Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя. Существует несколько способов выражения концентрации.
Массовая (процентная) концентрация С, % - отношение массы растворенного вещества к общей массе раствора, может быть выражена в долях единицы или в процентах. Массовая доля, выраженная в процентах, показывает, сколько граммов данного вещества содержится в 100 г раствора.
Молярная концентрация СМ, моль/л – отношение количества растворенного вещества (в молях) к объему раствора. Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают 1М раствор, соответственно при СМ = 0,05 моль/л раствор называют 0,05 М и т.д.
Молярная концентрация эквивалентов (нормальная концентрация или нормальность) Сн, моль/л – отношение количества вещества эквивалентов (моль) к объему раствора. Раствор, в одном литре которого содержится 1 моль эквивалентов вещества, называют нормальным и обозначают 1 н. или 1N. Соответственно могут быть 0,5 н. (0,5N), 0,01н. (0,01N) и т.п. растворы.
Моляльная концентрация (моляльность) С m , моль/кг – отношение количества растворенного вещества (в молях) к массе (m ) растворителя
(в килограммах).
Титр раствора Т, г/мл – отношение массы растворенного вещества
(в граммах) к объему раствора (в мл или в см3).
Пример 1. Вычислите: а) массовую (процентную) (С,%); б) молярную концентрацию (СМ); в) молярную концентрацию эквивалента (Сн);
г) моляльную (Cm) концентрацию раствора Н3Р04, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность раствора
r=1,031 г/см3. Чему равен титр Т этого раствора?
Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г. Следовательно:
300 г раствора содержат 18 г вещества
100 г раствора соответствуют С, %.
Отсюда: 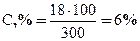 .
.
б) молярная (мольно-объемная) концентрация показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора m = V .r = 1031 г. Массу кислоты в литре раствора находим из соотношения:
300 г раствора содержат 18г Н3Р04
1031 г раствора – m г Н3Р04
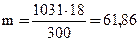 г.
г.
Молярную концентрацию раствора получим делением числа граммов Н3Р04 в 1 л раствора на молярную массу Н3Р04 (97,99 г/моль):
СМ = 61,86/97,99 = 0,63 М.
в) молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора.
Так как эквивалентная масса НзР04 mэ = М/3 = 97,99/3 = 32,66 г/моль, то
Сн = 61,86/32,66=1,89 н.;
г) моляльная концентрация (или моляльность) показывает число молей растворенного вещества, содержащихся в 1000 г растворителя. Массу Н3Р04 в 1000 г растворителя находим из соотношения:
282 г растворителя (воды) содержат 18 г Н3Р04,
1000 г растворителя - m г Н3Р04.
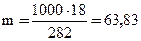 г.
г.
Отсюда Cm = 63,83/97,99 = 0,65 М.
Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты,
то Т= 61,86/1000 = 0,06186 г/см3.
Зная молярную концентрацию эквивалента Cн и молярную массу эквивалента (mэ) растворенного вещества, титр легко найти по формуле
T = Cн mэ / 1000.
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано
25 см3 0,5 н. раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной молярной концентрации эквивалентов реагируют в равных объемах. При разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальным концентрациям, т.е
V1 : V2 = Cн 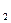 : Сн
: Сн 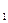 . или V1 . Cн
. или V1 . Cн 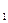 = V2 .Cн
= V2 .Cн 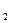
50 Cн 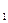 =25 . 0,5 , откуда Cн
=25 . 0,5 , откуда Cн 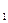 = 25 . 0,5 / 50 = 0,25 н.
= 25 . 0,5 / 50 = 0,25 н.
Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Решение. Масса одного литра 10%-ного раствора КОН равна 1092 г. В этом растворе содержится 1092 • 10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 • 0,5 = 522,5 г. В этом растворе содержится 522,5 - 5/100 = 26,125 г КОН.
В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярная концентрация раствора СМ = 135,325/(2 . 56,1) = 1,2 М,
где 56,1 г/моль — молярная масса КОН.
Пример 4. Какой объем 96%-ной кислоты плотностью 1,84 г/см" потребуется для приготовления 3 л 0,4 н. раствора?
Решение. Эквивалентная масса H2S04 = М/2 = 98,08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 н. раствора требуется 49,04 . 0,4 . 3 = 58,848 r H2S04. Масса 1 см3 96%-ной кислоты равна 1,84 г.
В этом растворе содержится 1,84 . 96/100 = 1,766 г H2S04.
Следовательно, для приготовления 3 л 0,4 н. раствора надо взять:
58,848 : 1,766 = 33,32 см3 этой кислоты.
КОНТРОЛЬНЫЕ ВОПРОСЫ
121. Вычислите молярную концентрацию и молярную концентрацию эквивалента 20%-ного раствора хлорида кальция плотностью 1,178 г/см3.
Ответ: 2,1 М; 4,2 н.
122. Чему равна молярная концентрация эквивалента 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую (процентную) долю полученного раствора.
Ответ: 9,96 н.; 6,3%.
123. К 3 л 10%-ного раствора НNО3 плотностью 1,054 г/см3 прибавили 5 л 2%-ного раствора той же кислоты плотностью 1,009 г/см3. Вычислите массовую (процентную) и молярную концентрации полученного раствора, объем которого равен 8 л.
Ответ:5,0%; 0,82 М.
124. Вычислите молярную концентрацию эквивалента и моляльную концентрацию 20,8%-ного раствора HNO3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора?
Ответ: 3,70 н.; 4,17 М; 931,8 г.
125. Вычислите молярную концентрацию эквивалента, молярную и моляльную концентрации 16%-ного раствора хлорида алюминия плотностью 1,149 г/см3.
Ответ: 4,14 н.; 1,38 М; 1,43 М.
126. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2S04 прибавить 125 см3 0,2 н. раствора КОН?
Ответ: 0,14 г КОН.
127. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgN03, потребуется 50 см3 0,2 н. раствора НС1. Какова молярная концентрация эквивалента раствора AgNO3? Какая масса AgCl выпала в осадок?
Ответ: 0,1 н.; 1,433 г.
128. Какой объем 20,01%-ного раствора НС1 (пл. 1,100 г/см3 ) требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3)?
Ответ: 485,38 см3.
129. Смешали 10 см3 10%-ного раствора НNО3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HN03(пл. 1,184 г/см3). Вычислите массовую (процентную) долю полученного раствора.
. Ответ28,38%.
130. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3).
Ответ: 245,5 см3.
131. Какой объем 10%-ного раствора карбоната натрия (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3).
Ответ: 923,1 см3.
132. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2S04? Чему равны молярная концентрация эквивалента и титр раствора Н3S04?
Ответ: 0,023 н.; 1,127.10-3 г/см3.
133. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3 ?
Ответ: 26,6 см3.
134. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты.
Ответ: 0,5 н.
135. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH?
Ответ: 0,882 г; 0,016 г/см3.
136. Какую массу NaN03 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор?
Ответ: 100 г.
137. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна массовая доля полученного раствора?
Ответ: 32,5%.
138. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова массовая доля полученного раствора?
Ответ: 45,72%.
139. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна массовая доля оставшегося раствора?
Ответ: 84%.
140. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна массовая доля охлажденного раствора?
Ответ: 16,7%.
Свойства растворов
Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (ΔТ) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
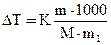 , (1)
, (1)
где К – криоскопическая или эбулиоскопическая константа. Для воды
они соответственно равны 1,86о и 0,52о;
m и М – соответственно масса растворенного вещества и его
молярная масса;
m1 – масса растворителя.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 42,529оС. Температура кипения сероуглерода 46,3оС. Вычислите эбулиоскопическую константу сероуглнрода.
Решение. Повышение температуры кипения ΔТ = 46,259 – 46,3 = 0,229о. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбулиоскопическую константу:
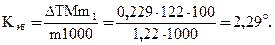
Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,279оС. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 0оС, следовательно, понижение температуры кристаллизации ΔТ = 0 – (– 0,279) = 0,279о. Масса глицерина m (г), приходящаяся на 1000 г воды, равна:
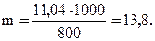
Молярную массу глицерина находим по формуле:
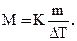 (2)
(2)
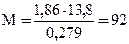 г/моль.
г/моль.
Пример 4. Вычислите массовую долю (%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна – 0,465оС.
Решение. Температура кристаллизации чистой воды 0оС, поэтому
ΔТ = 0 – (– 0,465) = 0,465о. Молярная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 1000 г воды, по формуле (2):
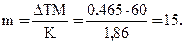
Общая масса раствора, содержащего 15 г мочевины, составляет
1000 = 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения:
в 1015 г раствора — 15 г вещества
в 100 г раствора — х г вещества
х = 1,48%.
КОНТРОЛЬНЫЕ ВОПРОСЫ
141. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296°С. Температура кристаллизации бензола 5,5 С. Криоскопическая константа 5,1°. Вычислите молярную массу растворенного вещества.
Ответ: 128 г/моль.
142. Вычислите массовую долю (%) водного раствора сахара C12H22O11, зная, что температура кристаллизации раствора - 0,93 °С. Криоскопическая константа воды 1,86.
. Ответ: 14,6%.
143. Вычислите температуру кристаллизации раствора мочевины (NН)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86°.
Ответ: - 1,03°С.
144. Раствор, содержащий 3,04 г камфоры С10Н16О в 100 г бензола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислите эбулиоскопическую константу бензола.
Ответ: 2,57о .
145. Вычислите массовую долю (%) водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,39°С. Эбулиоскопическая константа воды 0,52°.
Ответ: 6,45%.
146. Вычислите молярную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279°С. Крископическая константа воды 1,86о.
Ответ: 60 г/моль.
147. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2°С. Эбулиоскопическая константа его 2,57°.
Ответ: 81,25°С.
148. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0,465°С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86о
. Ответ: 342 г/моль.
149. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14 Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65оС.
Ответ: 3,9о .
150. При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°. Сколько атомов содержит молекула серы в этом растворе. Эбулиоскопическая константа бензола 2,57о
. Ответ: 8.
151. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0,558°С. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86о
. Ответ: 442 г/моль.
152. Какую массу анилина C6Н5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53о. Эбулиоскопическая константа этилового эфира 2,12о.
Ответ: 1,16 г.
153. Вычислите температуру кристаллизации 2%-ного раствора этилового спирта C2Н5OH. Криоскопическая константа воды 1,86°.
Ответ: -0,82°С.
154. Сколько граммов мочевины следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86о
. Ответ: 1,12 г.
155. Вычислите массовую долю (%) водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100,26оС. Эбулиоскопическая константа воды 0,52о.
Ответ: 8,25%.
156. Сколько граммов фенола следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7о? Криоскопическая константа бензола 5,1о.
Ответ: 3,91 г.
157. Сколько граммов мочевины (NH2)2CO следует растворить в 2 г воды, чтобы температура кипения повысилась на 0,26°? Эбулиоскопическая константа воды 0,52о.
Ответ: 7,5 г.
158. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372о. Вычислите молярную массу растворенного вещества. Криоскопическая константа воды 1,86°
. Ответ: 92 г/моль.
159. Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбулиоскопическая константа воды 0,52°.
Ответ: 101,52°С.
160. Вычислите массовую долю (%) водного раствора метанола СНзОН, температура кристаллизации которого -2,79оС. Криоскопическая константа воды 1,86о.
Ответ: 4,58%.
Дата: 2019-04-23, просмотров: 312.