Для понимания механизма формирования прочности важно ознакомиться с физико-химическими свойствами глин. Формовочные глины представляют собой дисперсную коллоидную систему с сильно развитой поверхностью. При смешивании глины с водой в глинистых суспензиях образуется коллоидный раствор. Коллоидные частицы (мицеллы) имеют вид, показанный на рис. 5.
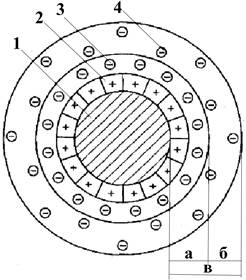
5. Схема мицеллы глины: a - адсорбционный слой; б - диффузионный слой; в - двойной электрический слой;
Около ядра мицеллы 1, т.е. глинистой частицы, располагаются ионы и возникают адсорбционный (а) и диффузионный (б) слои. Вместе они образуют двойной электрический слой (в). Противоионы 3, 4 находятся под действием электрического поля заряженной частицы и теплового движения жидкой фазы. Это приводит к динамическому распределению противоионов подобно облаку, плотность которого убывает по мере удаления от заряженной поверхности. Ионы располагаются вокруг внешних структурных единиц поверхности глины на ненасыщенных валентностях атомов кислорода в дефектных местах.
Коллоидальность характеризует способность глин к набуханию в воде. Степень набухания является важным показателем глин, особенно при использовании их в составе суспензий и противопригарных покрытий. Сильное влияние на коллоидальность оказывают количество и состав обменного комплекса глин. В глинах, содержащих в обменном комплексе многовалентные ионы Са, Mg и других элементов, мелкие частицы скоагулированы в агломераты большего или меньшего размера. Следовательно, чем больше таких ионов содержится в мицеллах глины, тем меньше ее коллоидальность. Если многовалентные ионы в мицеллах глины заменить одновалентными ионами натрия, то можно добиться более высокой дисперсности глинистых частиц.
Наиболее эффективными диспергаторами для глин различных месторождений являются натриевые соли сложных фосфорных кислот -Na4P2O7 и Na5P3O10. Максимальная коллоидальность достигается при определенном содержании диспергатора. При недостатке диспергатора катионы в обменном комплексе заменяются не полностью и частицы глины продолжают оставаться в виде агрегатов. При избытке диспергатора мицеллы глины перенасыщаются ионами натрия, что приводит к снижению электрокинетического потенциала системы вода - глина, и частицы глины слипаются между собой. Для бентонитовых глин, содержащих в обменном комплексе преимущественно катионы кальция и магния, наилучшим диспергатором является кальцинированная сода (Na2CO3).
Все глины имеют в кристаллической решетке два элемента (рис. 6). Один, толщиной 0,5 мм, состоит из двух слоев гидроксидов или ионов кислорода. Между ними на одинаковом расстоянии от шести ионов кислорода (или гидроксидов) в октаэдрической координации расположены ионы алюминия, железа или магния. Другой, толщиной 0,49 мм, состоит из кремнекислородных тетраэдров, в которых расположенный в центре ион кремния Si + окружен находящимися в вершинах тетраэдра четырьмя ионами кислорода. Тетраэдры образуют повторяющуюся гексагональную сетку (рис. 7), из которой в зависимости от способа соединения структурных элементов (октаэдров и тетраэдров) и их числа в элементарной ячейке глинистые минералы подразделяют на два типа. К минералам первого типа относится каолинит. В них число слоев кремнекислородных тетраэдров и алюмосиликатных октаэдров одинаково (рис. 7, а). В минералах второго типа, к которым относятся монтмориллонит и гидрослюды, в элементарной ячейке имеются три слоя: два слоя тетраэдров с расположенным между ними слоем октаэдров.
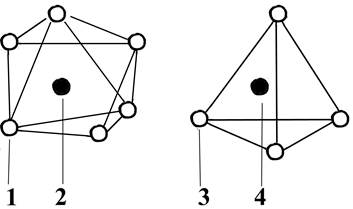
Рис. 6. Структурные элементы глин:
1 - гидроксил; 2 - Аl, Мg, Fe; 3 – кислород; 4 – Si
Химические формулы идеальных глинистых минералов обычно пишут двумя способами: в виде оксидов металлов в последовательности по возрастающей валентности до кремнезема с указанием в конце молекул воды или в виде структурных формул. Так, каолинит, монтмориллонит и мусковит показывают соответственно как
Al2O3 2SiO2 2H2O, Al2O3 4SiO2 H2O + n H2O, K2O 3Al2O3 6SiO2 2H2O
Глина имеет весьма сложное строение. Структуру глинистых минералов можно рассматривать как сочетание перемежающихся слоев различных групп атомов кислорода, кремния, алюминия, водорода, калия и др. Комбинация из этих слоев образует пакеты (рис. 7).
Пакет каолинита (рис. 7, а) состоит из слоя кремнекислорода тетраэдрической упаковки (в вершинах атомы кислорода, в центре — кремния) и гидроксильных групп, в которых в виде октаэдрической упаковки расположены атомы алюминия. Пакеты находятся на равном расстоянии друг от друга. Межплоскостное расстояние с составляет (7,13—7,2) 10-10 м. Ионы в каждом пакете каолинита (равно как и в других глинистых минералах) связаны между собой прочными валентными силами. Пакеты-соседи удерживаются друг с другом более слабыми водородными связями, возникающими между кислородом тетраэдров и водородом внешних ОН-групп. Пакеты электрически нейтральны.
Пакет монтмориллонита (рис. 7, б) состоит из трех слоев: двух кремнекислородных тетраэдрических, расположенных на внешних плоскостях, и одного внутреннего алюмокислородного с ОН-группами октаэдрической упаковки. Как и в каолините, здесь связь между ионами внутри пакета валентная, прочная. Взаимодействие пакетов осуществляется межмолекулярными (вандерваальсовыми) силами между одноименными внешними ионами кремнекислородного тетраэдра соседних пакетов. Это взаимодействие более слабое, чем в каолините (где действуют Н-связи). Такая взаимосвязь позволяет между пакетами проникать воде (+ n Н2О в формуле монтмориллонита), увеличивая межплоскостное расстояние с до 21,4-10-10 м [вместо (9,2...9,4) 10-10м у сухого бентонита], что вызывает набухание минерала при увеличении его объема в 10—15 раз.
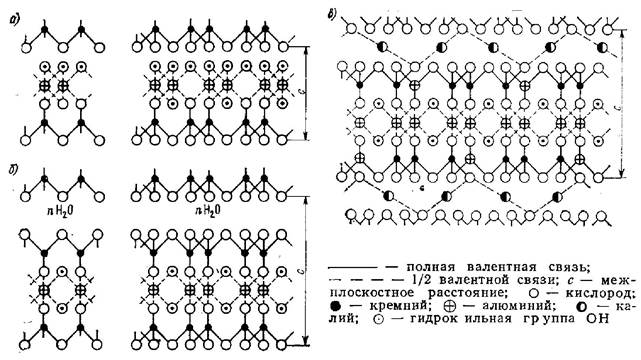
Рис. 7. Структура каолинита (а) , монтмориллонита (б) и мусковита(в).
Структура кристаллической решетки мусковита (рис. 7, в) имеет такой же вид, как и монтмориллонита, с той разницей, что вместо молекул воды между пакетами расположены ионы калия и каждый четвертый ион кремния в кремнекислородном тетраэдре замещен ионом алюминия в соответствии со структурной формулой K2O 3Al2O3 6SiO2 2H2O или KAl2 [Si3AlO10](OH)2
При замещении ионов кремния ионами алюминия образующийся недостаток зарядов компенсируется зарядами ионов калия, которые располагаются между пакетами в середине гексагональных пустот поверхностного кислородного слоя. Пакеты накладываются друг на друга так, что ион калия оказывается равноудаленным от 12 атомов кислорода (по 6 атомов от каждого пакета). Большим различием между структурой монтмориллонита и мусковита является то, что катион калия, компенсирующий заряд алюминия, очень прочно удерживается в пакете, не имея возможности проявлять обменных свойств. Кроме того, близкое соответствие между размерами ионного радиуса иона калия и гексагональных полостей кремнекислородных тетраэдров дает возможность осуществлять плотную упаковку с координационным числом 12. Следовательно, в мусковите между пакетами наблюдается валентная связь за счет ионов калия. Однако и здесь легче оторвать пакет от пакета, чем разорвать валентную связь внутри пакета. Межплоскостное расстояние с в мусковите составляет примерно 10∙10-10 м.
Наиболее слабые связи между пакетами у монтмориллонита, наиболее прочные — у мусковита, каолинит занимает промежуточное положение. Такое состояние со связями между пакетами тесно коррелирует с удельными поверхностями разбираемых глинистых минералов. Вот почему бентонит имеет наибольшую удельную поверхность, гидрослюдистые глины — наименьшую. Удельная поверхность, в свою очередь, в определенной степени характеризует прочностные способности глин, связанные с активными центрами глинистых минералов.
По мнению Р. И. Злочевской, активные центры в системе глина—вода, обладающие повышенной энергией, на частицах глины возникают следующим образом: каждый ион кристаллической решетки, находящийся внутри тела, имея какой-то заряд, окружен определенным числом ионов с зарядом противоположного знака, вследствие чего полностью насыщен связями с этими ионами. Такое положение нарушается на поверхности частиц, где возникают не скомпенсированные поверхностные заряды вследствие изоморфных замещений ионов решетки (выходящей на поверхность частицы) на ионы с меньшим зарядом, в углах и ребрах кристалла, в местах сколов. Кроме того, в определенных условиях молекулы поверхностных частиц глины диссоциируют на ионы, часть которых уходит в дисперсионную среду, другая часть остается на своем месте, нарушая электростатическое равновесие. Возникновение новых активных центров может иметь место также вследствие так называемой сверх эквивалентной избирательной адсорбции ионов из дисперсионной среды, когда часть заряда адсорбата остается не скомпенсированной. Еще одним источником образования активных центров является обмен водорода ОН-группы глинистой частицы на металлические ионы. Могут быть и другие источники появления активных центров на поверхности частиц глины.
Итак, в системе глина—вода на поверхности частиц глины имеет место наличие активных центров, интегрирование выражаемых нескомпенсированностью заряда, численное значение которого зависит от природы глины и характера дисперсионной среды (рН, температуры, состава растворенных веществ и др.).
Ионы, расположенные на внешних поверхностях пакетов глины, имеют менее прочные связи с основной решеткой кристалла, чем ионы внутренних слоев. Поэтому часть внешних ионов при соответствующих условиях может быть замещена другими ионами, находящимися в дисперсионной среде, без нарушения целостности кристаллической решетки. Это явление называют ионным обменом.
Ионный обмен схематически можно представить идущим по следующей реакции (
Х-глина + Yn+«Y-глина + Xn+
Смещение реакции вправо или влево зависит от природы и концентрации ионов Х и Y, а также от природы самой глины. Обменными ионами в глинах являются главным образом катионы натрия, калия, водорода, кальция и магния. Максимальное количество ионов, которое может быть замещено в глине, называют суммой обменных катионов, которая колеблется в следующих пределах (мг∙экв./100 г сухой глины): для каолиновых 10—35, гидрослюдистых 10—25 и монтмориллонитовых 35—135. Увеличение удельной поверхности приводит к увеличению суммы обменных катионов.
Ионный обмен в значительной степени изменяет химический состав глин. Так, при обмене ионы Si4+ замещаются ионами А13+ и далее — ионы А13+ — ионами Мg2+ или Са2+, последние, в свою очередь, могут быть замещены ионами К+ или Мg2+. Ионы решетки глинистого минерала переходят в раствор, из которого в несбалансированные по электронам ячейки поступают другие, имеющиеся в нем ионы. Если пакеты заряжаются зарядами одинаковых знаков, то они отталкиваются друг от друга, что ведет к самопроизвольному диспергированию. Такое явление наблюдается у бентонита.
При ионном обмене большое значение может иметь концентрация активных ионов водорода в промышленной воде, рН которой может изменяться от 5 до 7,5.
рН водопроводной воды составляет 9,6—10,7, рН влажного кварцевого песка — 5—8. Этот показатель необходимо систематически контролировать.
Для повышения эффективности использования глину необходимо подвергать химической активации, заключающейся в замене ионов Са, Мg, Fе, А1 диффузного слоя глинистой частицы на ион Nа. Это приводит к увеличению дисперсности глины, и, как следствие, к повышению ее связующей способности.
В настоящее время до 75 % отливок получают в песчаноглинистых формах, примерно половина из которых не подвергается сушке. Однако все формы должны обладать той или иной конструктивной прочностью.
Дата: 2019-05-29, просмотров: 430.