1. Қандай заттар электролиттер деп аталады?
1. ерітіндідегі еріген заттар электролиттер деп аталады
2. ерітіндідегі ион түрінде кездесетін заттар электролиттер деп аталады, мұндай ерітінді электр тогын өткізеді
3. ерітіндіде еріген қатты заттар электролиттер деп аталады
4. суда еріген газ тәрізді заттар электролиттер деп аталады
5. балқыған күйдегі қатты заттар электролиттер деп аталады
2. Қандай заттар күшті электролиттер деп аталады?
1. ерітіндіде толығымен иондарға ыдырайтын заттар күшті электролиттер деп аталады
2. суда нашар еритін күшті электролиттер деп аталады
3. суда нашар еритін барлық тұздар күшті электролиттер деп аталады
4. суда жақсы еритін барлық қатты заттар күшті электролиттер деп аталады
5. суда жақсы еритін барлық газ тәрізді заттар күшті электролиттер деп аталады
3. «Коллоидты бөлшектер» ұғымына анықтама беріңіз:
1. бөлшектердің мөлшері кәдімгі молекула мөлшерімен кіші бөлшектер
2. бөлшектердің мөлшері кәдімгі молекула мөлшерінен кіші, бірақ кішілігі сондай, ол ерітіндіде жүзгін түрінде бола алады
3. бөлшектердің мөлшері полюсті молекулалардың мөлшеріне жақын болатын бөлшектер
4. бөлшектердің мөлшері бір ангстремнен (10-8A) үлкен бөлшектер
5. бөлшектердің мөлшері үш ангстремге (3A) тең бөлшектер
4. Қандай ерітінділер қаныққан ерітінді деп аталады?
1. берілген температурадағы ерігіштігіне сәйкес келетін еріген заттың белгілі бір концентрациялық ерітіндісі
2. еріген заттың концентрациясы берілген температурадағы ерігіштігінен төмен болатын ерітінді
3. еріген заттың концентрациясы берілген температурадағы ерігіштігінен жоғары болатын ерітінді
4. 1г- моль зат еріген ерітінді
5. 2 г- моль зат еріген ерітінді
5. Қандай заттар әлсіз электролиттер деп аталады?
1. суда еріген кезде иондық ерітінді түзілетін заттар
2. суда ток өткізетін ерітінді түзілетін заттар
3. ерітіндіде біртіндеп иондарға жіктелетін заттар
4. иондық кристалдық тор құратын заттар
5. диполь-дипольдық өзара әрекеттесуге сәйкес келетін заттар
6. «Сольватация» ұіымының анықтамасын келтіріңіз:
1. сольватация-еріген зат молекулаларының өзара бірімен-бірі әрекеттесуі
2. сольватация-еріткіштің молекулаларының ион-дипольдық өзара әрекеттесуі
3. сольватация- еріткіш молекулаларының диполь-дипольдық өзара әрекеттесуі
4. сольватация- еріген зат бөлшектерінің еріткіш молекулаларымен әрекеттесуі
5. сольватация- ассоциатты гидраттар түзілетін процестер
7. «Гидратация» ұғымының анықтамасын көрсетіңіз:
1. гидратация – еріген зат бөлшектерінің су молекуласымен әрекеттесуі
2. гидратация –еріген зат молекулаларының еріткішпен әрекеттесуі
3. гидратация –су молекуласының еріген затпен қосылуы
4. гидратация –кристалогидраттардың суда еруі
5. гидратация –еріген зат молекулаларының диссоциацияға ұшырауы
8. Төменде көрсетілген электролиттердің қайсысы амфотерлік қасиет көрсетеді?
1. C2H6
2. H2SO4
3. NaOH
4. HCIO4
5. AI(OH)3
9. Төменде көрсетілген қосылыстардың қайсысы суда өзін әлсіз электролит ретінде көрсетеді?
1. HCI
2. LiOH
3. Ba(NO3)2
4. H2O2
5. NH4OH
10. «Кристаллизацияланған су» ұғымына анықтама беріңіз:
1. суда еріген тұздың сумен кристалдық қосылыс түзілуі
2. CuSO4×5H2O кристалдары құрамына кіретін гидратты су
3. суда еріген кешенді қосылыстар
4. тұздарда гидраттанған қабат түзілетін су
5. тұздардың иондармен әрекеттесетін су
11. Қандай ерітінді «қанықпаған ерітінді» деп аталады?
1. еріген заттың мөлшері, берілген температурадағы қаныққан ерітіндідегі заттың мөлшерінен аз болатын ерітінді
2. еріген заттың мөлшері берілген температурадағы заттың қаныққан ерітіндідегі заттың мөлшерінен көп болатын ерітінді
3. 1 моль зат еріген ерітінді
4. 5-20% еріген заты бар ерітінді
5. 1-10 г- моль зат еріген ерітінді
12. Ерітінділердің физикалық теориясының негізін қалаушы кім?
1. Ломоносов
2. Менделеев
3. Бертло
4. Лавуазье
5. Аррениус
13. Ерітінділердің химиялық теориясының негізін қалаушы кім?
1. Аррениус
2. Берцелиус
3. Менделеев
4. Каблуков
5. Бутлеров
14. Бейтарап ерітіндінің рН-ы нешеге тең?
1. рН>7
2. рН<7
3. рН=7
4. рН>14
5. рН=14
15 . «Индикатор» ұғымының физикалық мағынасы не?
1. сумен әрекеттесуші органикалық қышқылдар
2. сумен әрекеттесуші органикалық полимерлер
3. түсін өзгертетін бейорганикалық полимерлі қосылыстар
4. сутегі және гидроксил иондарының концентрациясына тәуелді ерітіндінің түсін өзгертетін әлсіз диссоциоцияланатын органикалық қышқылдар немесе негіздер
5. сулы ерітінділердің түсін өзгертетін органикалық негіздер
16. «Буферлік ерітінді» ұғымының физикалық мағынасын көрсетіңіз:
1. рН өзгертуші ерітінділер
2. ерітіндідегі [H+] иондарының өсуіне жағдай жасайтын ерітінділер
3. сұйылтқан кеде немесе қышқыл және сілтінің азғантай мөлшерін қосқан кезде сутек иондарының концентрациясын өзгертпей сақтайтын ерітінді
4. ерітіндідегі [H+] иондарының концентрациясының төмендеуіне жағдай жасайтын ерітінділер
5. белгілі уақыт ішінде [ОH-] иондарының концентрациясын өзгертпей сақтайтын ерітінділер
17. «Гидроксоний ионының» дұрыс формуласын көрсетіңіз:
1. ОН-
2. (OH-)2
3. (H2O2)-
4. H3O+
5. H+
18. Сутектік көрсеткіш рН мәнін қалай есептейді?
1. pH=lg[H+]
2. pH=10-14-pOH
3. pH=ln c[H+]
4. pH=-ln c[H+]
5. pH=10-14+pOH
19. Егер ерітіндіде сутек иондарының концентрациясын көбейтсе, рН сандық мәні қалай өзгереді?
1. рН өседі
2. гидроксид иондарының концентрациясы өседі
3. рН кемиді
4. ерітіндінің қышқылдығы азаяды
5. өзгермейді
20. Мына реакция Сг3++3OH- ® Cr(OH)3 жүру үшін қандай заттар алу керек?
1. Cr2(SO4)3, H2O
2. Cr2O3
3. CrCI3, NaOH
4. Cr2O3, AI(OH)3
5. Cr2(SO4)3
21. Қандай затты суға қосқаннан оның рН жетіден жоғарылайды, белгілеңіз:
1. Na2CO3
2. NaCI
3. AICI3
4. HCI
5. H2SO4
22. Гидролиздің белгілі өнімдеріне … ® Fe(OH)2+H+ қарап, реакция теңдеуінің сол жағын көрсетіңіз:
1. Fe2(CO3)3+H2O®
2. Fe(CH3COO)3+H2O®
3. FeCI3+H2O®
4. Fe(NO3)2+H2O®
5. FeCI2+H2O®
23. Мына қышқылдардың қайсысы күштірек?
1. H2CO3
2. H2SO3
3. H3PO4
4. H2SO4
5. H2S
24. Қышқыл немесе негіздің аздаған мөлшерін қосқаннан рН өзгермейтін ерітінді былай аталады:
1. қышқылдық
2. сілтілік
3. нейтралдық
4. буферлік
5. әлсіз негіздік
25. Генри заңының дұрыс тұжырымдамасын көрсетіңіз:
1. қысымның көлемге көбейтіндісі тұрақты шама болып табылады, PV=const
2. екі араласпайтын сұйықтардағы еріген заттардың концентрацияларының қатынасы тұрақты шама болап табылады, K=C1/C2
3. сұйықтағы газдың ерігіштігі ерітінді үстіндегі газ қысымына пропорционал, C(r)=k×P(r)
4. бейэлектролиттердің сұйытылған ерітіндісіндегі еріткіш бу қысымының төмендеу еріген заттың мольдік үлесіне тең, p0-p/ p0=NB, m0-m/m0=NB
5. аз еритін қосылыстың судағы ерігіштік көбейтіндісі тұрақты өлшем болып табылады.
26. Заттың суда ерігіштігіне әсер ететін факторларды көрсетіңіз:
1. ерітіндідегі беттік керілу күші
2. тығыздығы
3. сыну коэффициенті
4. еритін заттың табиғаты мен қасиеті, сонымен қатар температура және қысым
5. диссоциациялану дәрежесі
27. «Ерітіндінің молярлығы» ұғымының анықтамасын көрсетіңіз:
1. 1 л ерітіндідегі заттың моль санымен анықталатын ерітінді концентрациясы
2. 1 л ерітіндідегі заттың г-моль мөлшерімен анықталатын ерітінді концентрациясы
3. 100 г ерітіндідегі заттың г мөлшерімен анықталатын ерітінді концентрациясы
4. 1 кг еріткіштегі заттың массасымен анықталатын ерітінді концентрациясы
5. 1 кг еріткіштегі заттың г-моль мөлшерімен анықталатын ерітінді концентрациясы
28. Мына молекулалардың ішінен электролит емес молекуланы көрсетіңіз:
1. Na3PO4
2. HgCI2
3. BeCI2
4. C2H5OH
5. AgCI
29. «Ерітіндінің молялдығы» ұғымының анықтамасын көрсетіңіз:
1. 1 л ерітіндідегі заттың мольдік үлесі
2. 1 л ерітіндідегі заттың г-мольдік саны
3. 1 кг еріткіште еріген заттың моль саны
4. 100 г ерітіндідегі еріген заттың грамм саны
30. «Гидролиз» ұғымына анықтама беріңіз:
1. гидролиз -ерітіндінің рН өзгере отырып жүретін заттың сумен алмасу реакциясы
2. гидролиз-еріген заттың еріткіш молекулаларымен сольватациялану процесі
3. гидролиз-кристалогидраттардың түзілу процесі
4. гидролиз-еритін заттан судың бөліну процесі
5. гидролиз-тұз катионының сумен алмасу реакциясы.
31. «Ерігіштік көбейтіндісі» ұғымының дұрыс анықтамасын беріңіз:
1. ерігіштік көбейтіндісі -заттың суда жақсы еритін иондардың концентрациясының көбейтіндісі
2. ерігіштік көбейтіндісі -электролит ерітіндісіндегі аниондары мен катиондардың концентрациясының көбейтіндісі
3. ерігіштік көбейтіндісі- берілген температурадағы қаныққан ерітіндідегі аз еріген электролит иондарының концентрациясының көбейтіндісі
4. ерігіштік көбейтіндісі -[Н+] пен [ОН-] концентрацияларының көбейтіндісі
5. ерігіштік көбейтіндісі - ерітіндідегі тұз катиондары концентрациясының [Н+] концентрациясына көбейтіндісі
32. «Судың иондық көбейтіндісі» Kw ұғымының физикалық мағынасын көрсетіңіз:
1. Kw- ерітіндідегі катиондар концентрациясының көбейтіндісі
2. Kw- ерітіндідегі аниондар концентрациясының көбейтіндісі
3. Kw- диссоциацияланған молекулалардың концентрациясының көбейтіндісі
4. Kw- сутек және гидроксил иондарының концентрациясының берілген
температурадағы көбейтіндісі
5. Kw= [ОН-]2
33. Барлық тұздар гидролизге ұшырай ма?
1. гидролизге тек ауыр металдың тұздары ұшырайды
2. гидролизге тек құрамында әлсіз қышқылдың иондары немесе әлсіз негіздердің иондары кіретін тұздар ұшырайды
3. гидролизге тек сілтілік металдардың тұздары ұшырайды
4. гидролизге тек галогенсутек қышқылдардың тұздары ұшырайды
5. гидролизге тек оттекті қышқылдардың тұздары ұшырайды.
34. Қышқылдық және негіздік протолиттік теориясының авторын көрсетіңіз:
1. Усанович
2. Бренстед
3. Пирсон
4. Льюис
5. Измайлов
35. Қышқылдық және негіздік электронды теорияның авторын көрсетіңіз:
1. Бренстед
2. Франклин
3. Льюис
4. Усанович
5. Пирсон
36. Таза судағы сутек және гидроксил иондарының концентрациясы нешеге тең?
1. [Н+] > [ОН-]
2. [Н+] = [ОН-]=10-7
3. [Н+] <[ОН-]
4. [Н+] =10-8
5. [ОН-]=10-11
37. Полюсті заттар қай еріткіштерде жақсы ериді?
1. бензол
2. күкіртті көміртек
3. төрт хлорлы көміртек
4. сұйық аммиак
5. полярлы емес еріткіштерде
38. Қышқылдық күші өсу реті бойынша дұрыс қышқылдық қатарды таңдаңыз:
1. HCI > CH3COOH> H3PO4> H2SO4
2. H2SO4 > HCI > CH3COOH > H3PO4
3. H2SO4>HCI > H3PO4> CH3COOH
4. HCI > H2SO4> H3PO4>CH3COOH
5. CH3COOH >HCI > H2SO4> H3PO4
39. NaHPO4 ерітіндісінің pH мәнін көрсетіңіз:
1. pH=7
2. pH>7
3. pH<7
4. pH>14
5. pH<1
40. ҒеСІ3 ерітіндісінің рН мәнін көрсетіңіз:
1 pH=1
2. pH>7
3. pH<7
4. pH=7
5. pH=14.
41. Әлсіз электролиттер болатын қосылыстарды көрсетіңіз:
1. K2CO3, H2CO3, NH4OH
2. KOH, CaCI2, HCN
3. CH3COOH, NH4OH, HCIO4
4. H2S, NH4OH, CH3COOH
5. NaOH, K2CO3, CH3COOH
42. Алюминий нитраты ерітіндісінің ортасы мынадай болады:
1. сілтілік
2. нейтралдық
3. қышқылдық
4. әлсіз қышқылдық
5. әлсіз негіздік
43. Лабораториялық жағдайда органикалық еріткішті еріген заттан былай бөлуге болады:
1. декантациялау
2. айдау
3. сүзу
4. тұндыру
5. буландыру
44. Қыста жер тайғақ болғанда, мұздаған жолдарға NaСІ және СаСІ2 себеді, сонда мұз ериді. Бұл мына жағдаймен түсіндіріледі:
1. таза суға қарағанда қату температурасы жоғары ерітінді түзіледі
2. таза суға қарағанда қату температурасы төмен ерітінді түзіледі
3. жылу бөлінеді
4. жылу сіңіріледі
5. кристаллогидраттар алынады
45. Темір (ІІІ) хлориды ерітіндісінің гидролизін тоқтату немесе баяулату үшін мына заттардың қайсысын аздап қосу керек?
1. тұз қышқылы
2. калий гидроксиді
3. NaСІ (қатты)
4. Н2O (дист.)
5. Ғе(ОН)3
46. Ерітіндінің рН 5 - ке тең. Ондағы сутек иондарының концентрациясы (моль/л) мынаған тең:
1. 1,0×10-14
2. 1,0×10-5
3. 5,0
4. 9,0
5. 14,0
47. Аяғына дейін жүретін реакцияны белгілеңіз:
1. Na2SO4+KCl®
2.Cr(NO3)2+Na2SO4®
3.NaNO3+KOH®
4. H2SO4+BaCI2®
5. NaCI+K2SO4®
48. Су ерітіндісінде гидроксид аниондарының концентрациясы 10-3 М тең. Осы ерітіндінің pH нешеге тең және ортасы қандай?
1. pH=3, қышқылдық
2. pH=3, сілтілік
3. pH=11, қышқылдық
4. pH=7, бейтарап
5. pH=11, сілтілік
49. Гидролиз реакциясын көрсетіңіз:
1. NH4CI+HOHÛNH4OH+HCI
2. NH4CI+KOHÛNH4OH+KCI
3. NH4OH+HCIÛNH4CI+HOH
4. NH4OHÛNH4++OH-
5. NH4CIÛNH4++CI-
50. Сутектік көрсеткіш рН мәні бойынша су ерітіндісінің күшті қышқылдық ортасын анықтаңдар:
1. pH=6
2. pH=5
3. pH=4
4. pH=3
5. pH=1
9. Кешенді қосылыстар
1. Мына [Ғе(Н2О)6]СІ3 кешенді қосылысты атаңыз:
1. аквогексаферрат (ІІІ) хлорид
2. гексааквотемір (ІІІ) хлорид
3. гексааквоферрум (ІІІ) хлорид
4. гексааквоферрат (ІІІ) хлорид
5. трихлоридаквоферрат (ІІІ)
2. Мына қосылыстан [Ғе(Н2О)6]СІ3 ионның координациялық санын (к.с.), кешен түзушінің зарядын (к.т.з.) және кешенді ионның зарядын (к.и.з.) анықтаңыз:
1. к.с.6; к.т.з. (+3); к.и.з. (+3)
2. к.с.6; к.т.з. (-3); к.и.з. (+3)
3. к.с.6; к.т.з. (+3); к.и.з. (-3)
4. к.с.6; к.т.з. (-3); к.и.з. (-3)
5. к.с.6; к.т.з. (+6); к.и.з. (+4)
3. Кешенді ионның [Ғе(Н2О)6]+3 магниттік қасиеті қандай және қанша жұптаспаған электроны бар?
1. парамагнитті, бес жұптаспаған электрондар
2. диамагнитті, бір жұптаспаған электрон
3. бір жұптаспаған электрон, парамагнитті
4. бес жұптаспаған электрондар, диамагнитті
5. төрт жұптаспаған электрондар, диамагнитті.
4. Мына кешенді иондағы [Ғе(Н2О)6]+3 гибридизация түрін көрсетіңіз:
1.
 | |  |
3d 4s 4p
2. d2sp3
3. sp3
4. sp3d2
5. dsp2
5. [Ғе(Н2О)6]СІ3 кешенді қосылыстағы тұрақсыздық константасының формуласын көрсетіңіз:
1. 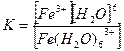
2. 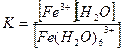
3. 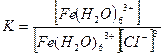
4. 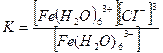
5. 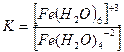
6. Координациялық саны 6 болатын кешендің кеңістіктік құрылысы қандай?
1. октаэдр
2. тетраэдр
3. куб
4. бипирамида
5. жазық квадрат
7. Кешенді қосылысты К3[Ғе(CN)6] атаңыз:
1. калий цианогексаферриті (ІІ)
2. калий гексацианоферраты (ІІІ)
3. калий гексацианотемірі (ІІІ)
4. калий гексацианоферрумы (ІІ)
5. калий цианоферрум (ІІ)
8. К3[Ғе(CN)6] қосылысының координациялық санын (к.с.), кешен түзушінің зарядын (к.т.з.) және кешенді ион зарядын (к.и.з.) анықтаңыз:
1. к.с.6; к.т.з. (+2); к.и.з. (+3)
2. к.с.6; к.т.з. (+3); к.и.з. (-3)
3. к.с.6; к.т.з. (-3); к.и.з. (+3)
4. к.с.6; к.т.з. (+2); к.и.з. (+4)
5. к.с.6; к.т.з. (+4); к.и.з. (+3)
9. [Ғе(CN)6]3- кешенді ионының магниттік қасиеті қандай және қанша жұптаспаған электроны бар?
1. парамагнитті, жұптаспаған электрондары жоқ
2. диамагнитті, жұптаспаған электроны төртеу
3. парамагнитті, бір жұптаспаған электроны бар
4. диамагнитті, жұптаспаған электрондары жоқ
5. парамагнитті, бес жұптаспаған электрондары бар
10. Координациялық саны 4 болатын кешенді қосылыстың кеңістіктік құрылысы қандай?
1. тетраэдр
2. октаэдр
3. бипирамида
4. куб
5. жазық квадрат
11. Na3[CoF6] кешенді қосылысын атаңыз:
1. натрий гексафторокобальты (ІІІ)
2. натрий гексафторокобальты (ІІ)
3. натрий гексафторокобальтаты (ІІІ)
4. натрий гексафторокобальты (ІІ)
5. натрийгексакобальтфтор (І).
12. Na3[CoF6] кешенді қосылысының координациялық санын (к.с.), кешен түзуші зарядын (к.т.з.) және кешенді ион зарядын (к.и.з.) анықтаңыз:
1. к.с.6; к.т.з. (+3); к.и.з. (-3)
2. к.с.3; к.т.з. (+3); к.и.з. (+3)
3. к.с.6; к.т.з. (-3); к.и.з. (+3)
4. к.с.6; к.т.з. (-3); к.и.з. (-3)
5. к.с.5; к.т.з. (+2); к.и.з. (+4)
13. K3[Co(CN)6] кешенді қосылысты атаңыз:
1. калий гексацианокобальты (ІІІ)
2. калий гексацианокобальтаты (ІІІ)
3. калий гексацианокобальты (ІІ)
4. калий гексацианокобальтиаты
5. калийцианокобальтаты (ІІІ).
14. K3[Co(CN)6] қосылысының координациялық санын (к.с.), кешен түзушінің зарядын (к.т.з.) және кешенді ион зарядын (к.и.з.) анықтаңыз:
1. к.с.6; к.т.з. (+3); к.и.з. (+3)
2. к.с.4; к.т.з. (-3); к.и.з. (+3)
3. к.с.6; к.т.з. (+3); к.и.з. (-3)
4. к.с.6; к.т.з. (-3); к.и.з. (-3)
5. к.с.6; к.т.з. (+4); к.и.з. (-4)
15. [Co(CN)6]3-кешенді ионында неше жұптаспаған электрон бар екенін анықтап, магниттік қасиетін сипаттаңыз:
1. диамагнитті, жұптаспаған электрондары жоқ
2. парамагнитті, жұптаспаған электроны біреу
3. диамагнитті, жұптаспаған электрондары екеу
4. парамагнитті, жұптаспаған электрондары жоқ
5. парамагнитті, жұптаспаған электрондары алтау
16. Кристалдық өріс теориясын қолдана отырып [Co(CN)6]3- ионындағы кешен түзушінің электрондық конфигурациясын көрсетіңіз:
1. жоғары спинді конфигуация
2. төменгі спинді конфигурация, жұптаспаған электрондары жоқ
3. 1 жұптаспаған электроны бар, төменгі спинді конфигурация
4. 5 жұптаспаған электронды, төменгі спинді конфигурация
5. жұптаспаған электрондары жоқ, төменгі спинді
 | |||||
| |  | ||||
4d 4s 4p
17. [ Cr(NH3)4(H2O)2 ] CI3 қосылысын атаңыз:
1. тетрааминдиаквохромиат (ІІІ) хлорид
2. диаквотетраамиохром (ІІІ) хлорид
3. диаквотетрааминохром (ІІ) хлорид
4. тетрааминдиаквохромит (ІІ) хлорид
5. аквоаминохлоридхром (ІІ).
18. [ Cr(NH3)4(H2O)2 ] CI3 қосылысының координациялық санын (к.с.), кешен түзушінің зарядын (к.т.з.) және кешен ионының зарядын (к.и.з.) анықтаңыз:
1. к.с.6; к.т.з. (+3); к.и.з. (+3)
2. к.с.4; к.т.з. (+3); к.и.з. (-3)
3. к.с.2; к.т.з. (+3); к.и.з. (+3)
4. к.с.6; к.т.з. (-3); к.и.з. (-3)
5. к.с.5; к.т.з. (+4); к.и.з. (+4)
19. [ Cr(NH3)6 ] 3+ кешенді ионның магниттік қасиетін сипаттаңыз және неше жұптаспаған электроны бар екенін анықтаңыз:
1. диамагнитті, жұптаспаған электроны біреу
2. парамагнитті, жұптаспаған электроны жоқ
3. диамагнитті, жұптаспаған электроны екеу
4. жұптаспаған электроны үшеу, диамагнитті
5. жұптаспаған электроны біреу, парамагнитті
20. K2 [ PtCI6 ] кешенді қосылысының дұрыс аталуын көрсетіңіз:
1. калий гексахлороплатинаты (IV)
2. калий гексахлороплатина (IV)
3. калий гексахлороплатиниті
4. калий гексахлороплатина (ІІ)
5. калий пентахлороплатиниат
10. Тотығу-тотықсыздану реакциялары
1. «Тотығу процесі» ұғымының дұрыс тұжырымдамасын көрсетіңіз:
1. электронды беру арқылы тотықсыздандырғыштың тотығу дәрежесі төмендейтін процесс
2. электронды беру арқылы тотықсыздандырғыштың тотығу дәрежесі жоғарылайтын процесс.
3. тотықсыздандырғыштың тотығу дәрежесі өзгермейтін процесс
4. электронның қосылуынан тотықтырғыштың теріс тотығу дәрежесі жоғарылайтын процесс.
5. электронның қосылуынан тотықтырғыштың оң тотығу дәрежесі төмендейтін процесс.
2. «Тотықсыздану процесі» ұғымының дұрыс тұжырымдамасын көрсетіңіз:
1. электронның қосылуынан тотықтырғыштың тотығу дәрежесі төмендейтін процесс
2. электроның қосылуынан тотықтырғыштың тотығу дәрежесі жоғарылайтын процесс.
3. тотықтырғыштың да, тотықсыздандырғыштың да тотығу дәрежесі өзгермейтін процесс
4. электронның алынуынан тотықсыздандырғыштың оң тотығу дәрежесі жоғарылайтын процесс.
5. электронның алынуынан тотықсыздандырғыштың оң тотығу дәрежесі төмендейтін процесс.
3. Төменде келтірілген реакциялардың қайсысы тотығу-тотықсыздану реакциялары?
1. NaOH+H2SO4®
t0
2. CuCO3®
3. BaCI2+ H2SO4®
t0
4. KCIO3 ®
5. CaO+H2O ®
4. Тотығу-тотықсыздану реакцияларын белгілеңіз:
1. KOH+HCI®
2. H2S+HNO3+H2O ®
3. AgCI+NH3+H2O®
4. BF3+HF®
5. H2S+NaOH®
5. Тотығу-тотықсыздану реакцияларын анықтау керек:
1. Zn+HCI ®
t0
2. CaCO3®
3. Ba(OH)2+H2SO4 ®
4. Na3 PO4+H2SO4®
5. HNO3+KOH®
6. Төмендегі реакциялар арасынан тотығу-тотықсыздану реакцияларын белгілеу керек:
1. Mg(OH)2 +H2SO4 ®
2. CI2+H2O ®
3. CaO+SO3 ®
4. Cr2O3+H2O®
5. SiO2+H2O®
7. Төменде берілген заттардың ішінен тотықсыздандырғышты белгілеу керек:
1. Fe2O3
2. KMnO4
Mg
4. P2O5
5. K2Cr2O7
8. Тотықсыздандырғыш бола алатын затты анықтаңыз:
1. O2
2. SO3
3.I2
4. Fe(OH)2
5. Ca(OH)2
9. Мына заттардың арасынан тотықсыздандырғышты белгілеңіз:
1. O3
2. KCIO4
3. Na2Cr2O7
4. Na2S2O3
5. BaSO4
10. Төменде берілген заттардың арасында тотықтырғыш бар ма?
1. H2
2. C
3. Al2O3
4. O2
5. MgCI2
11. Тотықтырғыш бола алатын затты белгілеңіз:
1. Zn
2. KMnO4
3. KCI
4. Ba
5. Na2SO4
12. Тотықтырғышты белгілеу керек:
1. СаСО3
2. SiO2
3. K2Cr2O7
4. Zn(NO3)2
5. MgSO4
1 3. Na3PO3 қосылысындағы фосфордың тотығу дәрежесін анықтаңыз:
1. +1 2.+2 3. +3 4. +4 5. +5
14. КСІО3 қосылысындағы хлордың тотығу дәрежесін анықтаңыз:
1. +1 2.+2 3. +3 4. +4 5. +5
15. Су ерітіндісіндегі галогенсутек қышқылдары НҒ-НСІ- НВг-НІ қатарында тотықсыздандығыш белсенділігі қалай өзгеретінін көрсетіңіз:
1. НҒ®НІ қатарында тотықсыздандырғыш белсенділігі төмендейді
2. берілген қатарда тотықсыздандырғыш белсенділігі артады
3. берілген қатарда тотықсыздандырғыш белсенділігі өзгермейді
4. көрсетілген қышқылдардың ешқайсысы тотықсыздандырғыш белсенділікті көрсетпейді
5. берілген қатарда тотықсыздандырғыш белсенділігі тек органикалық еріткіш ортасында ғана анықталады.
16. Молекулааралық тотығу-тотықсыздану реакциясына жататын реакция теңдеуін көрсету керек:
1. Na2SO4+BaCI2®BaSO4+2NaCI
2. Fe+CuSO4=FeSO4+2H2O
3. KOH+H2SO4®K2SO4+2H2O
4. KCIO3®2KCI+3O2
5. K2Cr2O7+3Na2SO4+4H2SO4=Cr(SO4)3+K2SO4+3Na2SO4+7H2O
1 7. Мына реакциялардың ішінен молекула ішіндегі тотығу-тотықсыздану реакцияларын белгілеңіз:
1. 2HgO®2Hg+O2
2. BaCI2+2NaOH®Ba(OH)2+NaCI
3. NaOH+HCI®NaCI+2H2O
4. Mg+O2®MgO
5. 2SO2+O2®2SO3
1 8. Өзіндік тотығу-өзіндік тотықсыздану (диспропорциялану) реакциясын көрсетіңіз:
1. Zn+HCI=ZnCI2+H2
2. CI2+2NaOH=NaCI+NaCIO+H2O
3. BaCI2+Na2SO4=Ba2SO4+2NaCI
4. 2Hg=2Hg+O2
5. 6KI+2KMnO4+4H2O=3I2+2MnO2+8KOH
1 9. Тек қана тотықтырғыш болатын заттарды көрсетіңіз:
1. құрамында тотығу дәрежесі максимал элементтер атомы бар қосылыстар
2. барлық ауыспалы металдар
3. сілтілік және сілтілік-жер металдар
4. сутек
5. көміртек (кокс), СО
20. Тотығу-тотықсыздану реакцияларын теңестіру әдістерін көрсетіңіз:
1. иондық реакциялар әдісі
2. жартылай реакция әдісі
3. электронды баланс және жартылай реакция әдісі
4. ионды-электронды баланс әдісі
5. тепе-теңдік константаларының шамасын салыстыру әдісі.
21. «Тотықсыздандырғыш» ұғымының дұрыс анықтамасын белгілеңіз:
1. тотықсыздандырғыш- тотығу-тотықсыздану реакциясы нәтижесінде тотықсызданған түрге ауысады
2. тотықсыздандырғыш-тотығу-тотықсыздану реакциясы нәтижесінде тотыққан түрге ауысады
3. тотықсыздандырғыш-тотығу-тотықсыздану реакциясы нәтижесінде тотығу дәрежесін өзгертпейді.
4. тотықсыздандырғыш-тотығу-тотықсыздану реакциясы нәтижесінде негіздік және қышқылдық оксидтерге ыдырайды.
5. тотықсыздандырғыш-тотығу-тотықсыздану реакциясы нәтижесінде қиын еритін тұз түзеді.
22.Галогендердің тотығу дәрежесі қалай өзгереді?
1. -1- ден +1-ге дейін
2. -1-ден +7-ге дейін
3. 0-ден +5-ге дейін
4. -1-ден +3-ге дейін
5. +1-ден +7-ге дейін
23. Тотығу -тотықсыздану реакциясы нәтижесінде VA (N, P, As, Sb, Bi) тобы элементтерінің тотығу дәрежесі қалай өзгереді?
+3
1. -1- ден ¾® +5-ге дейін
+2
2. -4-тен ¾® +6-ға дейін
+3
3. - 3 -тен ¾® +5-ке дейін
+3
4. -2-ден ¾® +7-ге дейін
5. тотығу дәрежесі тұрақты +5.
24. Тотығу –тотықсыздану реакциясы нәтижесінде VIIA тобының элементтерінің (F, CI, Br, J, At) тотығу дәрежесі қалай өзгереді?
+4,+3,+5,
1. -1- ден ¾® +7-ге дейін
+1,+3,+5,
2. -1-ден ¾® +7-ге дейін, тотығу дәрежесі барлық элементтермен тұрақты -1 болатын, фтордан басқалары
+5
3. +3-тен ¾® +7-ке дейін
+3
4. -1-ден ¾® +5-ге дейін
+3
5. +1-ден ¾® +6-ге дейін
25. Қандай зат «тотықсыздандырғыш» деп аталады?
1. құрамына тотықсызданатын элемент кіретін зат
2. құрамына тотығатын элемент кіретін зат
3. құрамына тотығу дәрежесі +7 болатын элемент кіретін зат
4. құрамына тотығу дәрежесі төмен элемент кіретін зат
5. құрамына тотығу дәрежесі өзгермейтін элемент кіретін зат
26. Қандай затты «тотықтырғыш» деп атауға болады?
1. құрамына тотықсызданушы элемент кіретін зат
2. құрамына тотығатын элемент кіретін зат
3. құрамында тотығу дәрежесі екіге тең болатын элемент кіретін зат
4. құрамына тотығу дәрежесі нөлге тең болатын элемент кіретін зат
5. құрамында тотығу дәрежесі тұрақты элемент кіретін зат
27. Металдардың қандай қосылыстары тотықтырғыш бола алады?
1. металдың тотығу дәрежесі нөлге тең болатын қосылыстар
2. металдың тотығу дәрежесі теріс болатын қосылыстар
3. металдың тотығу дәрежесі топтың нөміріне тең қосылыстар
4. металдың тотығу дәрежесі (+1) тең болатын қосылыстар
5. металдың тотығу дәрежесі (+1) –ден (-1) –ге дейін өзгеретін қосылыстар
28. Молекула ішіндегі тотығу–тотықсыздану реакциясын көрсетіңіз:
1. 2Mg+O2=2MgO
2. 5KNO2+2KMnO4+6H2SO4¾®2MnSO4+5KNO3+K2SO4
3. CI2+H2O¾®HCI+HCIO
4. NaAsO2+J2+4NaOH=Na2AsO4+2H2O+2NaJ
5. Ba(OH)2+H2SO4¾®BaSO4+2H2O
29. Өзіндік тотығу–өзіндік тотықсыздану реакциясын көрсетіңіз:
1. 2NaI+CI2¾®2NaCI+J2
2. MgSO4+2NaOH¾®Mg(OH)2+Na2SO4
3. CI2+H2O¾®HCI+HCIO
4. 2KMnO4+5Na2SO4+8H2SO4¾®2MnSO4+5Na2SO4+K2SO4+8H2O
5. 4NH4+3O2¾®2N2+6H2O
ҚОСЫМШАЛАР
1. Фундаментальды физикалық және физико-химиялық тұрақтылар
Массаның атомдық бірлігі м. а. б., mu = 1,66·10-27 кг
Нейтронның тыныштық массасы mn = 1,675·10-27 кг
Протонның тыныштық массасы mр = 1,673·10-27 кг
Электронның тыныштық массасы mе = 9,11·10-31 кг
Идеальдық газдың молярлық көлемі:
қалыпты жағдайда VМ = 2,241·10-2 м3/моль = 22,4 л/моль
стандартты жағдайда VоМ = 2,447·10-2 м3/моль = 24,5 л/моль
Планк тұрақтысы h = 6,63·10-34 Дж·с
Фарадей тұрақтысы F = 9,65·104 Кл/моль
Бор радиусы (бор) а0 = 5,29·10-11 м
Жарық жылдамдығы с = 3,00·108 м/с
Стандартты температура 298,15 К (25оС)
Стандартты қысым 1,013·105 Па (1 атм)
Молярлық газ тұрақтысы R = 8,314 Дж/(К·моль)
Авогадро саны NА = 6,02·1023
Электр тұрақтысы ε0 = 8,85·10-12 Кл/(В·м)
Элементар электр заряды е = 1,602·10-19 Кл
Қалыпты физикалық жағдайлар :
273,15 К (0оС), 101,3кПа (760 мм сын. бағ., 1033 кг/см2, 1036 м су бағ., 1 атм)
Стандартты жағдайлар:
298,15 К (25оС), 101,3кПа (760 мм сын. бағ., 1033 кг/см2, 1033 м су бағ., 1 атм)
2. Жай заттардың тығыздығы , г/см3
| зат | ρ, г/см3 | зат | ρ, г/см3 | зат | ρ, г/см3 |
| Ag Al Au Ca Co | 10,5 2,7 19,32 1,54 8,84 | Cr Cu Fe Ni Sc | 7,19 8,96 7,87 8,90 3,0 | Sn Sr Ti Tl | 7,30 2,63 4,51 11,85 |
3. Энергия бірліктерінің арасындағы қатынастар
| Дж | кал | эВ | |
| Дж кал эВ | 1 4,18 1,60·10-19 | 0,24 1 3,82·10-20 | 6,24·1018 2,62·1019 1 |
4. Ат о мдардың салыстырмалы электртерістігі
(Полинг бойынша )
| I | II | III | IV | V | VI | VII |
| H 2,1 Li 1 Na 0,9 K 0,8 R b 0,8 Cs 0,7 | Be 1,5 Mg 1,2 Ca 1,0 Zn 1,6 Sr 1,0 Ba 0,9 | B 2,0 Al 1,5 Sc 1,3 Ga 1,6 Y 1,3 In 1,5 | C 2,5 Si 1,8 Ti 1,6 Ge 1,7 Zr 1,6 Sn 1,7 | N 3,0 P 2,1 As 2,0 Sb 1,8 | O 3,5 S 2,5 Se 2,4 Te 2,1 | F 4,0 Cl 3,0 Br 2,8 I 2,6 |
5. Элемент атомдарының иондану потенциалы (ИП) және электронға ынтықтығы (СЭ)
| элемент | ИП1, эВ | ИП2, эВ | СЭ, эВ | элемент | ИП1, эВ | ИП2, эВ | СЭ, эВ |
| H He Li Be B C N O F Ne Na Mg Al Si P | 13,6 24,6 5,4 9,3 8,3 11,3 14,5 13,6 17,4 21,6 5,1 7,7 6,0 8,2 10,5 | 54,4 75,6 18,2 25,2 24,4 29,6 35,1 35,0 41,1 47,3 15,0 18,8 16,3 19,7 | +0,8 -0,2 +0,6 -0,2 +0,3 +1,3 -0,2 1,5 3,5 -0,6 0,3 -0,2 0,5 1,8 0,8 | S Cl Ar K Ca Ga Ge As Se Br Kr I Cs Ba | 10,4 13,0 15,8 4,3 6,1 6,0 7,9 9,8 9,8 11,8 14,0 10,5 3,9 5,2 | 23,4 23,8 27,6 31,8 11,9 20,5 15,9 18,6 21,2 21,8 24,4 19,1 25,1 10,0 | 2,1 3,6 -0,4 0,5 -1,9 0,4 1,7 0,6 2,0 3,4 -0,4 3,1 0,4 -0,5 |
6. Қосылыстардың байланыс ұзындығы және дипольдік моменті μ , D
(1 D =3,34·10-30 Кл · м)
| қосылыс | dбайл, пм | μ, D | қосылыс | dбайл, пм | μ, D |
| BrCl | 213,6 | 0,57 | NaCl | 236 | 10,0 |
| BrF | 176 | 1,29 | NaI | 271 | 8,5 |
| ClF | 163 | 0,65 | NO | 115 | 0,16 |
| HCl | 128 | 1,08 | H2O | 96 | 1,86 |
| HBr | 141 | 0,79 | 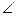 HOH=104,5o HOH=104,5o
| ||
| HI | 161 | 0,42 | NH3 | 103 | 1,46 |
| LiBr | 217 | 6,2 | 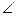 HNH=107o HNH=107o
| ||
| LiF | 156 | 6,6 |
| ||
7. Заттардың стандартты түзілу жылуы  Но, энтропия сы So және түзілу Гиббс энергиясы
Но, энтропия сы So және түзілу Гиббс энергиясы 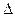 Go
Go
| Зат | 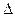 Но,
кДж/моль Но,
кДж/моль
| So, Дж·моль-1·К-1 | 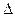 Gо,
кДж/моль Gо,
кДж/моль
|
| Al(т) | 0 | 28 | 0 |
| Al2O3(т) | -1675 | 51 | -1582 |
| As2O3(т) | -666 | 117 | -588 |
| As2O5(т) | -925 | 105 | -782 |
| В(т) | 0 | 6 | 0 |
| В(г) | +562 | 152 | +518 |
| В2O3(т) | -1272 | 54 | -1193 |
| ВаСО3(т) | -1201 | 112 | -1123 |
| ВаСl2(т) | -845 | 124 | -797 |
| Br2(ж) | 0 | 152 | 0 |
| Br2 (г) | +31 | 245 | +3 |
| Br(г) | +112 | 175 | +82 |
| C(графит) | 0 | 6 | 0 |
| C(алмаз) | +2 | 2 | +3 |
| C(г) | +715 | 158 | +670 |
| CH4(г) | -75 | 186 | -51 |
| CO(г) | -110 | 198 | -137 |
| CO2(г) | -393 | 214 | -394 |
| CS2(ж) | +88 | 151 | +64 |
| CS2(г) | +117 | 238 | +67 |
| СаСO3(т) | -1207 | 88 | -1127 |
| СаO(т) | -635 | 40 | -604 |
| Cl2 | 0 | 223 | 0 |
| Cl(г) | +122 | 165 | +106 |
| Cl-(г) | -234 | 153 | -240 |
| Cr(т) | 0 | 24 | 0 |
| Cr2О3(т) | -1141 | 81 | -1059 |
| Cs+( г) | +460 | 170 | +428 |
| Cu(т) | 0 | 33 | 0 |
| CuO(т) | -156 | 43 | -128 |
| F2(г) | 0 | 203 | 0 |
| F(г) | +79 | 159 | +62 |
| Fe(т) | 0 | 27 | 0 |
| Fe2О3(т) | -824 | 87 | -742 |
| Fe3О4(т) | -1118 | 146 | -1015 |
| FeS2(т) | -174 | 53 | -163 |
| H2(г) | 0 | 131 | 0 |
| H(г) | 218 | 115 | 203 |
| HBr(г) | -36 | 199 | -53 |
| Зат | 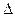 Но,
кДж/моль Но,
кДж/моль
| So, Дж·моль-1·К-1 | 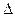 Gо,
кДж/моль Gо,
кДж/моль
|
| HCl(г) | -92 | 187 | -95 |
| HF(г) | -217 | 174 | -273 |
| H2O(ж) | -286 | 70 | -237 |
| H2O(г) | -242 | 189 | -229 |
| H2O2(ж) | -187 | 110 | -120 |
| H2O2(р) | -191 | 143 | -134 |
| H2S(г) | -21 | 206 | -34 |
| H2Se(г) | +30 | 219 | +16 |
| I2(т) | 0 | 116 | 0 |
| I2(г) | +62 | 261 | +19 |
| I2(ж) | +22 | 137 | +16 |
| I(г) | +107 | 181 | +70 |
| I- (г) | -195 | 169 | -222 |
| Li(т) | 0 | 29 | 0 |
| Li2O (т) | -599 | 38 | -562 |
| Mg (т) | 0 | 33 | 0 |
| MgCO3(т) | -1096 | 66 | -1012 |
| MgO(т) | -601 | 27 | -569 |
| Mn(т) | 0 | 32 | 0 |
| MnO(т) | -385 | 60 | -363 |
| MnO2() | -520 | 53 | -465 |
| N2() | 0 | 192 | 0 |
| N() | +473 | 153 | +456 |
| N+() | +1883 | 162 | +1857 |
| NH3() | -46 | 192 | -16 |
| NO(г) | +91 | 211 | +87 |
| NO2(г) | +33 | 240 | +51 |
| N2O4(г) | +9 | 304 | +98 |
| N2O(г) | +82 | 220 | +104 |
| O2(г) | 0 | 205 | 0 |
| O(г) | +249 | 161 | +232 |
| O+(г) | +1569 | 155 | +1547 |
| O3(г) | +143 | 239 | +163 |
| Pb(т) | 0 | 65 | 0 |
| PbO(т) | -219 | 66 | -189 |
| PbO2(т) | -277 | 72 | -218 |
| S(т) | 0 | 32 | 0 |
| S2(г) | +128 | 228 | +79 |
| S8(г) | +102 | 431 | +50 |
| SO2(г) | -297 | 248 | -300 |
| SO3(г) | -396 | 257 | -371 |
| Se(т) | 0 | 42 | 0 |
8. Күшті электролиттер
Тұздар.
Қышқылдар – HCIO4, НMnO4, НСІ, НВr, НІ, НCІO3, HВrO3, НNO3, Н2SO4, Н2SеO4.
Негіздер – сілтілік және сілтілік-жер металдарының гидроксидтері: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Кейбір қышқылдардың сулы ерітінділерінің 20°С температурадағы
концентрациясы мен тығыздығы (кг/м3 немесе г/л)
| Масс. % | H2SO4 | HCI | HNO3 | H3PO4 | CH3COOH |
| 1 2 3 4 5 | 1005 1012 1018 1025 1032 | 1003 1008 1013 1018 1023 | 1004 1009 1015 1020 1026 | 1004 1009 1015 1020 1026 | 1000 1001 1003 1004 1006 |
| 6 7 8 9 10 | 1039 1045 1052 1059 1066 | 1028 1033 1038 1043 1047 | 1031 1037 1043 1049 1054 | 1031 1037 1042 1048 1053 | 1007 1008 1010 1011 1013 |
| 12 34 16 18 20 | 1080 1095 1109 1124 1139 | 1057 1068 1078 1088 1098 | 1066 1078 1090 1103 1115 | 1065 1076 1088 1101 1113 | 1015 1018 1021 1024 1026 |
| 22 24 26 28 30 | 1155 1170 1186 1202 1219 | 1108 1119 1129 1139 1149 | 1128 1140 1153 1167 1180 | 1126 1140 1153 1167 1181 | 1029 1031 1034 1036 1038 |
| 35 40 45 50 55 | 1260 1303 1348 1395 1445 | 1174 1198 | 1214 1246 1278 1310 1339 | 1216 1254 1293 1335 1379 | 1044 1049 1053 1058 1061 |
| 60 65 70 75 80 | 1498 1553 1611 1669 1727 | 1367 1391 1413 1434 1452 | 1426 1476 1526 1579 1633 | 1064 1067 1069 107 1070 | |
| 85 90 92 94 96 | 1779 1814 1824 1831 1836 | 1469 1483 1487 1491 1495 | 1689 1746 1770 1794 1819 | 1069 1066 1064 1062 1059 | |
| 98 100 | 1836 1831 | 1501 1513 | 1844 1870 | 1055 1050 |
Кейбір негіздер мен тұздардың 20°С температурадағы
концентрациясы мен тығыздығы (кг/м3 немесе г/л)
| Масс . % | NaOH | KOH | NH4 | NaCl | KCl |
| 1 2 3 4 5 | 1010 1021 1032 1043 1054 | 1007 1017 1026 1035 1044 | 994 990 985 981 977 | 1005 1012 1020 1027 1034 | 1004 1011 1017 1024 1030 |
| 6 7 8 9 10 | 1065 1076 1087 1098 1109 | 1053 1062 1072 1081 1090 | 973 969 965 961 958 | 1041 1049 1056 1063 1071 | 1037 1043 1050 1057 1063 |
| 12 14 16 18 20 | 1131 1153 1175 1197 1219 | 1109 1128 1148 1167 1186 | 950 943 936 930 923 | 1086 1101 1116 1132 1148 | 1077 1090 1104 1118 1133 |
| 22 24 26 28 30 | 1241 1263 1285 1306 1328 | 1206 1226 1247 1267 1288 | 916 910 904 898 892 | 1164 1180 1197 | 1147 1162 |
| 35 40 45 50 | 1380 1430 1478 1525 | 1341 1396 1452 1511 |
9. Әлсіз электролиттердің диссоциациялану константасы КД
| Қосылыс | Кд | рКд | ||
| Қышқылдар | ||||
| Азотты НNO2 | 5,1·10-4 | 3,29 | ||
| Иодтау HIO3 | 0,16 | 0,79 | ||
| Құмырсқа НСООН | 1,8·10-4 | 3,75 | ||
| Күшән Н3AsO4 | К1 6,0·10-3 | 2,22 | ||
| К2 1,0·10-7 | 7,0 | |||
| К3 3·10-12 | 11,52 | |||
| Селенді H2SeO3 | К1 2,4·10-3 | 2,62 | ||
| К2 4,8·10-9 | 8,32 | |||
| Селенсутек H2Se | К1 1,3·10-4 | 3,89 | ||
| К2 1,0·10-11 | 11,0 | |||
| Күкіртті H2SO3 | К1 1,7·10-2 | 1,76 | ||
| К2 6,2·10-8 | 7,20 | |||
| Күкіртсутек H2S | К1 8,9·10-8 | 7,05 | ||
| К2 1,3·10-13 | 12,90 | |||
| Көмір H2СO3 | К1 4,5·10-7 | 6,35 | ||
| К2 4,8·10-11 | 10,32 | |||
| Сірке СH3СООН | 1,7·10-5 | 4,76 | ||
| Дихлорсірке СHСl2СООН | 5·10-2 | 1,3 | ||
| Үшхлорсірке ССl3СООН | 0,2 | 0,7 | ||
| Фосфор H3РО4 | К1 7,6·10-3 | 2,12 | ||
| К2 6,2·10-8 | 7,21 | |||
| К3 4,4·10-13 | 12,36 | |||
| Дифосфор H4Р2О7 | К1 3·10-2 | 1,52 | ||
| К2 4,4·10-3 | 2,36 | |||
| К3 2,5·10-7 | 6,60 | |||
| К4 5,6·10-10 | 9,25 | |||
| Фторосутек НF | 6,8·10-4 | 3,17 | ||
| Хлорлы НСlO2 | 1,1·10-2 | 1,97 | ||
| Циансутек HCN | 6,2·10-10 | 9,21 | ||
| Негіздер | ||||
| Аммоний гидроксиді NH4OH | 1,8·10-5 | 4,26 | ||
10. Тұздар мен гидроксидтердің ерігіштік көбейтіндісі
| Қосылыс | ЕК | р ЕК |
| Ag 3AsO4 | 1,0·10-22 | 22,0 |
| AgBr | 5,3·10-13 | 12,28 |
| Ag2CO3 | 8,2·10-12 | 11,09 |
| AgCl | 1,8·10-10 | 9,75 |
| Ag2CrO4 | 1,1·10-12 | 11,95 |
| AgI | 8,3·10-17 | 16,08 |
| AgIO3 | 3,1·10-8 | 7,52 |
| Ag3PO4 | 1,3·10-20 | 19,89 |
| Ag2S | 6,3·10-50 | 49,20 |
| BaCO3 | 5,1·10-9 | 8,29 |
| BaCrO4 | 1,2·10-10 | 9,93 |
| Ba3(РO4)2 | 6,0·10-39 | 38,22 |
| ВаSO4 | 1,1·10-10 | 9,97 |
| СаCO3 | 4,8·10-9 | 8,32 |
| СаF2 | 4,0·10-11 | 10,4 |
| CaSO4 | 2,4·10-5 | 4,62 |
| Cd(OH)2 | 5,9·10-15 | 14,23 |
| CdS | 7,9·10-27 | 26,10 |
| Cu(OH)2 | 2,2·10-20 | 19,66 |
| Fe(OH)2 | 1,0·10-15 | 15,00 |
| Fe(OH)3 | 3,2·10-38 | 37,50 |
| HgS | 1,6·10-52 | 51,80 |
| PbBr2 | 9,1·10-6 | 5,04 |
| PbCO3 | 1,0·10-13 | 13,0 |
| Pb3(PO4)2 | 7,9·10-43 | 42,10 |
| PbSO4 | 1,6·10-8 | 7,8 |
| SrCO3 | 1,1·10-10 | 9,97 |
| SrSO4 | 3,2·10-7 | 6,49 |
| ZnCO3 | 1,5·10-11 | 10,84 |
| ZnC2O4 | 2·10-8 | 7,7 |
| ZnS | 1,6·10-24 | 23,8 |
11. Кешенді иондардың тұрақсыздық константаларының
Теріс логарифмдері
| Ион | рК1 | рК1-2 | рК1-3 | рК1-4 |
| Аммиакты кешендер | ||||
| Ag+ | 3,32 | 7,24 | ||
| Cd2+ | 2,51 | 4,47 | 5,57 | 6,56 |
| Zn2+ | 2,18 | 4,43 | 6,74 | 8,70 |
| Бромидті кешендер | ||||
| Ag+ | 4,38 | 7,34 | 8,00 | 8,73 |
| Hg2+ | 9,05 | 17,33 | 19,74 | 21,0 |
| Pb2+ | 1,77 | 1,92 | 3,30 | 3,00 |
| Гидроксокешендер | ||||
| Cd2+ | 4,17 | 8,33 | 9,02 | 8,60 |
| Cu2+ | 7,00 | 13,68 | 17,00 | 18,50 |
| Fe2+ | 5,56 | 9,77 | ||
| Fe3+ | 11,87 | 21,17 | 30,67 | |
| Ag+ | 2,3 | 4,00 | 5,2 | |
| Hg2+ | 10,3 | 21,7 | 21,2 | |
| Pb2+ | 6,9 | 10,8 | 13,3 | |
| Sn2+ | 11,9 | 20,6 | 25,1 | |
| Zn2+ | 4,4 | 11,3 | 13,1 | 14,7 |
| Иодидті кешендер | ||||
| Ag+ | 8,13 | 15,74 | ||
| Hg2+ | 12,87 | 23,82 | 27,60 | 29,83 |
| Pb2+ | 2,30 | 3,68 | 5,44 | 6,20 |
| Нитриттті кешендер | ||||
| Ag+ | 1,88 | 2,83 | ||
| Тиосульфатты кешендер | ||||
| Ag+ | 8,82 | 13,46 | ||
| Хлоридті кешендер | ||||
| Ag+ | 3,04 | 5,04 | 5,04 | 5,30 |
| Hg2+ | 6,74 | 13,22 | 14,07 | 15,07 |
| Pb2+ | 1,62 | 2,44 | 2,04 | 1,0 |
| Цианидті кешендер | ||||
| Ag+ | ? | 19,85 | ||
| Cd2+ | 5,18 | 9,60 | 13,92 | 17,11 |
| Cu2+ | ? | 24,0 | 28,6 | 30,3 |
12. Металдардың стандартты электродт ы қ потенциалдары Е0
Электрод …… Li Ca Mg Al Mn Zn Fe
Ео, В…………-3,02 -2,84 -2,37 -1,66 -1,19 -0,76 -0,44
Электрод …… Cd Co Ni Sn Pb H2 Sb Bi
Ео, В……… -0,4 -0.28 -0,23 -0,14 -0,13 0,0 +0,20 +0,23
Электрод …… Cu Ag Hg Pd Pt Au
Ео, В……….. +0,34 +0,8 +0,85 +0,99 +1,2 +1,7
13. Стандартты тотығу-тотықсыздану потенциалдары Е о
| Элемент | Жартылай реакция теңдеуі | Ео, В |
|
Ag
|  AgCl++e- Ag+Cl- AgCl++e- Ag+Cl-
| +0,22 |
 AgI+e- AgI+e-  Ag+I- Ag+I-
| -0,15 | |
 ۟ Ag2O+H2O+2e- ۟ Ag2O+H2O+2e-  2Ag+2(OH-) 2Ag+2(OH-)
| +0,34 | |
| Al |  Al(OH)-4+3e- Al(OH)-4+3e-  Al+4(OH-) Al+4(OH-)
| -2,35 |
| As |  H3AsO4+2H++2e- H3AsO4+2H++2e-  HAsO2+2H2O HAsO2+2H2O
| +0,56 |
 AsO AsO 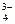 +2H2O+2e- +2H2O+2e-  AsO-2+4(OH-) AsO-2+4(OH-)
| -0,71 | |
| Au |  Au3++2e- Au3++2e-  Au+ Au+
| +1,41 |
 AuCl AuCl 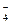 +2e- +2e-  AuCl AuCl 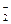 +2Cl- +2Cl-
| +0,93 | |
 AuCl AuCl 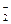 +e- +e-  Au+2Cl- Au+2Cl-
| +1,11 | |
 Au(CN) Au(CN) 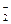 +e- +e-  Au+2CN- Au+2CN-
| -0,61 | |
| Bi |  NaBiO3+4H++2e- NaBiO3+4H++2e-  BiO++2H2O+Na+ BiO++2H2O+Na+
| +1,8 |
| Br |  Br2+2e- Br2+2e-  2Br- 2Br-
| +1,09 |
 HBr+H++2e- HBr+H++2e-  Br-+H2O Br-+H2O
| +1,33 | |
 BrO-+H2O+2e- BrO-+H2O+2e-  Br-+2(OH-) Br-+2(OH-)
| +0,76 | |
| Ce |  Ce4++e- Ce4++e-  Ce3+ Ce3+
| 1,44 |
| Cl |  Cl2+2e- Cl2+2e-  2Cl- 2Cl-
| +1,36 |
 2HClO+2H++2e- 2HClO+2H++2e-  Cl2+2 H2O Cl2+2 H2O
| +1,63 | |
 ClO-+ H2O +2e- ClO-+ H2O +2e-  Cl-+2(OH-) Cl-+2(OH-)
| +0,88 | |
 HCl+H++2e- HCl+H++2e-  Cl- +H2O Cl- +H2O
| +1,50 | |
 ClO-3+6H++6e- ClO-3+6H++6e-  Cl- +3H2O Cl- +3H2O
| +1,45 | |
| Co |  Co3++e- Co3++e-  Co2+ Co2+
| +1,84 |
 Co(OH)3+e- Co(OH)3+e-  Co(OH)2+OH- Co(OH)2+OH-
| +0,17 | |
 Co(NH3) Co(NH3) 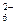 +2e- +2e-  CO+6NH3 CO+6NH3
| -0,42 | |
 Co(NH3) Co(NH3) 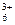 +e- +e-  Co(NH3) Co(NH3) 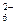
| +0,1 | |
| Cr |  Cr2O Cr2O 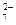 +14H++6e- +14H++6e-  2Cr3+ +H2O 2Cr3+ +H2O
| +1,33 |
 Cr3++e- Cr3++e-  Cr2+ Cr2+
| -0,41 | |
 Cr3++3e- Cr3++3e-  Cr Cr
| -0,74 | |
| Элемент | Жартылай реакция теңдеуі | Ео, В |
| Cu |  Cu2++e- Cu2++e-  Cu+ Cu+
| +0,15 |
 Cu2++Cl-+e- Cu2++Cl-+e-  CuCl CuCl
| +0,54 | |
 ۟ Cu2++Br-+e- ۟ Cu2++Br-+e-  CuBr CuBr
| +0,64 | |
 Cu2+I-+e- Cu2+I-+e-  CuI CuI
| +0,86 | |
 Cu++e- Cu++e-  Cu Cu
| +0,52 | |
 CuCl+e- CuCl+e-  Cu+Cl- Cu+Cl-
| +0,14 | |
 Cu(NH3) Cu(NH3) 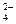 +e- +e-  Cu(NH3)+2+2NH3 Cu(NH3)+2+2NH3
| -0,01 | |
 Cu(NH3) Cu(NH3) 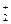 +e- Cu+2NH3 +e- Cu+2NH3
| -0,12 | |
 Cu(NH3) Cu(NH3) 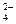 +2e- +2e-  Cu+4NH3 Cu+4NH3
| -0,07 | |
| F |  F2+2H++2e- 2HF F2+2H++2e- 2HF
| +3,07 |
 F2+2e- F2+2e-  2F- 2F-
| +2,87 | |
| Fe |  Fe3++e- Fe2+ Fe3++e- Fe2+
| +0,77 |
 Fe(OH)3+e- Fe(OH)2+OH- Fe(OH)3+e- Fe(OH)2+OH-
| -0,56 | |
 Fe(CN) Fe(CN) 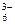 -+e- Fe(CN) -+e- Fe(CN) 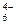
| +0,36 | |
| Hg |  2Hg2++2e- Hg2 2Hg2++2e- Hg2
| +0,91 |
 HgO↓+H2O+2e- Hg↓+2OH- HgO↓+H2O+2e- Hg↓+2OH-
| +0,1 | |
| I |  I2+2e- 2I- I2+2e- 2I-
| +0,54 |
 3I2 +2e- 2I3 3I2 +2e- 2I3
| +0,52 | |
 HlO+H++2e- l- +H2O HlO+H++2e- l- +H2O
| +0,99 | |
 lO-+H2O++2e- l- +2OH- lO-+H2O++2e- l- +2OH-
| +0,49 | |
| Mn |  MnO MnO 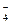 +8H++5e- Mn2++4H2O +8H++5e- Mn2++4H2O
| +1,51 |
 MnO2+4H++2e- Mn2++2H2O MnO2+4H++2e- Mn2++2H2O
| +1,23 | |
 MnO MnO 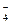 +4H++3e- MnO2+2H2O +4H++3e- MnO2+2H2O
| +1,69 | |
| N |  NO NO 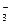 +3H++2e- HNO2+H2O +3H++2e- HNO2+H2O
| +0,94 |
 HNO2+H++e- NO+H2O HNO2+H++e- NO+H2O
| +1,00 | |
 NO NO 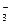 +4H++3e- NO+2H2O +4H++3e- NO+2H2O
| +0,96 | |
| Элемент | Жартылай реакция теңдеуі | Ео, В |
| O |  O2+4H++4e- 2 H2O O2+4H++4e- 2 H2O
| +1,23 |
 O2+H2O+4e- 4OH- O2+H2O+4e- 4OH-
| +0,40 | |
 ۟H2O2+2H++2e- 2H2O ۟H2O2+2H++2e- 2H2O
| +1,77 | |
 O2+2H++2e- H2O2 O2+2H++2e- H2O2
| +0,68 | |
 O2+2H2O+2e- H2O2+2OH- O2+2H2O+2e- H2O2+2OH-
| -0,08 | |
 HO-2+H2O+2e- 3OH HO-2+H2O+2e- 3OH
| +0,08 | |
| P |  H3PO4+2H++2e- H3PO3+H2O H3PO4+2H++2e- H3PO3+H2O
| -0,28 |
| Pb |  PbO2+4H++2e- Pb2++H2O PbO2+4H++2e- Pb2++H2O
| +1,46 |
 Pb(OH) Pb(OH) 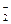 +2e- Pb+3OH- +2e- Pb+3OH-
| -0,54 | |
| Pt |  PtCl PtCl 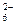 +2e- PtCl +2e- PtCl 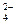 Au+2Cl- Au+2Cl-
| +0,72 |
| Re |  ReO4+8H++4e- Re3++4H2O ReO4+8H++4e- Re3++4H2O
| +0,42 |
| S |  S+2H++2e- H2S S+2H++2e- H2S
| +0,14 |
 S+2e- S2- S+2e- S2-
| -0,48 | |
 SO4+4H++2e- Br-+2(OH-) SO4+4H++2e- Br-+2(OH-)
| +0,17 | |
| Se |  Se+2H++2e- H2Se Se+2H++2e- H2Se
| -0,4 |
 Se+2e- Se2- Se+2e- Se2-
| -0,78 | |
 H2SeO3+4H++2e- Se+3H2O H2SeO3+4H++2e- Se+3H2O
| +0,74 | |
 SeO SeO 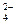 + 4H+ +2e- H2SeO3+ H2O + 4H+ +2e- H2SeO3+ H2O
| +1,15 | |
| Sn |  Sn4++2e- Sn2+ Sn4++2e- Sn2+
| +0,15 |
 Sn(OH) Sn(OH) 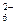 +2e- Sn(OH) +2e- Sn(OH) 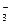 +3OH- +3OH-
| -0,93 | |
 Sn(OH) Sn(OH) 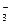 +2e- Sn+3(OH)- +2e- Sn+3(OH)-
| -0,91 | |
| Te |  Te+2H++2e- H2Te Te+2H++2e- H2Te
| -0,69 |
 Te +2e- Te2- Te +2e- Te2-
| -0,92 | |
| Ti |  TiO2++2H++e- Ti3++H2O TiO2++2H++e- Ti3++H2O
| +0,1 |
| Tl |  Tl3++2e- Tl Tl3++2e- Tl
| +1,28 |
| Zn |  Zn(OH) Zn(OH) 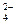 +2e- Zn+4OH- +2e- Zn+4OH-
| -1,22 |
Негізгі әдебиет
11. Б.А.Бірімжанов. Жалпы химия. Алматы, 2001 ж.
12. К.Аханбаев. Химия. Алматы. Ана тілі,1993 ж.
13. Б.Өтелбаев. Химия. Шымкент, 2000 ж.
14. Л.Ю.Аликберова, Р.А.Лидин т.б. Жалпы және бейорганикалық химия практикумы. М., 2004 ж.
15. Б.М.Ділманов, Ә.С. Тапалова. Бейорганикалық химия практикумы. Астана,2009 ж.
16. С.Ж. Піралиев, Б.М. Бутин, Г.М. Байназарова, С.Ж. Жайлау. Жалпы химия. Алматы, 2003 ж.
17. М.Р. Танашева, Т.Т. Омаров, Д.Ә. Смағұлова. Бейорганикалық химия. Алматы, 2000ж.
18. Ә.С.Тапалова. Элементтер химиясы. Оқу-әдістемелік кешен. Астана,2009 ж.
19. Ә.С.Тапалова. Бейорганикалық химия. Есептер мен жаттығулар. Астана, 2008 ж.
20. З.Е. Гольбрайх, Е.И. Маслов. Сборник задач и упражнений по химии. М, 2004г.
Қосымша әдебиет
11. Н.Л.Глинка. Задачи и упражнения по общей химии. Л, 1985 г.
12. Н.С.Ахметов. Общая и неорганическая химия. М., 2000 г.
13. Л.С.Гузей т.б.Жалпы және бейорганикалық химия практикумы.
М.,2000ж.
14. Т.Т.Омаров, Т.С.Гурьевская. Бейорганикалық химия. А., 2002 ж.
15. Ю.М.Коренев, А.Н.Григорьев. Задачи и вопросы по общей и неорганической химии. “Мир”. М., 2004 г.
16. Л.М.Романцева, З.Л.Лещинская. Сборник задач и упражнений по общей химии. М., 1991 г.
17. Н.Н.Павлов, В.И.Фролов. Практикум по общей и неорганической химии. М., 2002 г.
Аудиовизуальды және интерактивті оқыту құралдары
1.В/ф. Химия вокруг нас.
2.В/ф. Оснывные классы неорганических веществ.
3.В/ф. Периодическая система Д.И.Менделеева. Металлы и неметаллы.
4.CD-ROM № 1. Химия для всех. Серия «Обучающие энциклопедии», 2 диска.
5.CD-ROM № 2. Электронный учебник. «Химия».
6.CD-ROM № 3. Серия 1 С: Репититор. Химия.
7.CD-ROM № 4. Общая и неорганическая химия. Лаборатория систем муль-тимедиа. МарГТУ. Йошкар-Ола.
8.CD-ROM № 5. Естественные науки. Неорганическая химия. Знаменитые ученые-химики.История химии. Мультисоф, 2003 г. Москва.
9.CD-ROM № 6. Кирилл и Мифодий. Тесты по химии. Москва, 2003г.
Глоссарий
Абсорбция – абсорбенттің газ фазасындағы компоненттерді сіңіріп алу процесі.
Адсорбция – фазалардың бөліну бетінде бүкіл көлемнен шығып заттардың концентрлену құбылысы.
Аккумуляторлар – химиялық энергияны өз бойына жинап қажет кезінде электр энергиясына айналдыратын құралдар.
Активаторлар – коррозияны өршітетін заттар.
Активтендіру энергиясы – молекулаларды активті күйіне айналдыру үшін жұмсалатын қосымша энергия.
Акцептор – байланыс түзуге бос орбиталін жұмсайтын атом.
Аллотроптық – химиялық элементтің құрылымдары мен қасиеттері әр түрлі екі немесе одан да көп жай зат түрінде болуы.
Аморфты заттар – тәртіпсіз орналасқан молекулалар агрегаты (күйі).
Амфотерлік – бірдей жағдайда әрі сутек иондарын, әрі гидроксид иондарын бөліп шығара алатын қосылыстар.
Анод – тотығу процесі жүретін электрод.
Атом – жай және күрделі заттардың молекулаларының құрамына кіретін химиялық элементтің ең кіші бөлшегі.
Ауыр су – құрамында дейтерий бар су молекулалары.
Бейэлектролиттер – ерітіндісі ток өткізбейтін заттар.
Бертолиттер – түзілу жағдайына қарай құрамы айнымалы химиялық қосылысар.
Броматтар – бромдау қышқылының тұздары
Бромидтер – бромсутек қышқылының тұздары
Буферлік ерітінділер – сутек иондарының концентрациясын белгілі бір дәрежеде ұстайтын ерітінділер.
Валенттілік – бір элемент атомының басқа элемент атомының белгілі бір санын қосып алу қабілеті.
Вискозиметрия – газдар мен сұйықтықтардың тұтқырлығын өлшейтін әдістердің жиынтығы.
Газометр – лаборатория жағдайында газды сақтауға және көлемін өлшеуге арналған құрал.
Гетерогенді жүйе – екі немесе одан да көп бөліктен тұрады, бөліктердің физикалық не химиялық қасиетінде айырмашылығы болады және олардың беттері ғана жанасады, бірімен-бірі араласпайды (мысалы, бензин мен су т.б.).
Гибридтену – атомның пішіндері мен энергиялары әр түрлі орбитальдарының (электрон бұлттарының) өзара араласып, бір пішіндес және тең энергиялы орбитальдарға айналуы.
Гидратация – еріген заттың сумен қосылысу процесі.
Гидрлеу – сутектендіру.
Гипохлоридтер – хлорлылау қышқылының тұздары.
Гомогенді жүйе – біртекті жүйе (мысалы, газдар қоспасы, тұздың ерітіндісі, су т.б.).
Дальтониттер – құрамы тұрақты қосылыстар (формуласы валенттілікке сәйкес).
Дегидраттану – судың бөлінуі.
Дегидрогендеу – химиялық қосылыстан сутектің бөліну процесі.
Дисперсті жүйе – қандай да бір затқа екінші заттың өте ұсақ бөлшектері араласуы.
Диссоциациялану дәрежесі - диссоциацияланған молекулалар саны-
ның жалпы еріген молекулалар санына қатынасы.
Диполь – бірінен-бірі белгілі қашықтықта орналасқан шамалары бірдей, таңбалары қарама-қарсы екі нүктелік электр зарядтардың жиынтығы.
Донор – байланыс түзуге қос электронды орбиталін, яғни электрон жұбын жұмсайтын атом.
Еріткіш – ішінде еріген зат молекула, не тіпті ион түрінде біркелкі болып араласатын орта.
Ерітінді – ең кемі екі компоненттен тұратын біртекті жүйе.
Ерітіндінің концентрациясы – ерітіндінің белгілі көлем не салмақ бірлігіндегі еріген заттың мөлшері.
Изотоп – элемент атомдарының массасында айырмашылығы бар әрбір түрі.
Ингибитор – реакцияны баяулататын заттар.
Индикатор – сутек иондарының концентрациясына қарай өз түсін өзгертіп, ерітіндінің қышқыл, бейтарап, не сілтілік екенін көрсететін арнаулы реактивтер.
Иондық байланыс – қарама-қарсы зарядталған иондардың электростатикалық тартылысуы.
Калориметр – физикалық не химиялық процесте бөлініп шығатын немесе сіңірілетін жылудың мөлшерін өлшейтін құрал.
Катализ – катализатордың әсерінен реакция жылдамдығы өзгеретін процесс.
Катализатор – реакцияның жылдамдығын өзгертіп, бірақ реакция нәтижесінде өздері химиялық өзгермей қалатын заттар.
Катод – тотықсыздану процесі жүретін электрод.
Кермек су – табиғи сулардың құрамында еріген күйде кальций мен магний тұздарының көп болуы.
Коваленттік – бір элементтің өзі әртүрлі жағдайларда коваленттік, не иондық көрсететін валенттілігі.
Коваленттік байланыс – бір немесе бірнеше электрон жұптары арқылы түзілетін химиялық байланыс.
Кешенді қосылыстар – қатты күйінде де, еріген күйінде де тұрақты болып келетін жоғары ретті қосылыстар.
Конденсация – газ күйінен сұйық немесе қатты күйге біріншітекті фазалық ауысу.
Коррозия – қоршаған ортаның әсерінен металдардан жасалған бұйымдардың өздігінен бүліну процесі.
Кристаллогидраттар – құрамына судың молекулалары кіретін кристалдық түзінділер.
Қайтымды реакциялар – бір бағытта жүретін реакциялар.
Қайтымсыз реакциялар – бірдей жағдайда қарама-қарсы жүретін реакциялар.
Қышқылдар – суда ерігенде сутек иондарын беретін қосылыстар.
Молекула – заттың химиялық қасиеттерін бойында сақтайтын ең кіші бөлшегі.
Моль – көміртектің 12С изотопының 0,012 килограмындағы атомдар санына тең құрылым бірліктері (молекулалар, атомдар, электрондар, т.б.) болатын зат мөлшері.
Молярлық масса – зат массасының оның мөлшеріне қатынасы.
Мольдік концентрация – ерітіндінің бір литрінде еріген заттың моль санымен өлшенетін ерітінділер.
Негіздер – суда ерігенде гидроксид-иондарын беретін қосылыстар.
Нейтрон – массасы протондай ғана, бірақ заряды жоқ бейтарап бөлшек.
Нормальді концентрация – ерітіндінің бір литрінде еріген заттың эквивалент санымен өлшенген ерітінді.
Нуклон – протон мен нейтронның жалпы атауы.
Озонатор – озон алатын аппарат.
Оксидтер – екі элементтен тұратын, оның біреуі оттегі болатын күрделі заттар.
Олеум – күкірт триоксидінің сусыз күкірт қышқылындағы ерітіндісі.
Период – ядро зарядының біртіндеп өсуі және қасиеттерінің белгілі тәртіп бойынша өзгеру ретімен орналасқан элементтердің жиынтығы.
Пиролиз – жоғары температура әсерінен жүретін заттарды ыдырату әдісі мен процесі.
Позитрон – массасы электрон массасындай, бірақ оң заряды бар бөлшек.
Промоторлар – катализаторға аз мөлшерде қосқанда оның активтігін, тұрақтылығын күшейтетін заттар.
Реактор – белгілі жағдайда реагенттердің химиялық өзгерулерін іске асыруға арналған аппарат.
Резервуар – сұйықтық, газдар сақтауға арналған бассейн, бак, баллон түріндегі ыдыс.
Ректификация – ұшқыштығы әр түрлі сұйықтықтардың гомогенді қоспасының айырылуына әкелетін сұйық фазалардың жанасу кезінде
қарама-қарсы ағынды бу беру процесі.
Сублимация – заттардың қыздырғанда бірден буға айналу қабілеті.
Тотығу – атомның, молекуланың, ионның электрон беру процесі.
Тотықсыздану – атомның, молекуланың, ионның электрон қосып алу процесі.
Тотықсыздандырғыш – электрон қосып алушы бөлшек.
Тотықтырғыш – электрон беруші бөлшек.
Тұздар – суда ерігенде металл катионын және қышқыл қалдығы анионын беретін қосылыстар.
Фаза – бөлу беттерімен шектелген жүйенің химиялық құрамы, физикалық және термодинамикалық қасиеттері ұқсас бөліктерінің жиынтығы.
Флюс – шойын қорытып шығарғанда кендегі бос жыныстарды оңай балқытып қоқысқа айналдыру үшін қосылатын зат.
Фотолиз – жарық әсерінен өтетін химиялық қосылыстардың ыдырауы.
Химия – заттардың құрамын, құрылысын, қасиеттерін, химиялық өзгерістерін, өзгеріс жағдайын зертетін ғылым.
Химиялық теңдік – химиялық белгілер мен формулалардың жәрдемімен қысқа түрде жазылатын реакция.
Химиялық тепе-теңдік – қайтымды реакцияда тура реакция мен кері реакцияның жылдамдықтары теңескен күй.
Химиялық формула – молекуланың сапалық және сандық құрамын көрсетеді.
Химиялық энергия – химиялық процестерде заттардан бөлінетін немесе сіңірілетін энергияның түрі.
Эквивалент – кез-келген заттың сутектің 1,008 массалық бөлігімен немесе оттектің 8 массалық бөлігімен қалдықсыз әрекеттесетін массалық бөлігі.
Эквиваленттік фактор – нақты бөлшектің берілген қышқылдық-негіздік реакцияда сутектің бір катионына, немесе берілген тотығу-тотықсыздану реакциясында бір электронға сәйкес келетін үлесі.
Экзотермиялық реакция – энергия бөле жүретін реакциялар.
Электролиз – еріген немесе балқыған күйдегі электролиттен ток өткен кезде жүретін тотығу-тотықсыздану процесі.
Эндотермиялық реакция – энергия сіңіре жүретін реакция.
Дата: 2019-05-29, просмотров: 1559.