Гидролиз.
Қайталау сұрақтары.
1. Ерітіндідегі электролиттер арасында алмасу реакциясы қандай жағдайларда жүруі мүмкін?
2. Ионды-молекулалық теңдеулерде күшті электролиттер, аз диссоциацияланатын заттар мен қиын еритін қосылыстар және газдар қалай жазылады?
3. Реакция нәтижесінде суда жақсы еритін газ тәріздес зат пайда болса, бұл реакция аяғына дейін жүре алады ма?
4. Тұздың құрамына қарай гидролиздің қандай түрлері белгілі?
5. Гидролиз дәрежесі дегеніміз не? Гидролиздің әр түрлі жағдайында гидролиз константасы қалай өрнектеледі?
Есептер мен жаттығулар.
Мысал 1. Натрий ацетатының 0,1 М ерітіндісінің рН мен гидролиздену дәрежесін есептейміз.
Шығарылуы. СН3СООNa гидролиздену реакциясының теңдеуін жазамыз:
 CH3COONa + H2O CH3COOH + NaOH
CH3COONa + H2O CH3COOH + NaOH
қысқартылған иондық молекулалық түрде:
 СН3СОО- + Н2О СН3СООН + ОН-
СН3СОО- + Н2О СН3СООН + ОН-
с – х х х
Гидролиздену константасы
Егер х моль ацетат-иондар гидролизденсе, онда [CH3COOH] = [OH] = x, [CH3COO-] = c – x , мұндағы с – тұздың бастапқы концентрациясы. (Тепе-теңдік концентрациялары теңдеудегі бөлшектердің астында жазылған). Енді осы белгілеулерімізді гидролиз константасының өрнегіне қойсақ, 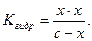 Ал тұздың өте аз бөлігі ғана гидролизденетінін ескерсек с – х ≈ с, ал
Ал тұздың өте аз бөлігі ғана гидролизденетінін ескерсек с – х ≈ с, ал 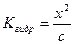 болады.
болады.  екендігі белгілі, осыдан
екендігі белгілі, осыдан 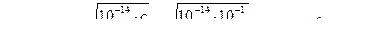 pOH = -lg [OH-] = -lg 7,4∙10-6 = -lg 7,4 – (-6) = 5,1; pH = 14 – pOH = 14 – 5,1 = 8,9.
pOH = -lg [OH-] = -lg 7,4∙10-6 = -lg 7,4 – (-6) = 5,1; pH = 14 – pOH = 14 – 5,1 = 8,9.
Гидролиздену дәрежесін h деп белгілесек:
[OH-] = ch, немесе 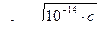
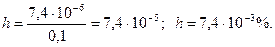
1. Нәтижесінде аз еритін тұнба, газ және аз диссоциацияланатын қосылыс түзілетін реакция теңдеулерін иондық-молекулалық түрде жазыңыз:
BaCl2 + K2SO4 = NH4Cl + KOH =
K2CO3 + HCl = Ca(HCO3)2 + H2SO4 =
FeCl3 + KOH = NaHSO4 + KOH =
HCl + Ba(OH)2 = AgNO3 + FeCl3 =
Pb(NO3)2 + NaI = Ba(OH)2 + H2SO4 =
AlBr3 + AgNO3 = Pb(CH3COO)2 + K2S =
Na2S + H2SO4 = KHSO3 + H2SO4 =
CuSO4 + KOH = NiCl2 + K2S =
2. Берілген реакциялардың жүруі мүмкін бе? Олар қай бағытта жүреді? (Түсіндіру үшін ерігіштік көбейтіндісінің кестесін пайдаланыңыз).
1) AgCl + NaI = AgI + NaCl
2) PbS + K2SO4 = PbSO4 + K2S
3) BaCO3 + Na2SO4 = BaSO4 + Na2CO3
4) 2AgBr + K2SO4 = Ag2SO4 + 2 KBr
3. Берілген тұздар үшін гидролиз реакциясының теңдеуін қысқартылған иондық-молекулалық түрде жазып, тұздың ортасын көрсетіңіз:
1) K2S; 2) Na3PO4; 3) CuSO4; 4) NaCl; 5) FeCl3
4. Берілген тұздар үшін гидролиз реакциясының теңдеуін жазып, тұздың ортасын көрсетіңіз:
1) Na2SiO3; 2) AlCl3; 3) Na2CO3; 4) K2SO4; 5) CuCl2
5. Берілген тұздарды сулы ерітінділерінің рН өсуі бойынша қатарға орналастырыңыз (тұздардың концентрацияларын бірдей деп алыңыз):
1) Cu(NO3)2; 2) K2CO3; 3) NaCl; 4) Na2S.
6. Натрий ацетаты мен формиатының ерітінділері берілген. (Ерітінділердің СМ бірдей деп есептейміз). Осы ерітінділердің қайсысында сілтілік орта басым?
7. Құрамында 0,2 моль/л натрий ацетаты бар ерітіндінің рН анықтаңыз.
8. Құрамында 0,2 моль/л аммоний хлориді бар ерітіндінің рН анықтаңыз.
9. Фосфат ерітінділерінің Na3PO4, Na2HPO4, NaH2PO4, (ωтұз=1%) рН мәндері 12,1; 8,9; 4,6 сандарына сәйкес. Реакция теңдеулерін жазып, ортаның қышқылдағы неге артатынын түсіндіріңіз.
10. Темір (ІІІ) хлориді (FeCl3) ерітіндісіне Na2CO3 eрітіндісін қосқанда темір (ІІІ) карбонаты емес, Fe(ОН)3 тұнбаға түседі. Неліктен?
10. Кешенді қосылыстар
Қайталау сұрақтары
1. Кешенді қосылыстар қалай түзіледі?
2. Су ерітіндісінде кешенді қосылыстар диссоциациясы нәтижесінде не түзіледі? Мысал келтір.
3. Қандай иондар кешентүзушінің рөлін орындай алады?
4. Кешенді қосылыстар қалай жіктеледі? Мысалмен түсіндір.
5. Лигандтар (аддендтер) деген не? Мысал келтір.
6. Қандай иондарда координациялық сан 2, 4, 6 болады? Мысал келтір.
7. Неліктен кешен түзу қасиеті s- және p- элементтермен салыстырғанда d- элементтер үшін көбірек кездеседі?
8. Кешенді ионның зарядын қалай есептейді? Мысал келтір.
Есептер мен жаттығулар
Мысал 1. Берілген кешенді иондардағы орталық атом орбитальдарының будандасу типін валенттік байланыс әдісі [ВБ] тұрғысынан анықтаңыз:
1) [Zn(NH3)4]2+; 2) [CoF6]3-; 3) [Co(CN)6]3-
1 мен 2 – диамагнитті, ал 3 – парамагнитті кешендер екені белгілі.
Шығарылуы. 1. Zn2+ ионының электрондық конфигурациясы: [Ar]3d10. Бұл жағдайда Zn2+ - орталық ионның бос орбитальдарына төрт аммиак молекуласының бөлінбеген электрон жұбы келуі қажет. Лигандармен 4δ-байланыс түзу үшін 4 орбиталь қажет: олар 4s-орбиталь және 4р-орбитальдар, яғни sр3-будандасу орын алады. Кешендік ионда тетраэдр түрі болады, оның ортасында Zn2+ ионы, ал төрт төбесінде – NН3 молекулалары орналасады.

2. Орталық Со3+ ионының электрондық конфигурациясы: [Ar]3d6. Алты донорлы-акцепторлық δ-байланыстар түзілуі үшін алты вакантты Со3+ атомдық орбитальдары пайдаланылады. Орталық атомның d-электрондарын жұптастыру үшін лигандтардың өріс күші жетіспейтіндіктен (парамагнитті кешен) алты байланыстың түзілуі сыртқы 4s, 4р және екі 4d-орбитальдар есебінен жүреді.

Будандасу типі – sр3d2. Сыртқы (төртінші) электрондық қабатының d-орбитальдары байланысқа қатысқандықтан, мұндай кешенді қосылыстар «сыртқы орбитальдық» деп аталады. Со3+ ионының электрондық қабатында жұптаспаған (жалқы) электрондардың болуы кешендік қосылыстың парамагниттік қасиеттерін түсіндіреді. Кешендік ионның геометриялық пішіні – октаэдр.
3. Диамагнитті [Co(CN)6]3- кешендік ионындағы Со3+ ионы мен CN- иондарының арасындағы алты донорлық-акцепторлық байланыс түзуге қатысатын вакантты будандасқан (гибридті) орбитальдар түзілу схемасы [CoҒ6]3- ионынан басқаша.

Лигандтар өрісінің әсері есебінен төрт d-электрондарының жұптасуы жүреді де, нәтижесінде екі ішкі (3d) d-орбиталі босатылады. Аммиактың алты молекуласы алты байланысты түзу үшін екі 3d-орбитальдар, бір 4s-орбиталь және 4р-орбитальдар d2sр3 будандасқан орбитальдар пайдаланылды. Кешеннің геометриялық пішіні – октаэдр. Будандасуға сыртқы 4d-орбитальдар емес, ішкі 3d-орбитальдар қатысатындықтан [Co(CN)6]3- кешенін «ішкі орбитальдық» деп атайды.
Мысал 2. [Нg(CN)4]2- кешеніндегі орталық атом орбитальдарының будандасу типін анықтаңыз. Кешеннің геометриялық пішінін атап, суретін салыңыз.
|

Мысал 3. [Fе(C2О4)3]3- октаэдрлік кешеніндегі байланыстар түзілуінің энергетикалық диаграммасын құрып (лигандтар өрісі әлсіз), орталық атом орбитальдарының будандасу типін көрсетіңіз.
Берілгені:
Fе+ІII+3C2О  →[Fе(C2О4)3]3-
→[Fе(C2О4)3]3-
Fe+III=[Ar] 3d54s04p04d0 (акцептор)
C2О  = L(донор 2е2)
= L(донор 2е2)
6δ-байланыс Fe – ½L
Шығарылуы:

1. Хромның кешенді қосылыстары берілген:
[Cr(H2O)6]Cl3; [Cr(H2O)5Cl]Cl2; [Cr(NH3)6]·[Co(CN)6]; [Co(NH3)6]·[Cr(CN)6].
Қай заттар изомер екендігін тауып, изомерияның типін анықтаңыз.
2. Жалпы формуласы Co(NH3)5SO4Br екі изомердің біріншісі күміс нитратымен әрекеттескенде тұнба түзіледі, ал екіншісімен түзілмейді, ал бірінші изомерге барий хлоридімен әсер еткенде тұнба түзілмейді де, екінші изомермен тұнба түзіледі. Осы заттардың электрөткізгіштігін өлшегенде әрбір изомер ерітіндіде екі ионға диссоциацияланатыны байқалған. Әрбір изомердің координациялық құрылымын анықтап, изомерияның түрін атаңыз.
3. Берілген кешенді иондардың құрылымдық формулаларын жазыңыз:
[Co(C2О4)3]3-; цис-изомер [Pt(en)2(CN)2]2+; транс-изомер [Cr(NH3)2Cl2]+; [Mn(CN)6]4-.
4. Кобальттың екі аммиакатының түстері әртүрлі: біреуі – жасыл, екіншісі – күлгін. Екі ерітіндінің электрөткізгіштігін өлшегенімізде, изомерлердің әрқайсысы екі ионға диссоциацияланатыны байқалды. Жалпы формуласы CoCl3·4NH3 изомерлердің координациялық формулаларын жазып, изомерияның түрін анықтаңыз.
5. Берілген кешенді иондардың кеңістіктік конфигурациясын анықтаңыз:
а) [BeF4]2-; ә) [AlF6]3-; б) [ClF2]-; в) [ICl4]-.
6. Кешенді иондардың геометриялық құрылымын анықтаңыз.
Лигандтармен байланысуға кешентүзуші ионның қандай типтегі будандасқан (гибридтелген) орбитальдары қатысады: а) [CoCl4]-; ә) [MnCl4]2-; б)[FeCl4]-; в) [Pt(NH3)4]2+ - диамагнитті; г) [PdCl4]2- - диамагнитті; д) Cu[(NH3)4]2+; е)[AuCl4]- – диамагнитті; ж) [NiF4]2- – парамагнитті?
7. Берілген кешенді иондардағы кобальттың электрондық конфигурациясы қандай:
1) [Co(C2O4)5]3- – парамагнитті; 2) [Co(NH3)6]3+ – диамагнитті; 3) [CoF6]4- – парамагнитті?
8. Берілген диамагнитті кешендерде лигандтармен байланысқа платинаның қандай типтегі будандасқан орбитальдары қатысады? 1 жағдайда кешенді иондар жазық квадрат пішінде, ал 2 жағдайда октаэдр пішінде екендігі белгілі.
1) [Pt(NH3)4]2+; [Pt(NH3)2Cl2;
2) [Pt(NH3)6]4+; [Pt(NH3)2Cl4]; [PtCl6]2-.
9. Берілген кешенді иондарда δ-байланыстардың түзілуі орталық атомның қандай орбитальдарының қатысында іске асады: [Mn(CN)6]4- (әлсіз өріс) және [Mn(NH3)6]2+ (күшті өріс)? Бұлардың қайсысы «сыртқы орбитальдық», қайсысы «ішкі орбитальдық»?
10. Кешенді иондардағы орталық атомның электрондық конфигурациясын жазыңыз: 1) [Ғе(CN)6]3- және 2) [Ғе(CN)6]4-. Егер бірінші кешен парамагнитті, ал екінші – диамагнитті болса, лигандтармен δ-байланыстар орталық атомның қандай орбитальдарының есебінен пайда болады?
11. Тотығу-тотықсыздану реакциялары.
Электрохимиялық процестер
Қайталау сұрақтары
1. Тотығу дәрежесі деп нені атайды?
2. Тотығу-тотықсыздану реакцияларына анықтама беріңдер. Олардың кандай типтері бар?
3. Қандай заттар тотықтырғыш та, тотықсыздандырғыш та қасиет көрсете алады? Мұндай екі жақтылыққа мысал келтіріндер.
4. Ионды-электрондық баланс әдісі қандай ережеге негізделген?
5. Адам өзінің күнделікті өмірде іске асыратын тотығу-тотықсыздану реакцияларына мысал келтіріңдер.
6. Тотығу-тотықсыздану реакциялардың жүруіне әсер етер ортаның ықпалын түсіндіріңдер.
7. Тотығу-тотықсыздану реакциясының бағытын болжауға бола ма? Мысал келтіріндер.
Е септер мен жаттығулар
1. Келесі берілген реакциялардың әрқайсысы тотығу-тотықсыздану реакцияларының қандай түріне жатады?
а) Н2О2 + К2Сr2О7 + НСl 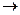 СrСl3 + КСl + О2 + Н2О
СrСl3 + КСl + О2 + Н2О
б) Н2О2 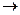 Н2О + О2
Н2О + О2
в) Н2О2 + KNО2 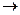 КNО3 + Н2О
КNО3 + Н2О
Осы реакциялардың әрқайсысында сутектің асқын тотығы қандай рөл (тотықтырғыш; тотықсыздандырғыш; екеуін де) атқарады? Электрондық баланс әдісімен реакция теңдеуін құраңдар.
2.Реакцияларды жазып аяқтандар, электрондық баланс әдісімен коэффициенттерді тауып орнына қойыңдар, тотықсыздандырғышты және тотықтырғышты көрсетіңдер:
а) Fе2О3 + Н2 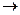 ...
...
б) SО2 + О2 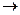 ...
...
в) S + Н2SО4 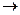 ...
...
3.Натрий сульфитінің массалық үлесі 3% массасы 50 г ерітіндісін сілтілік ортада тотықтыру үшін калий перманганатының массалык үлесі 4% массасы 120 г ерітіндісі жеткілікті ме?
4. Құрамындағы йодтың массалық үлесі 2% болатын, массасы 150 г молекулалық йод ерітіндісімен қалыпты жағдайда өлшенген күкіртті сутектің қандай көлемі, әрекеттеседі?
5.Берілген тотығу-тотықсыздану реакцияларына жартылай реакция әдісімен коэффициент таңдап алыңдар. Қысқарған иондық және молекулалық түрдегі теңдеуін жазындар:
а) KJ + КNО2 + Н2SО4 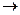 J2 + К2SО4 + Н2О
J2 + К2SО4 + Н2О
б) Nа2С2О4 + КВrО3 + Н2О 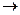 СО2 + КВr + NаОН
СО2 + КВr + NаОН
в) КМnО4 + КNО2 + Н2О 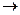 МnО2 + NаNО3 + КОН
МnО2 + NаNО3 + КОН
г) АgNО3 + РН3 +Н2О 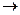 Аg + Н3РО4 + НNО3
Аg + Н3РО4 + НNО3
6.Мn2+ ионының марганецті қышқыл ионына тотығу реакциясынын теңдеуін құрастырып, ортасын анықтап және тотықтырғышты таңдап алыңдар.
7.Калий перхлораты бос хлорға дейін тотықсызданады. Осындағы калий перхлоратының тотығу-тотықсыздану эквивалентін есептеңдер.
Студенттің өз бетінше орындайтын жұмыстары
1. Химияның негізгі заңдары мен ұғымдары
Бақылау сұрақтары мен есептер
1. Заттың сандық және сапалық құрамы дегеніміз не?
2. 2,94 г кальций хлоридін қыздырғанда 1,45 г су бөлінген. Кристаллогидраттың формуласы қандай?
3. 0,9664 г кристаллогидраттағы кристалданған суды буландырғаннан кейін сусыз тұз Cu(NO3)2 0,7504 г болды. Мыс нитраты кристаллогидратының формуласы қандай?
4. Бурадағы Na2B4O7 · 10H2O элементтердің проценттік мөлшерін табыңыз.
5. Химиялық эквивалент деген не? Эквивалент заңының анықтамасы қандай? Эквивалент және эквиваленттер заңының қандай практикалық маңызы бар?
6. Оксидтердің, қышқылдардың, негіздердің және тұздардың эквиваленттерін қалай анықтайды? Мысал келтіріңіз.
7. Мына қосылыстардың құрамындағы элементтердің валенттілігі мен эквивалентін табыңыз:
а) К2О, ә) СаО, б) Ғе2О3, в) PbO, г) SO3, д) P2O5, е) HNO3, ж) H2SO4, з) Na2O3, и)Al2(SO4)3, к) Ca3(PO4)2.
8. Қалыпты жағдайда 0,1953 г металл 56 мл сутекті ығыстырған болса, металдың эквиваленті неге тең?
9. Қалыпты жағдайда 1 г металды тотықтыруға 462 мл оттек жұмсалған болса, металдың эквиваленті қандай болғаны?
10. 1 г металл 1,251 г оксид түзген болса, металдың эквиваленті қандай болғаны?
11. 0,09 г металл қышқылдан 170С-де және 0,987 атмосфералық қысымда 48 мл сутек ығыстырылған. Сутек су үстінде жиналған. Металдың эквивалентін табыңыз.
12. Хлорлы темірде 34,42% темір және 65,58% хлор бар. Хлордың эквиваленті 35,46. хлорлы темірдегі темірдің эквивалентін табыңыз.
13. Күміс оксиді құрамында 93,09% күміс, 6,91% оттек, ал йодты күмісте 45,95% күміс және 54,05% йод бар. Йодтың эквиваленті нешеге тең?
14. Атом, атомдық салмақ, молекула, молекулалық салмақ, зат мөлшері деген не?
15. Авогадро заңы қалай айтылады?
16. Қалыпты жағдайда әр түрлі газдардың 1молі қандай көлем алады?
17. Авогадро саны деген не? Ол неге тең?
18. Ацетиленнің С2Н2, оттектің, сутектің қалыпты жағдайдағы бір литрінің салмағын есептеңіз.
19. 172С-де және 0,95 атмосферада 200 мл газдың көлемін қалыпты жағдайға келтіріңіз.
20. Қалыпты жағдайдағы 1 л метанның және 1 л СО2 салмағын анықтаңыз.
21. 1 кг метан және 1 кг көміртек оксиді қалыпты жағдайда қандай көлем алады?
22. Қандай болмасын газдың 1 миллилитрінде қалыпты жағдайда неше молекула болады?
23. 7,5 грамы қалыпты жағдайда 5,6 л көлем алатын азот оксидінің молярлық массасын есептеңіз.
24. Газ тәрізді зат 770С температурада және 2,5 атм қысымда 12 л көлем алады және 17,7 г салмақ тартады. Бұл қандай зат?
25. 290С-де су үстінде жиналған газ 250 мл көлем алады. Су буы қысымының температураға тәуелділігінің таблицасын пайдаланып, осындай көлемдегі құрғақ газдың осы температурада қандай көлем алатындығын есептеңіз.
2. Бейорганикалық қосылыстардың негізгі кластары
Бақылау сұрақтары мен есептер
1. Заттардың жай және күрделі заттар болып бөлінуі; жай зат, оксид, негіз, қышқыл және тұздар дегеніміз не? Олардың әрқайсы қалай классификацияланады?
2. Қандай тұздар қалыпты (орта), қышқылдық және негіздік тұздар деп аталады? Мысал келтіріңіз.
3. Жай заттар, оксидтер, негіздер, қышқылдар және тұздар арасындағы өзара байланыс схемасын сызыңыз.
4.Оксидтерді, гидроксидтерді және қышқылдарды қандай тәсілдермен алуға болады? Мысал келтіріңіз.
5. Тұздарды алудың он тәсіліне мысал келтіріңіз.
6. ВаSO4, FеSO4, CuCl2 тұздарын алудың мүмкін болатын реакцияларының теңдеулерін жазыңыз.
7. Хлорлы сутек алу үшін хлорлы темірді қандай затпен әрекеттестіру керек? Реакция теңдеулерін жазыңыз.
8. Хром (ІІІ) гидроксидін алу үшін хром (ІІ) сульфаты ерітіндісіне қандай затпен әрекеттестіру керек? Реакция теңдеуін жазыңыз.
9. Натрий гидроксидінің, барий гидроксидінің, хром гидроксидінің құрылымдық формуласын жазыңыз.
10. Мына қосылыстарды қалыпты тұздарға айналдыру реакциясының теңдеулерін жазыңыз: Na2HPO4, Ca(H2PO4)2, Al(OH)2Cl, Al(OH)SO4, Bi(OH)2NO3 және осы тұздардың құрылымдық формулаларын жазыңыз.
11. Мына заттар өзара әрекеттескенде қалыпты және қышқылдық тұздар түзілу реакциясының теңдеулерін жазыңыз:
а) Н2SO4 + КОН = ә) Н2SO4 + Ca(ОН)2 =
б) Na2CO3 + HCl = в) Na2CO3 + Ca(OH)2 =
г) H3PO4 + NaOH = д) HNO3 + Al(OH)3 =
12. Мына заттар өзара әрекететескенде қалыпты және негіздік тұздар түзілу реакциясының теңдеулерін жазыңыз:
a) H2SO4 + Al(OH)3 = ә) HNO3 + Ві(OH)3 =
б) H2SO4 + NaOH = в) Cu(OH)2 + HCl =
13. Мына қосылыстарды қазақша химиялық және халықаралық номенклатура бойынша атаңыз:
а) NaNO3, NaNO2, CaCl2, MgSO4, K2CO3, (NH4)2SO4.
ә) NaHCO3, KHCO3, NaH2PO4, Na2HPO4, MgHPO4.
б) MgOHCl, Al(OH)2NO3, (MgOH)2SO4, Cu2(OH)2CO3.
14. Мына өзгерістерді жасауға болатын реакциялардың теңдеулерін жазыңыз:
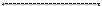 а) CuCl2 → Cu(OH)2 → CuSO4 → Cu → Cu(OH)2.
а) CuCl2 → Cu(OH)2 → CuSO4 → Cu → Cu(OH)2.
ә) Fe(NO3)3 → Fe2O3 → FeCl3 → Fe(OH)3 → Fe.
б) Al → AlCl3 → Al(OH)3 → Al2(SO4)3 → Al(NO3)3.
15. 2 г кальций карбонатын гидрокарбонатқа айналдыру үшін қалыпты жағдайда неше литр көмір қышқыл газы керек?
16. 10 г натрий хлориді мен 17 г күміс нитраты бар ерітінді өзара әрекеттескенде неше г күміс хлориді тұнбаға түседі? Реакция аяқталғаннан кейін ерітіндіде қандай заттар және қанша мөлшерде қалады?
3-4. Атом құрылысы және периодтық заң
Бақылау сұрақтары мен есептер
1. Периодтық заңның қазіргі кездегі тұжырымдамасының Д.И.Менделеев берген тұжырымдамадан өзгешелігі неде?
2. Периодта солдан оңға қарай элементтердің металдық қасиеті кеміп, бейметалдық қасиетінің артатынын қалай түсіндіруге болады?
2. Бір топтың әртүрлі топшасында орналасқан элементтердің ұқсастығы мен өзгешелігі неде?
3. Период шеңберіндегі ауыспалы металдардың химиялық қасиеттері неліктен ауыспалы емес элементпен салыстырғанда, аз дәрежеде өзгереді?
4. Бейметалдылықтың сандық сипаттамасы не болмақ?
6. Э.Резерфорд қандай тәжірибе жасады және атом құрылысының қандай теориясын ұсынды?
7. Э.Резерфорд теориясының қандай кемшіліктері болды?
8. Элементтің реттік нөмірі нені көрсетеді және оның физикалық мәні қандай?
9. Атом құрылысы туралы Н.Бор теориясының негізгі қағидалары қандай? Бор теориясы бойынша тұрақты орбитальдардың радиусы және сол орбитальдарды айналып жүрген электрондардың жылдамдығын қандай формулулардың жәрдемімен табады? Элемент атомының электрондары 3-орбитаға орналасқан. Осы орбитаның радиусы мен ондағы электрондардың жылдамдығын анықта.
10. Бас, орбиталь, магнит, спин квант сандары электрондардың қандай күйлерін көрсетеді? п=4 болғанда басқа квант сандарының мәндері қандай?
11. В.Паули принципі деген не және оның атомдардағы электрондардың орналасуын түсіндіруге маңызы қандай?
12. Клечковскийдің ережелерін айтып атомдағы электрондардың деңгейлер мен деңгейшелердегі орналасу ретін сызып көрсет.
13. Элемент атомының электрондық формуласы деген не және оны қалай жазады? Na, Si, S, Cl, Ar атомдарының электрондық формулаларын жаз.
14. Гунд ережесі қалай айтылады және оны пайдаланып азот, оттек, фтор, неон атомдарының электрондық-графикалық формулаларын жаз.
15. Электрондық-графикалық формуладан элементтің валенттілігін қалай анықтайды? P, S, Cl, Ar атомдарының қалыпты және қозған күйлеріндегі валенттіліктерін анықта.
16. Элемент атомының ядросы қандай бөлшектерден тұрады? Протондар мен нейтрондар қандай бөлшектер? Олардың сандарын қалай анықтайды? 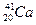 және
және 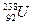 элементтерінің ядроларындағы нейтрондар санын анықтаңдар.
элементтерінің ядроларындағы нейтрондар санын анықтаңдар.
17. Изотоптар, изобарлар деген не? Мысалдар келтір. Атомдардың массалары неге бөлшек сандар болып келеді?
18. α, β-, β+-ыдыраулар және ядроға электрон қосып алу деген не? Мысалдар келтіре отырып түсіндір.
19. Мына табиғи ыдырау реакцияларының теңдеулерін аяқтау керек:
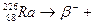
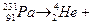
20. Мына жасанды радиоактивті ыдырау реакцияларының теңдеулерін аяқта:
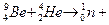
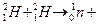
5. Химиялық процестердің жүру бағыты.
Бақылау сұрақтары мен есептер
1. Процестің энтропиялық факторы дегеніміз не?
2. Химиялық процестің бағыты энтальпиялық факторға да, энтропиялық факторға да тәуелді екендігін мысалдармен түсіндіріңіз.
3. Заттың стандартты энтропиясы деген не?
4. Стандартты жағдайда белгілі бір процестің жүруіне байланысты жүйенің энтропиясының өзгеруі қалай анықталады?
5. Изобара-изотермиялық потенциал немесе Гиббстің еркін энергиясы дегеніміз не? Мына химиялық процестер туралы не айтуға болады, егер:
1) ∆ G <0; 2) ∆ G >0; 3) ∆ G =0.
6. Зат түзілуінің стандартты изобара-изотермиялық потенциалы дегеніміз не?
7. Реакцияның бағыты энтропиялық фактордың өзгеруіне байланысты болатын жағдайларды (шарттарды) ∆G =∆Н - Т∆S теңдеуі бойынша анықтаңыз.
8. Неге кейбір реакциялар ∆G0298 мәні теріс болса да жүрмейді? Олардың жүруі үшін қандай шарттар орындалуы керек?
9. Кейбір заттар ∆G0298 түзілу мәні оң болса да түзіледі. Неліктен? Мұндай заттардың ашық жолдары туралы не айта аласыз?
1. Берілген әрбір реакция үшін:
1) Реакцияның стандартты энтальпиясын (кДж), есептеңіз;
2) Реакция типін (экзотермиялық немесе эндотермиялық), анықтаңыз;
3) Стандартты энтропияның өзгеруін (Дж/к) есептеңіз;
4) Оқшауланған жүйеде стандартты жағдайда реакция өздігінен жүре алады ма?
5) Реакцияның 298 К температурадағы стандартты Гиббс энергиясын (кДж) есептеп, реакцияның өздігінен жүретін-жүрмейтінін анықтаңыз.
6) Реакцияның 1000 К температурадағы ст. Гиббс энергиясын (кДж) есептеп, реакцияның өздігінен жүретін-жүрмейтінін анықтаңыз.
7) Реакцияның станд. Гиббс энергиясы нөлге тең болатын жағдайдағы температураны (Кельвин бойынша) анықтаңыз:
a. 2SO3(г) = 2SO2(г) + O2(г)
∆H0, кДж/моль -396 -297 0
S0, Дж/(К·моль) 257 248 205
b. Fe2O3(қ) + 3H2(г) = 2Fe(қ) + 3H2O(г)
∆H0, кДж/моль -824 0 0 -242
S0, Дж/(К·моль) 87 131 27 189
c. 2NO(г) + O2(г) = 2NO2
∆H0, кДж/моль +90 0 +33
S0, Дж/(К·моль) 211 205 240
d. 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г)
∆H0, кДж/моль -92 0 0 -24,2
S0, Дж/(К·моль) 187 205 223 189
e. CH4(г) + CO2(г) = 2СО(г) + 2Н2О(г)
∆H0, кДж/моль -75 -394 -111 0
S0, Дж/(К·моль) 186 214 198 131
f. Fе2О4(қ) + 4Н2(г) = 3Fе(қ) + 4Н2О(г)
∆H0, кДж/моль -1118 0 0 -242
S0, Дж/(К·моль) 146 131 27 189
g. 2NO2(г) + Cl2(г) = 2NOCl(г) + O2(г)
∆H0, кДж/моль +33 0 +53 0
S0, Дж/(К·моль) 240 223 262 205
h. 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O
∆H0, кДж/моль -46 0 0 -242
S0, Дж/(К·моль) 192 205 192 189
6. Химиялық реакцияның жылдамдығы. Химиялық
тепе-теңдік
Бақылау сұрақтары мен есептер
1. Реакцияның жылдамдығы деген не? Химиялық реакцияның жылдамдығы қандай өлшем бірліктерімен өлшенеді? Химиялық реакциялардың жылдамдығы қандай факторларға тәуелді болады?
2. Әрекеттесуші массалар заңы қалай айтылады?
3. Ауамен салыстырғанда таза оттекте реакция жылдамдығының арту себебін түсіндіріңіз.
4. Реакция жылдамдығының температураға тәуелділігінің математикалық теңдеуін жазып түсіндіріңіз.
5. Егер реакция жылдамдығының температуралық коэффициенті 1,5-ке тең болса, температураны 30 градусқа көтергенде, реакция жылдамдығы неше есеге артады?
6. Температурасын 10 градусқа көтергенде реакция жылдамдығы 2 есе артады. Температурасын 500С және 100 градусқа арттырғанда, реакция жылдамдықтары неше еседен артады?
7. 200С-ге қыздырғанда реакция жылдамдығы 8 есе артқан болса, температуралық коэффициент неге тең?
 8. Мына реакцияда 2NO + О2 2NO2:
8. Мына реакцияда 2NO + О2 2NO2:
а) NO концентрациясын 2 есе арттырғанда;
ә) NO және О2 концентрацияларын 3 есе арттырғанда реакция жылдамдықтары қалай өзгереді?
Ерітінділер
Бақылау сұрақтары мен есептер
1. Ерітінді дегеніміз не?
2. Ерітіндінің концентрациясы дегеніміз не? Ерітінді концентрациясын белгілеудің қандай тәсілдері бар?
3. Қанықпаған, қаныққан және аса қаныққан ерітінділерге мысал келтіріңіз. Қаныққан және аса қаныққан ерітінділерді қалай әзірлеуге болады?
4. Концентрациясы пайызбен өлшенетін ерітінді, молярлық және нормальдық ерітінділер дегеніміз не?
5. Қатты, газ және сұйық заттардың суда еруі қандай факторларға тәуелді болады? Ерігіштік дегеніміз не? Мысалдар келтіріңіз?
6. Күкірт қышқылы ерітіндісінің ареометрмен өлшенген тығыздығы 1,105. Ерітіндінің пайыздық, молярлық және нормальдық концентрациялары қандай?
7. Аммоний сульфатының 20 мл ерітіндісі 20,94 г тартады және онда 3,24 г (NH4)2SO4 еріген болса, аммоний сульфатының ерігіштігін, пайыздық, молярлық, нормальдық концентрацияларын есептеңіз.
8. 42,34 г ерітіндіде 7,28 г еріген зат бар. Заттың ерігіштігі және ерітіндінің пайыздық концентрациясы қандай
9. Тығыздығы 0,9г/мл болатын 500 мл 28 пайыздық аммиак ерітіндісіне 1 л су қосылған. Түзілген ерітіндідегі аммиактың пайыздық концентрациясы қандай?
10. 500 мл 40 пайыздық (тығыздығы1,25г/мл) азот қышқылы ертіндісінен 10 пайыздық ерітінді әзірлеу үшін қанша су керек?
11. 2 л 44 пайыздық (ρ=1,46г/мл) КОН ерітіндісінен 12 пайыздық (ρ=1,1г/мл) қандай көлем ерітінді әзірлеуге болады?
12. 2 л 60 пайыздық (ρ=1,5г/мл) және 3 л 14 пайыздық (ρ=1,1г/мл) күкірт қышқылы ерітінділері араластырылған. Осыдан түзілген ерітіндінің пайыздық концентрациясын табыңыз.
13. 10 л 27 пайыздық (ρ=1,2г/мл) күкірт қышқылы ерітіндісін әзірлеу үшін 60 проценттік (ρ=1,5г/мл) және 14 проценттік (ρ=1,1г/мл) күкірт қышқылы ерітінділерін қандай көлемде араластыру қажет?
14. Мынадай ерітінділерді әзірлеу үшін әр заттың қандай салмақ мөлшері қажет?
а) 400 мл 0,2 Н., Na2CO3 ∙ 10H2O;
ә) 600 мл 0,4 Н., H2C2O4 ∙ 2H2O;
б) 2 л 0,5 Н., AlCl3
15. Мына ерітінділердің пайыздық концентрациясын есептеңіз:
а) 4,9 Н. күкірт қышқылының (ρ=1,15г/мл);
ә) 0,9 М. азот қышқылының (ρ=1,03г/мл).
16. Мына ерітінділердің молярлық және нормальдық концентрацияларын есептеңіз:.
а) 70 пайыздық (ρ=1,6г/мл) күкірт қышқылының;
ә) 70 пайыздық (ρ=1,4г/мл) күйдіргіш натрдың;
б) 20 пайыздық (ρ=1,1г/мл) ортофосфор қышқылының.
17. 3 л 0,5 Н. ерітіндісін әзірлеу үшін 92 пайыздық (ρ=1,83г/мл) күкірт қышқылының неше мл керек?
18. 1 л 2М ерітінді әзірлеу үшін 20 пайыздық (ρ=1,098г/мл) тұз қышқылының қандай көлемі жұмсалады?
19. 10 мл 10 пайыздық азот қышқылы ерітіндісін нейтралдау үшін 0,1 н. сілті ерітіндісінің неше мл қажет болады?
20. Лабораториялық сутек алу үшін қажетті күкірт қышқылы ерітіндісін тығыздығы1,83г/мл болатын 1 көлем H2SO4 ерітіндісіне 5 көлем су қосу арқылы әзірлейді. Әзірленген қышқылдың пайыздық концентрациясы қандай?
21. Қалыпты жағдайда 2 л хлор 5 л суда ерітілген. Ерітіндінің көлемін судың көлеміне тең деп алып, ерітіндідегі хлордың концентрациясын: а) салмақ пайызы және ә) моль бойынша табыңыз.
22. 66,8 г күкірт қышқылы 133,2 суда ерітілді. Осыдан түзілген ерітіндінің тығыздығы 1,25г/мл. Ерітіндінің: а) пайыздық, ә) молярлық және б) нормальдық концентрациясын есептеңіз.
23. 10 пайыздық ерітіндісінде сусыз соданың Na2CO3 бір молекуласына судың неше молекуласы келеді?
24. 20 пайыздық ерітіндісін алу үшін 500 г 5 пайыздық хлорлы натрий ерітіндісінен қанша суды буландыру керек?
25. 50 мл 2 Н. ерітіндісін әзірлеу үшін 68 пайыздық (ρ=1,4г/мл) азот қышқылының неше миллилитрі керек?
8. Электролиттік диссоциация. Тұздар гидролизі
Бақылау сұрақтары мен жаттығулар
1. И.А. Каблуковтың теориясы бойынша электролиттік диссоциация кезінде су қандай роль атқарады?
2. Электролиттік диссоциация теориясы бойынша қышқыл, негіз және тұз дегеніміз не? Қышқыл, негіз және тұз ерітінділері қалай диссоциацияланады?
3. Күшті және әлсіз қышқылдар мен гидроксидтерге мысалдар келтіріңіз. Диссоциациялану дәрежелерін салыстырыңыз.
4. Қандай жағдайларда электролиттер арасындағы реакциялар аяғына дейін жүреді? Иондық теңдеулерін жазып, мысалдар келтіріңіз.
5. а) натрий карбонаты мен барий нитраты және ә) темір сульфаты (ІІ) мен барий хлориді ерітінділері араластырылған. Реакция теңдеулерін молекулалық және иондық түрде жазып, осы реакциялардың мәнін түсіндіріңіз.
6. Мына реакциялардың теңдеулерін иондық түрде жазыңыз: а) темір хлориді (ІІІ) мен күміс сульфаты; ә) ортофосфор қышқылы мен кальций гидроксиді; б) калий сульфиді мен күкірт қышқылы; в) аммоний гидрокарбонаты мен тұз қышқылы; г) күйдіргіш калий мен күкірт қышқылы.
7. Ерітіндіде AgNO3, Ba(NO3)2, Zn(CH3COO)2 тұздарының қоспасы бар. Оның үстіне тұз қышқылының ерітіндісі құйылды. Мүмкін болатын реакциялардың иондық теңдеулерін жазыңыз.
9. Тұздардың гидролизі дегеніміз не?
10. Гидролиз дәрежесіне қандай факторлар әсер етеді?
12. Төмендегі тұздардың мүмкін болатын гидролиздену реакция теңдеулерін молекула және ион түрінде жазыңыз: темір хлориді (ІІІ), калий цианиді, калийдің үшінші фосфаты, натрий сульфиді, алюминий сульфаты, аммоний хлориді, аллюминий сульфиді, натрий сульфаты, калий нитраты.
13. Мына тұздардың сулы ерітінділері қандай реакция ортасын көрсетеді: калий хлориді, калий сульфаты, натрий цианиді, натрий сульфиді, аммоний сульфаты, хром хлориді, калий нираты, калий сульфиді.
14. Температура артқанда және төмендегенде, концентрациясы артқанда және төмендегенде гидролиздену тепе-теңдігі қай бағытқа өзгереді? Мысалдар келтіріңіз.
15. Қалыпты (орта) тұздардың сулы ерітінділері қышқылдық, сілтілік не нейтрал орта көрсететіні неліктен? Мысалдар келтіріңіз.
16. Топырақты ізбестеу қандай мақсатта жүргізіледі?
17. Темір тұзына (ІІІ) натрий карбонатымен әсер еткенде темір карбонаты емес, темір гидроксиді (ІІІ) түзіледі. Мұны қалай түсінесіз?
9. Кешенді қосылыстар
Бақылау сұрақтары мен жаттығулар
1. Қандай тұздарды жай, қос және кешенді тұздар деп атайды? Осы қосылыстардың арасына ашық жік қоюға бола ма?
2. Кешен түзуші, лиганд, кешенді қосылыстың ішкі және сыртқы сферасы, координациялық сан дегендер не? Кешенді қосылыстың структуралық формуласын жазып түсіндіріңіз.
3. Мына тұздарда темірдің валенттілігі нешеге тең?
K3[Fe(CN)6], K4[Fe(CN)6], Fe3[Fe(CN)6]2, Fe4[Fe(CN)6]3.
Осы заттарды рационалды номенклатура бойынша атаңыз.
4. Төмендегі кешенді қосылыстардағы кешен түзушінің зарядын және координациялық санын табыңыз:
К3[Fe(CN)6], К4[Fe(CN)6], [Pt(NH3)4Cl2]Cl2, K2[PtCl6], [Ag(NH3)2]NO3, [Co(CH3)5NO2]Cl2.
5. Кадмийдің координациялық саны 4 деп, К+, Cd2+ және CN – иондарынан түзілген кешенді қосылыстың формуласын жазыңыз, атын атаңыз.
6. Үш валентті хромның координациялық саны 6 екенін ескеріп, төменгі тұздарды кешенді қосылыстар түрінде жазыңыз.
а) Co(NO2)3 ∙ 6NH3,
ә) Co(NO2)3 ∙ 3NH3,
б) Co(NO2)3 ∙ KNO2 ∙ 2NH3,
в) Co(NO2)3 ∙ 3KNO2.
Рационалды номенклатура бойынша аттарын атаңыз.
7. Формуласы CoBrSO4 ∙ 5NH3 екі изомер бар. Бір изомер ерітіндісіне Ba2+ ионымен әсер еткенде тұнба бермейді, ал Ag+ ионымен әсер еткенде тұнба береді. Екінші изомерлер ерітіндісі Ag+ ионымен тұнба бермейді, ал Ba2+ ионымен тұнба береді. Осы изомерлердің координациялық формуласын жазыңыз. аттарын атаңыз.
8. Төмендегі молекулалық теңдеуді аяқтап реакция теңдеуін ион түрінде жазыңыз.
CuSO4 + K4[Fe(CN)6] →
KCl + [Cu(NH3)4]Cl2 →
FeCl3 + K4[Fe(CN)6] →
9. Мына қос тұздарды кешенді қосылыстар түрінде жазыңыз:
Al2(SO4)3 ∙ K2SO4, PtCl ∙ 2KCl, Fe(CN)3 ∙ 3KCN,
CoCl3 ∙ 4NH3 ∙ H2O, 2NH4Br ∙ CuBr2 ∙ 2NH3, KCN ∙ Co(CN)3 ∙ 2H2O.
10. Мына кешенді қосылыстарды қалай алуға болады:
K2[HgJ4], [Ni(NH3)6]Cl2, H2[SnCl6].
11. Тұрақсыздық константасы таблицасын пайдаланып, мына иондардың ішіндегі тұрақтылауын көрсетіңіз:
[Cd(NH3)4]2+, [Cu(CN)4]2–, [HgJ4]2–, [Ag(NH3)2]+.
10. Тотығу-тотықсыздану реакциялары
Бақылау сұрақтары мен жаттығулар
1. Реттік нөмірі 11, 21, 38, 48 және 75 элемент атомдарының электрондық құрылымын анықтап, электрондық формулаларын, графиктік бейнеленуін жазыңыз.
2. Қайсы элементтің атомдарының сыртқы және сырттан санағанда екінші қабатында мынадай электрондар болады:
а) 2s22p2, б) 3s23p63d104s24p5,
ә) 3s2p63d104s2, в) 4s24p64d75s1.
3. Мына қосылыстардағы элементтердің валенттігін және тотығу дәрежелерін анықтаңыз: MnO2, K2MnO4, POCl3, K2Cr2O7, NaClO, Na3AsO4, H2SO3.
4. Мына реакциялардың қайсысы тотығу-тотықсыздану реакцияларына жатады:
HCl + KOH = KCl + H2O,
H2SO4 + BaCl2 = BaSO4 + 2HCl,
Mg + 2HCl = MgCl2 +H2,
CaCO3 = CaO + CO2,
2NaHCO3 = Na2CO3 + CO2 + H2O.
5. Мына реакция теңдеулеріндегі тотықтырғыш пен тотықсыздандырғышты анықтаңыз:
C + H2SO4 → CO2 + SO2 + H2O,
KClO3 → KCl + O2,
H2 + O2 → H2O.
6. Төменде келтірілген иондардың қайсысы: а) тек тотықтырғыш, ә) тек тотықсыздандырғыш, б) әрі тотықтырғыш, әрі тотықсыздандырғыш бола алады:
K+, Cl5+, S2-, S4+, S6+, N3–, N5+, Al3+,
Mn2+, Cr3+, Cr6+, Mn7+Mn4+.
7. Төменде келтірілген мысалдарда атомның және ионның өзгерістерге ұшырауы үшін қанша электрон алынады не беріледі:
O2– → O0, N3– → N5+, As3+ → A5+,
Mg2+ → Mg0, As0 → As5+, S2– → S6+,
S6+ → S2–, N5+ → N3+, Mn2+ → Mn7+.
8. Төмендегі реакциялардың теңдеулерін коэффициент қойып теңестіріп, тотықтырғыштар және тотықсыздандырғыштарды көрсетіңіз:
а) HNO3 + Cd → Cd(NO3)2 + N2O + H2O,
ә) HNO3 + Zn → Zn(NO3)2 + NH4NO3 + H2O,
б) K2Cr2O7 + H2S + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O,
в) KMnO4 + H2S + H2SO4 → K2SO4 + MnSO4 + S + H2O,
г) KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O,
д) AgNO3 + J2 + H2O → AgJO3 + HNO3 + AgJ,
е) HgO + Cl2 → Cl2O + HgCl,
ж) KOH + Cl2 → KCl + KClO3 + H2O.
9. Мына төмендегі тотығу-тотықсыздану реакцияларын теңестіріп коэффициенттерін қойыңыз. Ондағы тотықтырғыштар мен тотықсыздандырғыштарды көрсетіңіз.
а) As2S3 + HNO3 → H3AsO4 + H2SO4 + NO + H2O;
ә) As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO;
б) PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O;
в) FeS2 + O2 → Fe2O3 + SO2;
г) FeS + HNO3 → Fe(NO3)3 + S + NO2 + H2O;
д) Fe(CrO2)2 + Na2CO3 + O2 → Na2CrO4 + Fe2O3 + CO2;
е) FeCl2 + H2O2 + NaOH → Fe(OH)3 + NaCl;
ж) KMnO4 + H2O2 + Н2SO4 → MnSO4 + K2SO4 + O2 + H2O.
Тест сұрақтары
1. Атом-молекулалық ілім. Химияның негізгі заңдары
1. Ең алғаш атом-молекулалық ілімді ашқан ғалымның есімін атаңыз:
1. А.Н.Несмеянов
2. А.Л.Лавуазье
М.В.Ломоносов
4. А.М.Бутлеров
5. А.А.Чугаев
2. 1778 ж. М.В.Ломоносов ашқан заң қалай оқылады?
1. көлемдердің қатынас заңы
2. эквиваленттер заңы
3. массасының сақталу заңы
4. зат құрамының тұрақтылық заңы
5. еселі қатынас заң
3. Еселі қатынас заңын ашқан ғалымды көрсетіңіз:
Дальтон
2. Дюлонг-Пти
3. Лавуазье
4. Гей-Люссак
5. Бертолле
4. Газдардың молекулалық массасын анықтайтын формуланы көрсетіңіз:
1. 
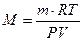 2.
2. 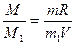
3. 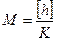 4.
4. 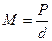
5. 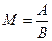
5. Масса сақталу заңының дұрыс тұжырымдамасын көрсетіңіз:
1. реакцияға дейінгі заттың салмағы реакциядан кейінгі зат салмағына тең
2. реакцияға дейінгі және реакциядан кейінгі энергия өзгермейді
3. оқшауланған жүйеде химиялық реакцияға дейінгі және кейінгі заттардың массасы мен энергиясының қосындысы тұрақты шама болады, яғни 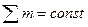 және
және 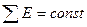
4. заттың массасы мен қозғалысы өзгермейді
5. заттың массасы үнемі өзгереді
6. Құрам тұрақтылық заңын ашқан автордың есімін атаңыз:
1. Ломоносов
2. Лавуазье
Пруст
4. Бертолле
5. Берцеллиус
7. Қай заңдар химияның стехиометриялық заңына қатысты екенін көрсетіңіз:
1. энергияның сақталу заңы мен еселі қатынас заңы
2. массасының сақталу заңы мен эквиваленттер заңы
3. құрам тұрақтылық, еселі қатынас, эквиваленттер заңы, газдар заңы (Гей-Люссак және Авогадроның көлемдік қатынас)
4. газ массасының сақталу заңы
5. заттардың стехиометриялық әрекеттесуі туралы Дальтон заңы.
8. Авогадро заңының дұрыс тұжырымдамасын көрсетіңіз:
1. бірдей жағдайда, бірдей көлемде газдардағы молекулалар саны бірдей болады
2. газдардың бірдей көлемінде 00К мен 1 атмосфералық қысымда молекула саны бірдей болады
3. қалыпты жағдайда газ тәрізді заттардың көлемі әр уақытта бірдей болды
4. қалыпты жағдайда бірдей көлемде молекула саны әр уақыта бірдей болмайды
5. газдардың бірдей көлемінде қалыпты жағдай молекула саны әртүрлі болады
9. Авогадро заңынан туындайтын салдардың математикалық формуласын көрсетіңіз:
1. 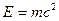
2. 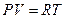
3. 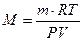
4. 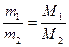
5. 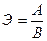
10. «Авогадро саны» деген ұғымның дұрыс мағынасын көрсетіңіз:
1. 6,022·1023 тең болатын 1 г сутектегі атомдар саны
2. 6,022·1023 тең болатын 8 г оттектегі атомдар саны
3. 6,022·1023 тең болатын 12 г (12С изотопы) көміртегі атомдар саны
4. бір эквивалент сутегіндегі структуралық мөлшердің саны
5. бір эквивалент оттегіндегі структуралық мөлшердің саны
11. Заттың «молі» ұғымының дұрс анықтамасын белгілеңіз:
1. салыстырмалы атомдық бірлігінде берілген атомның массасы
2. көміртектің 12С изотобында 12 г атом болса, сонша молекула, атом, ион немесе басқа құрылымдық бірліктер болатын заттың мөлшері
3. 1 г сутекте қанша атом болса, сонша құрылымдық бірліктер болатын заттың мөлшері
4. 16 г оттекте қанша атом болса, сонша құрылымдық бірліктер болатын заттың мөлшері
5. екі еселенген эквиваленттік масса
12. Элементтің «эквиваленті» ұғымының дұрыс жауабын көрсетіңіз:
1. атомдық бірлікпен көрсетілген атомның массасы
2. химиялық реакцияларда 1 моль сутек атомымен әрекеттесетін немесе алмастыратын элементтің мөлшері
3. заттың 1 молінің массасы
4. 1 моль атомдарының массасы
5. 1 моль/л-дегі 1 моль заттың массасы
14. Авогадро тұрақтысы 6,022·1023 тең, себебі
1. моль-Авогадро санын құрайтын (NA=6,022·1023 ) дискретті бөлшектерден (жүйенің құрылымдық элементтері) тұратын заттың мөлшері
2. моль-Авогадро санының жатысынан тең зат мөлшері
3. моль-Авогадро санының екі есе көбейтіндісіне тең зат мөлшері
4. моль-Авогадро санының үш есе көбейтіндісіне тең зат мөлшері
5. моль-1эквиваленттегі заттың массасы.
Мына қосылыстардың ішінен бертоллидтерді анықтаңыз:
1. H2O, CH4
2. H2S, H2SO3
3. NaOH, Na2O
4. MgO, MgCl2
5. Cu3P, Fe3Si2
Әртүрлі әдістермен СО2 алынған:
а) С+О2 =СО2; б) 2СО+О2=2СО2; в) СаСО3=СаО+СО2 бұл қандай заңның дәлелі? Дұрыс жауабын көрсетіңдер:
1. эквиваленттер заңы
2. Авогадро заңы
3. құрам тұрақтылық заңы
4. еселі қатынастар заңы
5. масса сақталу заңы
Мына өрнек 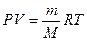 арқылы нені табуға болады? Дұрыс жауабын анықтаңыз:
арқылы нені табуға болады? Дұрыс жауабын анықтаңыз:
1. заттың эквивалентін
2. Авогадро санын
3. заттардың молекулалық массасын
4. газ тұрақтысын
5. заттардың атомдық массасын анықтауға болады.
Күкіртті сутек қышқылының 1 молі нешеге тең?
1. 34
2. 30
3. 68
4. 17
5. 25
200 г К2SO4 неше моль калий сульфаты бар??? ?????
1. 2 моль
2. 1,1 моль
3. 2,5 моль
4. 3,0 мол
5. 3,5 моль
Қалыпты жағдайда 0,1 моль мырыш артық НСІ әрекеттескенде қандай көлем сутек бөлінеді? Дұрыс жауабын беріңіз.
Zn+2HCI=H2+ZnCI2
1. 22,4 л
Л
3. 44,8 л
4. 4,48 л
5. 224 л
2. Бейорганикалық қосылыстардың негізгі кластары
1. Бейорганикалық қосылыстардың барлығы бөлінеді
А. Жай және күрделіге
В. Тұз түзетін және тұз түзбейтін
С. Иондық және коваленттіге
Д. Қатты және сұйыққа
2. Екі қышқылдық оксид бірімен бірі әрекеттеседі, егер де...
А. Оксидтің бірі күшті қышқылға, ал басқасы әлсізге сәйкес болса
В. Екі оксидте күшті қышқылға сәйкес болса
С. Тотығу-тотықсыздану реакциясы жүрсе
D. Реакция сулы ортада жүрсе
3. Сілтілік ортаны сапалық байқау үшін индикатор- фенолфталеинді өте жиі қолданады. Әрқайсында 4г натрий гидроксиді мен күкірт қышқылы бар. Осы екі ерітіндіні араластырып,фенолфталеин қосқанда оның ортасы қандай түсте болады?
А. Натрий гидроксиді артық мөлшерде (сілтілік орта)-ерітінді қызыл-күрен түсті
В. Қышқыл артық мөлшерде (қышқылдық орта)-ерітінді жасыл-көк түсті
С. Заттар эквимолекулярлы мөлшерде (бейтарап орта)-ерітінді түссіз
D. Натрий гидроксиді аз мөлшерде-ерітінді ашық –жасыл түсті
4. Кобальт(II) хлориді кристаллогидратының формуласын айқындаңдар, егер де ондағы оттектің массалық үлесі 25% құраса
А. CОCI2 ·6H2О
B CОCI2 ·4H2О
C CОCI2 ·3H2О
D CОCI2 ·H2О
5. Магний карбонатына азот қышқылымен әсер етсе, бөлінеді....
А. Иіс газы
В. Күркіреуік газ
С. Шаттандырғыш газ
D. көмір қышқыл газы
6. Үш сынауықта (пробиркада) кристалдық калий сульфаты, мырыш сульфаты және калий сульфиті бар. Осы үш тұзды жеке танып білуге көмектесетін реактивтерді атаңдар.
А. Барий хлориді
В. Азот қышқылы
С.Су
D. қызыл қандық тұз
7. Сілтілердің ерітінділері келесі жай заттармен әрекеттесуге қабілетті:
А.CI2, S, N2 , Br2 , Si
В.C, О3 , P, F2 , Si
С.J2 , Zn , Cu, S , Mn
D.Br2 , S, P, Si , Zn
8. 6,4 г кальций карбидінен қанша грамм кальций гидроксидін алуға болады?
А. 7,4г
В.14,8г
С. 3,7г
D.кальций гидроксидін кальций карбидінен алмайды, оны тек кальций карбонатынан алады
9. Суда еритін негіздер күшті электролит, бірақ та бір ескерту бар, суда еритін гидроксид әлсіз (нашар)негіз болып шықты, ол -...
А.AI (ОH)3
В.CsОH
С.NH 4ОH
D.Ba(ОH)2
10. Күкірт, хлор, дихром және ортофосфор қышқылдары берілген. Осылардың ангидридтерінің формуласын келтіріңдер
А. SО3, CI2О7, CrО3, P2О5
В. SО3, CI2О, Cr2О3, P2О5
С. SО2, CI2О7 , CrО3 , P2О3
D. SО2, CI2О3, CrО , P2О5
3-4. Периодтық жүйе және атом құрылысы
1. Қазіргі ғылыми тұрғыдан қарағанда периодтық заңның дұрыс тұжырымдамасын көрсетіңіз:
1. жай заттар мен олардың қосылыстарының қасиеттері олардың атомдық массаларына периодтық түрде тәуелді
2. жай заттар мен олардың қосылыстарының қасиеттері атомдық массаларының қосылыстарына периодты түрде тәуелді
3. жай заттар мен олардың қосылыстарының қасиеттері олардың атомдары ядро зарядының санына периодты түрде тәуелді.
4. жай заттар мен олардың қосылыстарының қасиеттері атомдар зарядының қосындысына периодты түрде тәуелді
5. жай заттардың қасиеті атом радиусына периодты түрде тәуелді.
2. Көрінетін жарық тербелісі толқын ұзындығының қай аймағында болады?
1. l» 10-6м
2. l = 500 м
3. l= 10-200 нм
4. l= 10-9м
5. l= 10-15м
3. Планк тұрақтысының мәнін көрсетіңіз:
1. h=6,626×10-27 эрг×с
2. h=0,1×10-10 эрг×с
3. h=const
4. h>1
5. h=0
4. Резерфордтың атом құрылысы моделінің дұрыс тұжырымдамасын белгілеңіз:
1. планетаралық модель: оң зарядтардың барлығы атомның орталығында ядроға жиналған, оның айналасында мөлшері ядродан ~ 10.000 есе үлкен қашықтықтан жеңіл теріс зарядталған электрондар айналып жүреді.
2. оң заряд барлық атом бойынша таралған, ал теріс заряд оған бекітілген.
3. электрондар қисық орбитальмен ядроны айналып жүреді
4. электрондар екі жақты сипат көрсетеді
5. атомның барлық көлемінде оң және теріс зарядтар ретсіз орналасқан.
5. Бор постулатының дұрыс мағынасын көрсету керек:
1. электрондар ядроны айналып жүрмейді, ал электрон бұлттары жеке күйінде болады
2. ядроны электрондар тек тұрақты белгілі орбитальдармен айналады, бұл орбитада энергия бөлінбейді және энергия сіңірмейді
3. электрон тек өз осінде айналады
4. ядроны электрондар Бор орбитасымен айналады және үздіксіз энергия сіңіреді
5. электрон тек өз осінде айналады, әр үздіксіз энергия бөлінеді
6. Де-Бройль теңдеуінің дұрыс жазылуын көрсетіңіз:
1. 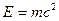
2. l= vc
3. 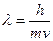

4. E=hv
5. E=mc
7. Белгісіздік принципінің авторы кім?
1. М.Планк
2. О.Девиссон
В.Гейзенберг
4. Джермер
5. Полинг
8. Қазіргі атом құрылысы теориясының (толқындық функция теңдеуі) авторы кім?
1. М. Планк
Шредингер
3. Полинг
4. Малликен
5. Девиссон
9. n-«бас квант саны» ұғымының дұрыс анықтамасын белгілеңіз:
1. n-электрон бұлтының мөлшері
2. n-электрон бұлтының пішіні
3. n-атомдағы электронның энергиясын анықтайтын кванттық күйі
4. n-атомдағы электронның энергетикалық деңгейі, ол орбитальдағы электрон энергиясын көрсетеді
5. n-қозғалыс мөлшері
10. l– «орбиталь квант саны» түсінігінің дұрыс анықтамасы қандай?
1. l - импульс моменті
2. l –электрон спині
3. l-энергетикалық деңгей
4. l- орбитальдардың кеңістіктегі пішінін көрсетеді
5. l- ядроны айналушы электронның жылдамдығын анықтайтын векторлық шама.
11. m- «магнит квант саны» ұғымының дұрыс анықтамасын көрсетіңіз:
1. m- қозғалыс мөлшері
2. m- электрон бұлтының пішіні
3. m-кеңістіктегі электрон бұлтының бағытталуын сипаттайды
4. m-энергетикалық деңгей
5. m-энергетикалық деңгейше
12. s- «спин квант саны» ұғымының дұрыс анықтамасын анықтаңыз:
1. s- қозған атом орбитальдарының бірі
2. s-өзіндік магниттік моменті
3. s -электронның осі бойынша айналуы
4. s-магнит квант саның қозғалу осіне проекциясы
5. s-энергетикалық деңгейше
13. Паули принципінің дұрыс тұжырымдамасын анықтаңыз:
1. бірдей квант саны бар энергетикалық деңгейлер атомда бірнеше
2. бір атомда барлық квант саны бірдей екі электрон болуы мүмкін емес.
3. атомда квант саны бірдей екі электрон болады
4. квант саны бірдей электрондар атомның р деңгейшесінде болады
5. атомдағы барлық электрондардың энергиясы біркелкі
14. Шредингер теңдеуінің ерекшелігін көрсетіңіз:
1. микрообъектің табиғатының екі жақтылығын ескере отырып, микрожүйенің (атомның) күйін сипаттайды.
2. электронның энергиясын ескеріп, оның күйін сипаттайды
3. атомның газ күйін сипаттайды
4. электронның массасы мен энергиясының байланысын сипаттайды
5. атомның вакуумдегі күйін сипаттайды
15. «Орбиталь» түсінігінің дұрыс анықтамасын көрсетіңіз:
1. атомның қазіргі квантохимиялық моделі бойынша электронның атомда болуына рұқсат етілген энергетикалық күйі. «Орбиталь» термині осымен қоса электронның атом кеңістігінде таралуын, яғни ядро төңірегіндегі кеңістікте электронның болу ықтималдығын көрсетуге қолданылады
2. электронның атомда болмауының рұқсат етілген күйі
3. электронның атомдағы қозған күйі
4. электронның атомдағы магниттік күйі
5. электронның жоғары энергетикалы күйі
16. Электронның орбитальдағы күйін қандай квант сандары анықтайды?
1. S=±1/2
2. n =1, 2, 3…
3. m = -1…0+1
N, 1, m
5. l=n-1
17. «Фотон» ұғымының физикалық мағынасы қандай?
1. жарық сәулесіндегі максимал энергия
2. жарық энергиясының hv- ге тең минимал мөлшері
3. фотон =1/2 hv
4. фотон 2 hv
5. фотон энергиясының өзгеру өлшемі
18. «Электрондық тығыздық» ұғымының дұрыс ережесін көрсетіңіз:
1. кеңістіктің белгілі бір жеріндегі энергияның максимал мөлшері
2. кеңістіктің белгілі бір жеріндегі энергияның минимал мөлшері
3. кеңістікте электрондарды табу ықтималдығы
4. орбитальдар жиынтығы
5. бірнеше электрондары бар атомдық орбиталь
19. «Иондану энергиясы» түсінігінің физикалық мағынасы:
1. нейтралды атомнан электронды алыстатуға қажетті энергия
2. электронның атомға қосылуында бөлінетін энергия
3. электронды алыс орбитальдан жақын орбитальға ауыстыруға қажетті энергия
4. электронды жақын орбитальдан алыс орбитальға ауыстыруға қажетті энергия
5. атомның электрондық қабығын бұзуға қажетті энергия
20. «Хунд ережесі» ұғымына дұрыс анықтама беріңіз:
1. энергетикалық деңгейлерге электрондар бөлінгенде спин сандары қосындысы 0-ге тең болуы керек
2. энергетикалық деңгейлерге электрондар бөлінгенде спин сандар қосындысы минимал болуы керек
3. энергетикалық деңгейшелерге электрондар бөлінгенде спин сандарының қосындысы максимал болуы қажет
4. спин сандары қосындысы > 1 болуы шарт
5. спин сандары қосындысы < 1 болуы шарт
21. Клечковский ережесінің дұрыс тұжырымдамасын көрсетіңіз:
1. (n+l) қосындысы бірдей болған жағдайда орбитальдардың толуы бас квант саны «n» өсу бағытында жүреді
2. (n+m) қосындысы бірдей болған жағдайда орбитальдардың толуы бас квант саны «n» өсу бағытында жүреді
3. (n+s) бірдей болған жағдайда орбитальдардың толуы бас квант саны «n» өсу бағытында жүреді
4. периодтық системада элементтердің орналасуы олардың атомдарының электрондық құрылысына байланысты
5. (l+m) бірдей болғанда орбитальдардың толуы «l» азаюы бағытында жүреді.
22. «Электрон тартқыштық» ұғымының дұрыс анықтамасы қандай?
1. бос атомға электрон қосылған кезде бөлінген энергия-электрон тартқыштық деп аталады
2. атомнан электронды жұлып алуға қажетті энергия
3. электронды бір орбитальдан екінші орбитальға ауыстыруға қажетті энергия
4. жақын орбитальдан алыс орбитальға электронды ауыстыруға қажетті энергия
5. атомнан катионға айналуына тең энергия
23. Төмендегі қатарларды энергиясының өсуіне қарай орналастыру керек:
1. 1s1p2s
2. 1s2p2d
3. 1s2s2p3s3p3d
4. 1s1p2s2p3s
5. 1s2p2s2d3s3p
24. Төменде көрсетілген атомдық орбитальдар белгілеулерінің қайсысы дұрыс емес?
1. 4f
2. 1p
3. 3s
4. 3p
5. 3d
25. Электронға тән қасиетті көрсетіңіз:
1. корпускулалық
2. толқындық
3. корпускулалы-толқындық, екіжақты табиғаттылық
4. жылулық
5. электрлік
26. Мына 1s22s22р6 электрондық конфигурацияға сәйкес келетін бөлшекті белгілеу керек:
1. Na+ 2. Ne 3. F 4. Mg2+ 5. Al
27. Көрсетілген радиоактивті айналудың қай этапы a -ыдырауға жатады?
1) 2) 3) 4) 5)
23892U®23498Th®23490Pd®23492U®23090Th
1. 2-этап
2. 1-этап
3. 4-этап
4. 3-этап
5. 5-этап
28. Мына көрсетілген электрондық конфигурацияларда орбитальдардың дұрыс толтырылуын белгілеңіз:
1. 1s22s22p63s2
2. 1s22s22p6 …4p65s24d105p66s23f14
3. …2p63s23p63d10
4. 1s22p63s2
5. 3s24s2
29. Орбитальдық квант саны « l » электронның қандай қасиеттерін сипаттайды?
1. электрон бұлтының пішінін
2. электрон қозғалысының өзгерісін
3. кеңістіктің қандай нүктесінде электронның болуын
4. энергетикалық деңгейін
5. электронның жалпы энергиясын көрсетеді
30. Бір орбитальдың екінші орбитальға электрон ауысқанда энергиясы неге тең?
1. 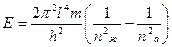 ккал
ккал
2. 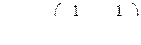 ккал
ккал
3. 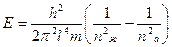 ккал
ккал
4. 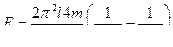 ккал
ккал
5. 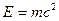
31. Атом ядросын атқылайтын бөлшектер ретінде қандай жағдайда қай элементтер бөлшектер қолданылады?
1. қалыпты жағдайда протондар, электрондар, a-бөлшектер
2. қатты қыздырғанда протондар, нейтрондар, b-бөлшектер, l , n, a, b позитрондар
3. күрделі қондырғыларда циклотрондар мен фазотрондар, жоғары жылдамдықта әртүрлі бөлшектер және ядроның өзі де
4. жоғары қысымда нейтрондар мен позитрондар
5. жоғары температурада нейтрал атомдар
32. Ядросының заряды 90 элементінен a -бөлшегі бөлінгенде қандай элемент пайда болады?
1. Po
2. Ra
3. Fr
4. Ac
5. Pв
33. Периодтық заңның физикалық мағынасы қандай?
1. Элементтің ядро заряды немесе реттік нөмірінің өсуіне қарай элементтердің қасиеті периодты түрде өзгереді
2. атомдық салмақтың өсуіне қарай элементтердің қасиеті периодты түрде өзгереді
3. валенттік қабаттың ұқсас электрондық құрылымдары периодты түрде қайталанатындықтан элементтердің қасиеті периодты түрде өзгереді
4. элементтердің валенттілігі периодты түрде өзгеруіне байланысты элементтердің қасиеті периодты түрде өзгереді
5. периодтық заңның физикалық мағынасы болмайды
34. Иондану энергиясын сандық жағынан сипаттайтын шаманы анықтаңыз:
1. элементтің электрон қосып алу қабілеттілігі
2. элементтердің тотықсыздандырғыш қасиеті
3. электронның ядромен байланысы
4. мына Э®Э++е- процестің энергиясы
5. элементтің тотықтырғыш қасиеті
35. Элементтердің ішкі периодтылығы неге байланысты?
1. p, d, f – орбитальдардың толтырылу ерекшеліктерімен
2. ядроны электрондардың әртүрлі жабуымен
3. элементтердің қасиеттерінің үздіксіз өзгеруімен
4. электронның үзілуінің қиындығымен байланысты
5. электрондардың үзілуінің жеңілдігімен байланысты.
36. 7-ші элементтің дұрыс электрондық конфигурациясын көрсетіңіз:
1. R-5d16s2
2. 2, 8, 18, 18, 8, 3
3. 1s2 2s2 2p3
4. 2, 8, 18, 20, 8, 1
5. 2, 8, 18, 20, 8, 2
37. Мына 1s22s22p2z2p1y2p1x электрондық бұлттардың пішіні қай элементке сәйкес келеді, белгілеңіз:
1. B
2. N
3. Ne
4. O
5. F
Дата: 2019-05-29, просмотров: 2091.