Қайталау сұрақтары
1. Ерітінділердегі заттардың электролиттік диссоциациясы дегеніміз не?
2. Иондық байланыстағы электролит диссоциациясының механизмін түсіндіріңіз.
3. Полярлы байланыстағы электролит диссоциациясының механизмі қандай?
4. Электролиттік диссоциация теориясының негізгі ережелерін тұжырымдаңыз. Электролиттерге және бейэлектролиттерге қандай заттар жатады?
5. Электролиттік диссоциация теориясы тұрғысынан а) қышқылдардың, ә) негіздердің жалпы қасиеттерін қалай түсіндіруге болады?
6. Электролиттік диссоциация дәрежесі нені сипаттайды?
7. Әлсіз электролиттің диссоциациялану дәрежесі мен оның ерітіндідегі концентрациясының арасындағы байланысты көрсетіңіз. Оствальдтың сұйылту заңы қалай тұжырымдалады?
8. Қандай электролиттер ерітіндіде сатылы диссоциацияға ұшырайды?
9. Неге кейбір негіздер амфотерлі деп аталады?
10. Қышқылдар мен негіздердің қандай теориялары бар?
Есептер мен жаттығулар
Мысал 1. Балқытқыш қышқылдың HF (с(HF) = 0,01 моль/л) судағы ерітіндісіндегі барлық бөлшектердің концентрациясын анықтаңыз. Осы ерітіндідегі қышқылдың диссоциациялану дәрежесі α = 25%.
Шығарылуы. Электролиттік диссоциация теңдеуін жазамыз:
 НF Н+ + F-
НF Н+ + F-
Берілген НF мөлшерінің (0,01 моль/л) 25% ғана диссоцияланған болса,
υ(НF) = 0,01 моль ∙ 0,25 = 0,0025 моль = 2,5 ∙ 10-3 моль.
Диссоциацияланбаған НҒ молекулаларының концентрациясы
[НF] = 0,01 моль - 0,0025 моль/л = 0,0075 моль/л = 7,5 ∙ 10-3 моль/л.
Әрбір молекула НF диссоцияланғанда бір катион Н+ және бір анион F- түзілетіндіктен, [Н+] = 2,5∙10-3 моль/л; [F-] = 2,5∙10-3 моль/л.
Мысал 2. Судағы ерітіндісінің концентрациясы 0,01 моль/л сірке қышқылының диссоциациялану дәрежесі қандай? Сірке қышқылының диссоциациялану константасы К = 1,86∙10-5.
Шығарылуы. Диссоциациялану теңдеуін жазамыз:
 СН3СООН Н+ + СН3СОО-
СН3СООН Н+ + СН3СОО-
с – сα сα сα
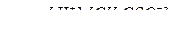
Алдыңғы есептегідей, диссоциацияға ұшыраған барлық бөлшектердің концентрациясын берілген концентрация (с) мен диссоциялану дәрежесі (α) арқылы есептейміз:
[Н+] = [СН3СОО-] = сα
[СН3СООН] = с – сα
Енді диссоциация константасының теңдеуін осы шамалар арқылы жазамыз:
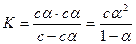
Егер электролит әлсіз болса (α<<1), К = сα2, немесе 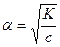 .
.
Осыдан
 немесе 4,5%.
немесе 4,5%.
1. Берілген заттарды судағы ерітінділерінің (с = 0,1 моль/л) диссоцияциялану дәрежесіне байланысты 3 топқа бөліп жазыңыздар: 1) күшті электролиттер; 2)әлсіз электролиттер; 3) орташа электролиттер: KCl, CH3COOH, HNO3, NaOH, HF, NH3∙H2O, CuSO4, H2CO3, Ca(OH)2, Fe(NO3)3, H2S, H2SO4, KMnO4, H2SO3, H3PO4, K2SO3.
2. Концентрациясы (с=0,01 моль/л) азотты қышқылдың сулы ерітіндісінің электролиттік диссоциациялану дәрежесі α(HNO2) = 20%. Ерітіндідегі түзілген барлық бөлшектердің концентрациясын есептеңіз.
Жауабы: [H+] = [NO2-] = 2∙10-3 моль/л; [HNO2] = 8∙10-2 моль/л.
3. Хлорсутек қышқылының 0,01 М ерітіндісінде сутек иондарының концентрациясы 0,01 моль/л-ден төмен, 0,0079 моль/л болатындығы байқалған. Бұл жағдайда қалай түсіндірер едіңіз?
4. Құмырсқа қышқылының қандай концентрациясында диссоциациялану дәрежесі сірке қышқылының с(СН3СООН)=0,02 моль/л ерітіндісінің диссоциациялану дәрежесіндей болады? Жауабы: 0,2 моль/л.
5. Фосфор қышқылының үш сатыда диссоциациялану константасының өрнегін көрсетіңіз.
6. Периодтық жүйенің бір тобында орналасқан элементтерден түзілген оттекті қышқылдардың салыстырмалы күші қалай өзгереді? Төртінші, бесінші, алтыншы топ бойынша мысалдар келтіріңіз.
7. Периодтық жүйенің бір тобының элементтерінен түзілген негіздердің күші қалай өзгереді? Бірінші және екінші топ бойынша мысалдар келтіріңіз.
8. Мына қатар бойынша HClO–HClO2–HClO3–HClO4 қышқылдық қасиеттің артуы байқалады. Осы жағдайды қалай түсіндіре аласыз?
9. Берілген қышқылдардың қайсысы күшті: H2SO4 және H2SO3; және HNO3 және HNO2? Жауаптарыңызды қышқылдардағы Н–О–Э байланыстарының полярлығына қарап тұжырымдаңыз.
10. Берілген қатар бойынша диссоциациялану түрінің өзгеруі мен гидроксидтердің күшінің өзгеруін түсіндіріп беріңіз: NaOH – Mg(OH)2 – Al(OH)3 – H2SiO3 – H3PO4 – H2SO4 – HClO4.
Судың диссоциациялануы. Сутектік көрсеткіш.
Қайталау сұрақтары.
1. Судың иондық көбейтіндісі дегеніміз не? Оны қалай анықтауға болады?
2. Сутектік көрсеткіш (рН) қалай анықталады? Реакцияның ортасын анықтау үшін (сілтілік орта болса да) рН шамасын білу жеткілікті. Неліктен?
3. рН + рОН = 14 екендігін дәлелдеңіз.
4. Қышқылдық, бейтарап және сілтілік ортада сутек иондары мен гидроксид – иондардың концентрациясы қандай болады?
Мысал 1. Концентрациясы 0,001 моль/л HCl ерітіндісінің рН есептеңіз.
Шығарылуы. HCl толық диссоциацияланғанда сутек иондарының концентрациясы берілген ерітіндінің молярлық концентрациясына тең болады:
 HCl H+ + Cl-
HCl H+ + Cl-
0,001 0,001 0,001
рН = -lg[H+] = -lg 0,001 = -lg 10-3 = -(-3) = 3.
Мысал 2. Концентрациясы 0,001 моль/л Н2SО4 сулы ерітіндісінің рН анықтаңыз.
Шығарылуы. Н2SО4 молекуласы диссоциацияланғанда екі Н+ катионы түзіледі:
 Н2SО4 2Н+ + SО42-, олай болса [H+] = 2∙0,001 = 0,002 моль/л;
Н2SО4 2Н+ + SО42-, олай болса [H+] = 2∙0,001 = 0,002 моль/л;
2∙0,001 0,001
рН = -lg[H+] = -lg 0,002 = -lg 2∙10-3 = -lg 2 – lg 10-3 = -0,3 – (-3) = 2,7.
Эквиваленттің молярлық концентрациясы Ceq(H2SO4)=0,001 моль/л H2SO4 ерітіндісінде [H+]=0,001 моль/л; pH=3 болатынына көңіл аударыңыз.
Мысал 3. Концентрациясы с(NaOH) = 0,001 моль/л NaOH ерітіндісінің рН анықтаңыз.
Шығарылуы. ОН- иондарының концентрациясы ерітіндінің молярлық концентрациясымен бірдей болады:
 NaOH Na+ + OH-
NaOH Na+ + OH-
0,001 0,001 0,001
Ерітіндінің рН-ын екі түрлі жолмен есептеуге болады:
1. [H+] [ОH-] = 10-14 (250С) болғандықтан, 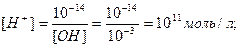 рН=-lg[H+] = -lg 10-11 = –(-11) = 11.
рН=-lg[H+] = -lg 10-11 = –(-11) = 11.
2. рН + рОН =14. рОН=-lg[ОH-]= -lg 10-3= –(-3)=3. рН=14 – рОН= 14–3 = 11.
Мысал 4. рН=4,60 тең ерітіндідегі сутек иондарының концентрациясын анықтаңыз.
Шығарылуы. рН=-lg[H+]; [H+] = 10-рН = 10-4,60 = 2,5∙10-5 моль/л.
Мысал 5. Құмырсқа қышқылының 1%-дық ерітіндісінің (тығыздығы ρ=1 г/мл, К=2,1∙10-4) рН есептеңіз.
Шығарылуы. 1 л 1%-дық ерітіндіде (ρ=1 г/мл) 10 г НСООН бар, олай болса 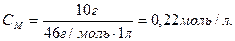
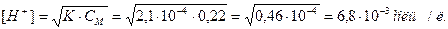
рН=-lg 6,8∙10-3 = -lg 6,8 – lg 10-3 = 3 – 0,83 = 2,17.
Мысал 6. Концентрациясы 0,2н бір негізді әлсіз қышқылдың диссоциациялану дәрежесі 3% тең. Ерітіндідегі сутек иондары мен гидроксид-иондарының концентрациясын және рН есептеңіз.
Шығарылуы. Бірнегізді қышқылдың диссоциациялану теңдеуі:
 НА Н+ + А-
НА Н+ + А-
Қышқыл бірнегізді болғандықтан СМ=СН, олай болса [HA] = 0,2 н = 0,2 M.
[H+] = C∙α = 0,2 M ∙0,03 = 0,006 M = 6∙10-3 моль/л
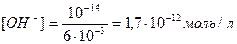
рН=-lg (6∙10-3) = 3 – lg 6 = 2,22.
Мысал 7. Сұйытылған 0,0365%-дық HCl ерітіндісінің тығыздығы мен f(H+) бірге тең деп алып, осы ерітіндінің рН есептеңіз.
Шығарылуы. Көлемі 1 л ерітіндінің массасы (ρ=1г/мл) 1000 г, 1л ерітіндідегі HCl массасы 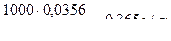 M(HCl) = 36,5 г/моль.
M(HCl) = 36,5 г/моль. 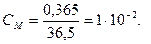 [H+]= 1∙10-2 моль/л, pH = 2.
[H+]= 1∙10-2 моль/л, pH = 2.
1. Сутек иондарының концентрациясын [H+] моль/л: 1) 10-7; 2) 2∙10-3; 3)5∙10-9 деп алып, ОН- иондарының концентрациясын есептеңіз. Жауабы: 1) 10-7; 2) 5∙10-12; 3) 2∙10-6.
2. Сутек иондарының концентрациясы [H+] моль/л: 1)3,2∙10-5; 2)6,5∙10-11; 3) 4,9∙10-12 болатын ерітіндінің рН есептеңіз.
3. Иондарға толық диссоциацияланады деп есептеп, берілген қышқыл ерітінділерінің рН анықтаңыз: 1) c(HCl) = 0,002; 2) c(HNO3) = 0,015; 3)c(H2SO4)=0,00025; 4) c(H2SO4)=0,0025 моль/л.
4. Иондарға толық диссоциацияланады деп есептеп, берілген сілті ерітінділерінің рН анықтаңыз: 1) c(КОH) = 0,01; 2) c(Са(ОH)2) = 0,0005; 3)c(Са(ОH)2) = 0,001 моль/л.
5. Концентрациясы 1%-дық КОН ерітіндісінің тығыздығын 1 г/см3 деп алып, осы ерітіндінің рН есептеңіз.
6. Аммиак гидратының NH3∙H2O 0,1 моль/л ерітіндісінің рН есептеңіз.
7. Сірке қышқылының 0,1 моль/л ерітіндісінің рН есептеңіз.
8. Аскорбин қышқылы (с-витамині) әлсіз бірнегізді органикалық қышқылға жатады. Диссоциациялану константасы 8∙10-5. Құрамында 0,1 моль/л С витамині бар ерітіндінің рН есептеңіз.
9. Адам қанының рН=6,35, ал асқазан сөлінің рН=1,5 тең. Қандағы және асқазан сөліндегі сутек иондарының концентрациясын есептеңіз.
10. Сірке қышқылының 0,1 М ерітіндісінің 1 литріне массасы 8,2 г натрий ацетатын қосқанда ерітіндінің рН-ы қалай өзгереді?
Ерігіштік көбейтіндісі.
Қайталау сұрақтары.
1. Ерігіштік көбейтіндісі дегеніміз не?
2. Мына заттар үшін: Ag2SO4, PbCl2, CaSO4, As2S3 ерігіштік көбейтіндісінің өрнегін жазыңыз.
3. NiCO3 және Cu(JO3)2 тұздарының ерігіштік көбейтіндісі бірдей және ол 1,4∙10-7 тең. Қайсы тұз тезірек ериді?
4. Қай жағдайда тұз ерітіндісі қанықпаған: 1) [A+]·[B-] > EK(AB); 2) [A+]·[B-] = EK(AB); 3) [A+]·[B-] < EK(AB)? Қай жағдайда тұнба пайда болады?
Есептер мен жаттығулар.
Мысал 1. Күміс хлориді AgCl мен күміс карбонаты Ag2CО3 ерігіштік көбейтінділері 1,6∙10-10 және 6,2∙10-12 сәйкес (250С). Қай тұздың ерігіштігі жоғары?
Шығарылуы. Қаныққан сулы ерітінділердің иондардың молярлық концентрацияларын анықтаймыз.
AgCl = Ag+ + Cl-
с1 с1
Егер с1 моль AgCl ерітіндіге көшсе, [Ag+]=[Cl-]=c1; EK(AgCl)=[Ag+][Cl-]=c12:
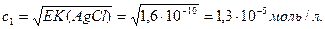
Екінші тұз үшін:
Ag2CО3 = 2Ag+ + Cl32-
2с2 с2
Егер с2 Ag2CО3 ерісе, [Ag+]=2c2; [CO32-]=c2; EK(Ag2CО3) = [Ag+]2 ∙ [CO32-] = (2c2)2∙c2 = 4c23; 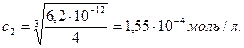
c1 мен с2 салыстырсақ күміс карбонатының ерігіштігі 10 есе жоғары екендігін байқаймыз. Бірақ EK(AgCl) > EK(Ag2CО3) болғандықтан, AgCl ерігіштігі жоғары болу керек еді. Есептеулерден ойға түйгеніміз: заттардың ерігіштігін салыстырғанда, ерітіндідегі иондардың жалпы саны бірдей ЕК бойынша болуы керек. Мысалы: EK(AgCl)=1,6∙10-10; EK(AgI)=1,0∙10-16; c(AgCl)>c(AgI); EK(Ag2CO3)=6,2∙10-12; EK(Ag2CrO4)=2,0∙10-12; c(Ag2CO3)>c(Ag2CrO4).
Мысал 2. Барий фосфатының Ва3(РО4)2 қаныққан ерітіндісінің ерігіштігін моль/л және г/л, иондардың молярлық концентрациясын есептеңіз.
Шығарылуы.
 Ва3(РО4)2 3Ва2+ + 2РО43-
Ва3(РО4)2 3Ва2+ + 2РО43-
EK = [Ва2+]3 [РO43-]2
Егер с моль/л Ва3(РО4)2 еріді деп есептесек, [Ва2+] = 3с; [РO43-]=2с;
ЕК = (3с)3∙(2с)2 = 108 с5 = 6,3∙10-39. ЕК(Ва3(РО4)2) = 6,3∙10-39. Кестеден табамыз.
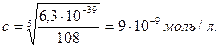
М(Ва3(РО4)2) =602 г/моль; олай болса, с = 602∙9∙10-9 = 5,42∙10-6 г/л.
Барий ионының концентрациясы 9∙10-9∙3=2,7∙10-8 моль/л, ал РО43- ионының концентрациясы 9∙10-9∙2=1,8∙10-8 моль/л.
Мысал 3. Кальций оксалатының СаС2О4 судағы ерігіштігін есептейміз. Егер с моль/л СаС2О4 еріді десек,
EK(СаС2О4) = [Са2+][C2O42-] = с2. EK(СаС2C4) = 2∙10-9 кестеден қараймыз.
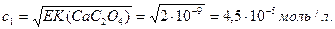
Енді кальций оксалатының 0,1 М NH4C2O4 ерітіндісіндегі ерігіштігін табамыз; оны с1 деп белгілейік.
Са2+ иондарының концентрациясын с1 деп, ал С2О42- - иондарының концентрациясы (0,1+с1) деп белгілейміз. Аз еритін затта с1<<0,1 болғандықтан, с1 есепке алынбайды, олай болса [C2O42-]=0,1 моль/л.
EK(СаС2C4) = 2∙10-9 = c1∙0,1; мұндағы 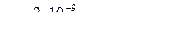
Сонымен кальций оксалатының аммоний оксалаты қатысындағы ерігіштігі оның судағы ерігіштігінен 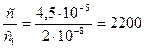 есе аз.
есе аз.
Мысал 4. Концентрациясы 2∙10-3 моль/л болатын күміс нитратының (AgNO3) 20 мл ерітіндісі және концентрациясы 1∙10-4 моль/л болатын калий хроматының 30 мл ерітіндісі араластырылды. Тұнба шөге ме?
Шығарылуы.
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
EK(Ag2CrO4) = 1,1∙10-12. Ерітіндісінің көлемі 20+30=50мл.
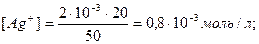
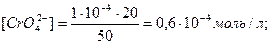
Онда [Ag+]2∙[CrO42-] = (0,8∙10-3)2∙(0,6∙10-4) = 0,38∙10-10, яғни [Ag+]2∙[CrO42-] >EK(Ag2CrO4), онда күміс хроматы тұнбаға түседі.
1. Кальций карбонатының (СаСО3) судағы ерігіштігін (моль/л) есептеңіз.
2. Мышьяк сульфидінің (As2S3) қаныққан сулы ерітіндісіндегі сутек иондарының молярлық концентрациясын есептеңіз.
3. Концентрациясы 0,02 моль/л СаCl2 ерітіндісіне бірдей көлемдегі 0,2 М H2SO4 ерітіндісін қосқанда СаSO4 тұнбасы түзіледі ме?
4. Қорғасын бромидінің (РbBr2) қаныққан ерітіндідегі молярлық концентрациясы 1,3∙10-2 моль/л (250С). Осы температурадағы тұздың ерігіштік көбейтіндісін табыңыз.
5. Массасы 5,8 PbI2 еріу үшін 10 л су жұмсалады. Осы тұздың ерігіштік көбейтіндісін табыңыз.
6. Құрамында 0,01 моль/л NaSO4 бар қаныққан ерітіндідегі барий сульфатының молярлық концентрациясын (моль/л), және тек қана ВаSO4 бар қаныққан сулы ерітіндідегі барий сульфатының молярлық концентрациясын салыстырыңыз. Неліктен тұзды ерітіндідегі ВаSO4 ерігіштігі төмендейтінін түсіндіріңіз.
7. Құрамында 0,01 моль/л NaCl бар ерітіндідегі және 0,01 моль/л СаCl2 бар ерітіндідегі AgCl молярлық концентрациясын есептеңіз. Қайсы ерітіндідегі күміс хлоридінің (AgCl) ерігіштігі жоғары? Есептеулерге жүгінбей-ақ, жауабыңызды негіздей аласыз ба?
8. рН=11 және рН=12 болған жағдайлардағы ерітіндідегі Ғе2+ иондарының концентрацияларын анықтап салыстырыңыз.
9. Күміс хлоридінің қаныққан ерітіндісіндегі Ag+ ионы бактерицидтік қасиет (с(Ag+)=10-9 г/л) көрсете алатын – алмайтындығын есептеңіз.
10. Магний иондарының концентрациясы 2∙10-3 моль/л болатын Mg(OH)2 ерітіндісінің рН салыстырыңыз.
Дата: 2019-05-29, просмотров: 1704.