1. электрон бұлтының формасы
2. электрон энергиясы
3. атомдағы электронның энергетикалық деңгейі
4. Бор теориясы бойынша электрон қозғалатын орбитаның радиусы
5. электронның жылдамдығы
39. Атомның ядролық моделі қай тәжірибелер негізінде анықталады?
1. a-бөлшектермен Резерфорд тәжірибелері
2. Крукс тәжірибелері
3. зарядтарды анықтау тәжірибелері
4. Вильсон камерасында a-бөлшектермен тәжірибелері
5. радиоактивтілік туралы жасалған тәжірибелер
40. Ядро заряды 24294Pu элементінен 2 a және 1 b - бөлшектердің ұшып шығуынан қандай элемент пайда болады?
1. 23990Th
2. 23491Pa
3. 24395Am
4. 24796Cm
5. Pb
41. Бірінші қосымша топшадағы қандай элементтер кіреді?
1. d-орбиталь электрондармен толтырыла бастаған элементтер
2. s және d электрондары әрекеттесе бастайтын элементтер
3. s- орбиталы толтырыла бастаған элементтер
4. f-орбиталы толтырыла бастаған элементтер
5. p- орбиталы толтырыла бастаған элементтер
42. Се-ден Lu-ге дейін лантаноидтардың атомдық және иондық радиустары қалай өзгееді?
1. кішірейеді (аномалия европий мен иттербийде), лантоидтық сығылу байқалады
2. периодты өзгереді
3. периодсыз өзгереді
4. өседі
5. тұрақты болып қалады
43. Егер l =2 болса, m1 мәндері қандай болады, белгілеңіз:
1. l =2, m=0
2. m 0-ден l-ге дейін мәнді қабылдайды
3. m 0-ден -l –ге дейін мәнді қабылдайды
4. m +2, +1,0, -1, -2 мәндерді қабылдайды
5. m l +1-ден l -1-ге дейін мәнді қабылдайды.
44. Мына электрондық R-3s23p63d10 4s24p64d104f7 5s25p66s2 конфигурация қай элементке сәйкес келеді?
1. Sm 2. Eu 3. Gd 4. Am 5. U
45. « ms » магнит квант саны нені сипаттайды?
1. электрон орбитальдарының кеңістікте орналасуын
2. орбиталь квант санының проекциясының ішкі магнит өрісіне бағытын
3. электрон энергиясының жалпы санын
4. магнит өрісінде электрондық орбитальдың рұқсат етілген бұрышының бұзылуы
5. y2 шамасын сипаттайды
46. Бор теориясына сәйкес сутек атомына электронның қозғалу жылдамдығы қай теңдеумен сипатталады?
1. 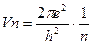
2. 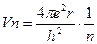
3. 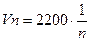 км/сек
км/сек
4. 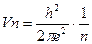
5. 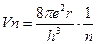
47. Элементтердің химиялық қасиеттеріне қай орбиталь шешуші роль атқарады?
1. негізінен сыртқы электрондық орбитальдар
2. d-орбитальдар
3. f-орбитальдар
4. элементтердің радиусы және заряд мөлшері
5. элементтердің химиялық қасиеттері атом құрылысына байланысты емес
48. Электрон тартқыштық элементтің қандай қасиетін сан жағынан сипаттайды?
1. элементтің электронға қосылу қабілеттілігі
2. элементтің тотықтырғыш қасиеті
3. электрон тартқыштық элементтің электронға қосылу қабілеттілігінің сандық сипаттамасы
4. ядро зарядының шамасы
5. иондану потенциалы
49. Резерфордтың ядролық моделінің кемшілігі неде?
1. электродинамикалық заңдарға қарама-қарсы және спектрдің сызықтылығын түсіндірмейді
2. атомдардың тұрақтылығын түсіндіруге болмайды
3. көп ядролы атомдарға электрондардың бөлінуін түсіндірмейді
4. атомның планетааралық құрылысын түсіндірмейді
5. электрондардың энергиясын түсіндірмейді
50. Периодтық системада топ элементтерінің радиустары қалай өзгереді?
1. топтарда атомдардың радиустары жоғарыдан төмен қарай өседі
2. топтарда атомдардың радиустары азаяды
3. негізгі топ элементтер атомдарының радиусы, қосымша топ элементтері атомдарына қарағанда секірмелі түрде өзгереді
4. элементтердің радиусы өзгермейді
5. элементтердің радиустары топ бойынша секірмелі өседі.
5. Химиялық байланыс
1. ВБТ бойынша химиялық байланыстың өлшемі не?
1. жалқы электрондар саны
2. бір атомдағы электрондар саны
3. бір атомдағы жұптасқан орбитальдар саны
4. екі атомдар арасындағы жалпыланған қос электрондар саны
5. атомдық байланыстардың жалпы саны
2. s және p байланыстарының айырмашылығын көрсетіңіз:
1. s-байланыс атомдық орбитальдардың орталық ядроларының ортасы арқылы бүркесу бойынша түзіледі, ал p байланыс ядроларының ортасы арқылы бүркіспейді
2. s-байланыс жұптаспаған электрондардың бүркесуі бойынша түзіледі, p-байланыс жұптаспаған электрондар бойынша емес
3. s-байланыстың p-байланыстан өзгешелігі, s-байланыс делокализацияланған
4. s-байланыс донорлық және акцепторлық атомдық орбиталдардың бүркесуі нәтижесінде түзілген
5. s-байланыстың p байланыстан өзгешелігі, s байланыс болмайды.
3. Қос электронды донордың акцептордан айырмашылығы не?
1. донордың бос орбиталі болады
2. акцепторда байланысқа қатыспайтын электрон жұбы болады
3. донорда байланысқа қатыспайтын электрон жұбы болады
4. донорда акцептордың бос орбиталімен әрекеттесе алатын байланыстырушы электрон жұбы болады
5. белгілі молекулалардың бірде-бірі донор ролін атқармайды, тек иондар ғана донор бола алады.
4. H2O молекуласының гибридтену типін көрсетіңіз:
1. sp 2. sp2 3. sp3 4. d2s 5. p3
5. NH3 молекуласының гибридтену типін көрсетіңіз:
1. sp3 2. sp 3. sp2 4. dsp 2 5. d2 sp3
6. HgCI2 молекуласының гибридтену типін көрсетіңіз:
1. sp3 2. sp2 3. sp 4. d3s 5. dsp2
7. Қай молекулада иондық байланыс көрсетілген?
1. NH3
2. Br2
3. N2
4. BaCI2
5. O2
8. KBr, CaCI2, Br2, Cu, SnCI2 қосылыстарының қасиеттерін салыстырмалы түрде қарастырып және қосылысқа коваленттік байланыс тән екендігін көрсетіңіз:
1. Br2
2. KBr
3. CaCI2
4. Cu
5. SnCI2
9 . Қос байланыстың анықтамасын көрсетіңіз:
1. коваленттік байланыс-екі ортасы болатын байланыс
2. екі байланыстырмайтын электрон жұптарынан түзілетін байланыс
3. бір байланыстыратын және екі байланыстырмайтын электрон жұптарынан түзілетін байланыс
4. ковалентті байланыс-екі электрон жұптары қатысатын байланыс
5. екі байланыстыратын жалқы электрондар қатысатын байланыс
10. Валенттілік ұғымының анықтамасын көрсетіңіз:
1.валенттілік-атомның басқа атомдармен қосылу қабілеттілігі
2.валенттілік-белгілі электрон сандарын басқа атомдарға беру қабілеттілігі
3.валенттілік-басқа атомның белгілі электрон сандарын қосып алу қабілеттілігі
4.валенттілік-химиялық байланыс өлшемі
5.валенттілік-тотығу дәрежесінің өлшемі
11.Ковалентті байланыстың негізгі түйіні неде?
1. жалқы электрондардың өзара тебісуі бойынша түзілетін байланыс
2. атомдық орбитальдардың бүркесуі нәтижесінде жекеленген атомдардың екі жалқы электрондарының жұптасуы арқылы алынған байланыс
3. донордың және акцептордың атомдық орбитальдарының бүркесуі арқылы түзілетін байланыс
4. әр аттас зарядтардың электростатикалық тартылысы бойынша түзілетін байланыс
5. гравитациялық күштер әсерінен түзілетін байланыс
12. Ковалентті байланыстың қасиетін анықтайтын негізгі параметрлерді көрсетіңіз:
1. байланыстыратын электрон жұбының тебілу қабілеті
2. байланыстырмайтын электрон жұбын тарту қабілеті
3. бағыттылығы, қанымдылығы, поляризациялануы
4. беріктігінің жоғарылығы
5. s-және p-байланыстардың болуы
13. s - байланыстың түзілу себебі:
1. байланыстың орталығы бойынша атомдық орбитальдардың бүркесуінен алынған байланыс
2. екі s- электрондармен түзелетін байланыс
3.p- электрондармен түзілетін байланыс
4. s- электрондар жұбымен және бір бос орбитальмен түзілетін байланыс
5. екі d- электрондармен түзілетін байланыс
14. ВеCl2 (валенттік бұрышы 1800) молекуласындағы орталық атомның орбитальдарының гибридтенуін көрсетіңіз:
1. sp3 2. sp 3. sp2 4. dsp 2 5. d2 sp2
15. BF3 (1200) молекуласындағы орталық атомның орбитальдарының гибридтенуін көрсетіңіз:
1. d3s 2. sp3 3. sp2 4. sp 5. dsp3
16. SiH4 (валенттік бұрышы 1090) молекуласындағы орталық атомның орбитальдарының гибридтенуін көрсетіңіз:
1. sp 2. d2sp 3. sp2 4. dsp3 5. sp3
17. Атомдық орбитальдардың гибридтенуі дегеніміз не?
1. байланыстырмайтын электрон жұбының әсері бойынша атомдық орбитальдардың деформациялануы
2. электр терістігі жоғары атомға қарай атомдық орбитальдардың ығысуы
3. әртүрлі атомдық орбитальдары (s, p, d, f) бар атомда, басқа атоммен химиялық байланыс түзуі үшін тиімді, жаңа, аралас орбитальдардың (мысалы, sp, pd) пайда болуы
4. екі атомдық орбитальдардан бір молекулалық орбитальдың түзілуі
5. атомдық орбитальдардың бүркесуі
18. Донорлы - акцепторлы байланыс туралы түсініктің дұрыс тұжырымдамасын көрсетіңіз:
1. байланыстыратын электрондардың екі жұбымен түзілетін байланыс
2. бір байланыстыратын және бір байланыстырмайтын электрон жұптарымен түзілетін байланыс
3. әр аттас атомдардың электростатикалық тартылысы есебінен түзілетін байланыс
4. сутектік байланыс түрі бойынша түзілетін байланыс
5. бір атомның байланыстырмайтын электрон жұбымен екінші атомның бос орбиталімен бүркесуі арқылы түзілетін байланыс.
19. 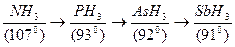 қатарындағы валенттік бұрыштың кемуін түсіндіріңіз:
қатарындағы валенттік бұрыштың кемуін түсіндіріңіз:
1. N-Sb қатарында металдық қасиет артады
2. көрсетілген қатарда атомдардың электр терістігі артады
3. көрсетілген қатарда атомдардың электр терістігі артады
4. берілген қатар бойынша азоттан сурьмаға қарай атомдардың электртерістігі кемиді, соның салдарынан байланыспаған электрондық жұптардың тебісу әрекеті тебісу әрекеті валенттік бұрышты әжептәуір кішіррейтеді
5. көрсетілген қатардағы барлық молекулалар 3p- атомдық орбитальдардың бүркесуі бойынша түзілген, валенттік бұрыштың кемуі топ бойынша жоғарыдан төмен өарай атомдардың электр терістігінің төмендеуімен түсіндіріледі
20. Валенттік байланыс теориясының дұрыс анықтамасын көрсетіңіз:
1. ВБТ бойынша химиялық байланыс жеке атомдардың электростатикалық тартылыс әсерінен түзілетінін түсіндіреді
2. ВБТ бойынша химиялық байланыс донор және акцептор атомдардың тартылысы әсерінен түзіледі
3. ВБТ бойынша химиялық байланыстың табиғаты гравитациялық болып табылады, атом массасы неғұрлым көп болса, соғұрлым байланыс берік болады
4. ВБТ бойынша химиялық байланыс жеке атомдардың жалқы электрондарының бірігуі есебінен түзіледі
5. ВБТ бойынша химиялық байланыс полярлы және полярлы емес молекулалардың тартылуы бойынша түзіледі
21. ВБТ кемшіліктерін көрсетіңіз:
1. молекулалардың геометриясын көрсетпейді
2. H2 молекуласының түзілуін өте дәл түсіндірмейді
3. гибридтену теориясына сәйкес келмейді
4. ВБТ -нан валенттік туралы түсінік шықпайды
5. ВБТ Ве2 молекуласының тұрақсыздығын, O2 парамагниттілігін, тақ санды электроны бар молекулалардың (H2+, NO) бар екенін, молекулалардың полюстігін, металдардағы химиялық байланысты түсіндірмейді.
22. МОТ - ң ВБТ - нан негізгі айырмашылығын көрсетіңіз:
1. МОТ ортақ электрон жұбын түзу жағдайынан шығады
2. айырмашылығы жоқ
3. МОТ бойынша химиялық байланыстың екі орталығы бар
4. МОТ бойынша химиялық байланыс екі ядроның ортасында локализацияланған
5. ВБТ бойынша электрондар екі ядро өрісінде қозғалады (байланысқан екі орталығы бар, байланыс локализацияланған), МОТ бойынша химиялық байланыс түзуге атомның барлық электрондары қатысады, байланыс делокализацияланған.
23 . Молекулалық орбитальдарды электрондармен толтыру принциптерін көрсетіңіз:
1. n AO – n МО, min энергия, Паули принципі және Хунд ережесі шығады
2. n АО– дан n /2 МО түзіледі
3. жоғары энергиялы атомдық орбитальдар толтырылады
4. МО толтыру кезінде Клечковский ережесі қолданылады
5. МО толтыру кезінде төменгі энергиядан басқа ешқандай ереже қолданылмайды
24. Қандай молекулалық орбитальдар болады?
1. тек қана байланыстырушы орбитальдар
2. тек қана босаң орбитальдар
3. жұптаушы орбитальдар
4. қозған орбитальдар
5. байланыстыратын және босаң орбитальдар
25. МО теориясы бойынша магниттік қасиет қалай түсіндіріледі?
1. молекулада жалқы электрондардың болуымен
2. молекулада жұптасқан электрондардың болуымен
3. МО түзілу кезінде атомдардың ядролары арасындағы электрон тығыздығының артуымен
4. МО түзілу кезінде атомдардың ядролары арасындағы электрон тығыздығының кемуімен
5. байланыстың полярлығы күшейуімен
26. Мына қатарда NaF, MgF2, AIF3, SiF4, PF5, SF6, F2 химиялық байланыстың қалай өзгеретінін көрсетіңіз:
1. коваленттік ® иондық ®полярлық
2. иондық®ионды–коваленттік®коваленттік
3. иондық®полярлық®коваленттік®полярлы–коваленттік
4.коваленттік
5. иондық–полярлық
27 . H2O ® H2S ® H2Se ® H2Te қатарында байланыстың полярлығы қалай өзгереді?
1. кемиді
2. жоғарлайды
3. өзгермейді
4. H2Se дейін кішкене өсіп, сосын кемиді
5. H2Se дейін кішкене кеміп, сосын жоғарылайды.
28. Сутектік байланыс ұғымына анықтама беріңіз:
1. оттек, азот немесе фтор атомдарымен байланысып тұрған сутек атомдары бар молекулалар арасындағы тартылыс күшімен анықталатын молекулааралық байланыс
2. полюсті молекулалардың әрекеттесуі бойынша болатын байланыс
3. полюсті және полюссіз молекулалардың әрекеттесуімен болған байланыс
4. дисперсті күштер арқылы болатын байланыс
5. ориентациялық күштер арқылы болатын байланыс
29. Мына заттардың BaCI2, H2, HF қайнау температурасының төмендеуіне байланысты орналасуын көрсетіңіз:
1. H2>HF>BaCI2
2. HF=BaCI2>H2
3. HF= BaCI2>H2
4. BaCI2>HF>H2
5. H2> BaCI2>HF
30. Байланыстырғыш молекулалардың орбитальдарының босаң молекулалық орбитальдарының айырмашылығын көрсетіңіз:
1. АО бүр кесуі бойынша
2. байланыс энергиясы бойынша
3. гибридтену типіне байланысты
4. электрондардың жұп саны бойынша
5. байланыс үзындығы мен тығыздығы бойынша
31. N2 молекуласындағы p -байланыстың санын көрсетіңіз:
1. бір 2. үш 3. екі 4. бес 5. төрт
32. sp- гибридтену түзілген кездегі валенттік бұрышты көрсетіңіз:
1. 900 2. 1200 3. 1090 4. 1800 5. 1050
33 . Диполь моменті үлкен молекуланы көрсетіңіз:
1. CS2 2. NH3 3. F2 4. H2O 5. CO
34. O2 молекуласындағы байланыс ретін көрсетіңіз:
1. -1 2. -3 3. -2 4. -0 5. 4
35. Парамагнетизм ұғымына анықтама беріңіз:
1. заттың бір немесе бірнеше жұптаспаған электрондары болуына байланысты
магнит өрісіне тартылу қасиеті
2. заттың магнит өрісінен тебісу қасиеті
3. заттың байланыстырмайтын екі электрон жұбы болатын қасиеті
4. заттың магниттік күшінің өзгеруіне әсер ететін қасиеті
5. заттың жарық энергиясына әсер ететін қасиеті
6-7. Кинетика және термодинамика
1. Гетерогенді катализатор ұғымының анықтамасын көрсетіңіз:
1. реагенттермен бірдей фазалық күйде болатын катализатор
2. газ күйінде болатын катализатор
3. қатты күйде болатын катализатор
4. реагенттерден өзге фазалық күйде болатын катализатор
5. сұйық күйде болатын катализатор
2. Гомогенді катализатор ұғымының анықтамасын көрсетіңіз:
1. газ күйінде болатын катализатор
2. сұйық күйде болатын катализатор
3. реагенттермен бірдей фазалық күйде болатын катализатор
4. реагенттерден өзге фазалық күйде болатын катализатор
5. гомогенді еритін сұйықтардан тұратын катализатор
Катализатор дегеніміз не?
1. тек химиялық реакцияның жылдамдығын арттыратын зат
2. тек химиялық реакцияның жылдамдығын баяулататын зат
3. әрекеттесуші заттардың ерігіштігін арттыратын зат
4. химиялық реакция жылдамдығын тездетіп, бірақ өзі реакция барысында химиялық әрекеттесуге қатыспайтын зат
5. әрекеттесуші заттардың ыдырауына ықпал ететін зат.
4. 1 моль судың [ Н2Осұй ® Н2Огаз ] булану процесінде жүйенің D S таңбасын анықтаңыз:
1. оң таңбалы +D S
2. теріс таңбалы -D S
3. D S=0
4. қысымға байланысты D S оң немесе теріс таңбалы белгіні көрсетеді
5. D S оң немесе теріс таңбалы судың бастапқы темпеатурасына байланысты
5. Төменде көрсетілген реакциялардың қайсысы қайтымсыз реакция екенін анықтаңыз:
1. H2+CI2=2HCI
2. 2KClO3=2KCl+3O2
3. 2H2+O2=2H2O
4. N2+3H2=2NH3
5. NaOH+HCI=NaCl+H2O
6. «Термодинамика» ұғымының дұрыс тұжырымын анықтаңыз:
1. әрекеттесуші массалардың концентрациясының өзгеруі
2. химиялық байланыстар туралы ғылым
3. энергияның бір түрінен екінші түріне айналуы туралы ғылым
4. реакциялардың жылу эффектісі туралы ғылым
5. жай заттардың күрделі заттарға айналуы туралы ғылым.
7. D G, D H және D S-пен байланыстыратын дұрыс теңдеуді көрсетіңіз:
1. D G = D H+D S
2. D G = D H-D S
3. D G = D H
4. D G = D H - ТD S
5. D G = D HТ- D S
8. Мұздың еруі кезіндегі D H, D S таңбаларын алдын-ала айтыңыз:
1. -D H, +D S
2. +D H, +D S
3. -D H, -D S
4. +D H, -D S
5. D H=0; D S=0
9. Келесі жағдайлардың қайсысында энтропия жоғарылайды?
1. зат сұйық күйден кристалға айналғанда
2. газ жағдайдан сұйыққа айналғанда
3. зат кристалдық жағдайдан сұйыққа немесе газға айналғанда
4. бөлшектер санын азайтуға әкелетін химиялық реакциялардың негізінде
5. газдың кристалға айналған кезінде
10. «Химиялық реакция жылдамдығы» ұғымына анықтама беріңіз:
1. бірлік уақыт ішінде әрекеттесуші заттардың концентрациясының өзгерісі
2. әректтесуші заттардың концентрациясы арасындағы тәуелділік
3. әрекеттесуші заттардың біреуінің концентрациясының уақыт бойынша өзгерісін анықтайтын тәуелділік
4. реакцияға қатынасатын заттардың табиғатына байланысты реакция механизмін анықтайтын константа
5. ерігіштік пен температура арасындағы тәуелділікті анықтайтын константа
11. «Жылдамдық константасы» ұғымына анықтама беріңіз:
1. реакция жылдамдығының өзгерісін температурасы бойынша анықтайтын тәуелділік
2. v=K[A][B], [A]=[B]=1 болғанда v=K жылдамдық теңдеуіндегі реагенттер концентрациясы мен реакция жылдамдығы арасындағы пропорционалдық коэффициент
3. қайтымды реакциялардағы химиялық реакцияның жылдамдықтары арасындағы тәуелділік
4. жылдамдықтың температураға тәуелділігін сипаттайтын константа
5. концентрация мен диссоциациялану дәрежесі арасындағы тәуелділік
12. Химиялық реакцияның жылдамдығына әсер етуші факторлар:
1. уақыт
2. концентрация, температура және катализатор
3. химиялық реакцияның жылдамдығына сыртқы факторлар әсер етпейді.
4. ерітінді үстіндегі будың қысымы
5 ерітіндінің осмос қысымы
13. А+В ® Д (А компоненті бойынша) теңдеудегі реакцияның ретін анықтаңыз:
1. бірінші ретті
2. екінші ретті
3. нөлінші ретті
4. мұндай реакциялардың реті болмайды
5. үшінші ретті.
14. Аррениус теңдеуінің дұрыс жазылуын көрсетіңіз:
1. 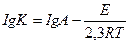
2. 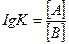
3. 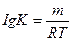
4. 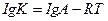
5. 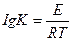
15. Массалар әрекеттесу заңының (Гульдбергтің, Ваагтың) дұрыс тұжырымдамасын көрсетіңіз:
1. химиялық реакцияның жылдамдығы реагенттердің концентрациясына және алынған заттардың қатынасына тең
2. химиялық реакцияның жылдамдығы реакцияласатын заттардың концентрациясының көбейтіндісіне пропорционал
3. химиялық реакцияның жылдамдығы реакцияласатын заттардың концентрациясына пропорционал
4. химиялық реакцияның жылдамдығы реакцияласатын заттардың концентрациясына тәуелді емес
5. химиялық реакцияның жылдамдығы қысым мен температураның көбейтіндісіне тура пропорционал
16. «Химиялық тепе-теңдік» ұғымының дұрыс анықтамасын көрсетіңіз:
1. кері реакцияның жылдамдығы, тура реакцияның жылдамдығына аз болатын химиялық жүйенің күйі
2. тура реакцияның жылдамдығы, кері реакцияның жылдамдығынан аз болатын химиялық жүйенің күйі
3. кері реакцияның жылдамдығы нөлге тең болатын химиялық жүйенің күйі
4. тура реакцияның жылдамдығы нөлге тең болатын химиялық жүйенің күйі
5. өнімдердің түзілу жылдамдығы, өнімдерден реагенттердің пайда болу жылдамдығына тең болатын химиялық жүйенің күйі
17. Химиялық тепе-теңдік жүйесіндегі Ле-Шателье принципімен анықталатын ығысуды көрсетіңіз:
1. химиялық тепе-теңдік күйіне келіп тұрған жүйеге сырттан әсер етсе, реакция жылдамдығы ұлғайады
2. химиялық тепе-теңдік күйіне келіп тұрған жүйеге сырттан әсер еткенде, реагенттер мен өнімдердің салыстырмалы концентрациясы өзгереді, яғни тепе-теңдікті сол өзгертуге қарсы әрекет туғызатын реакция бағытына қарай ығыстырады.
3. тепе-теңдіктегі жүйеге сырттан әсер еткенде, тура және кері реакцияның жылдамдығы төмендейді.
4. тепе-теңдіктегі жүйеге сырттан әсер еткенде, тура және кері реакцияның жылдамдығы ұлғаяды.
5. заттың концентрациясының температураға тәуелділігі.
18. Жүйенің D Н энтальпиясының өзгеруі қандай өлшемді анықтайды?
1. реакция жүргендегі сіңірген энергияның өлшемі
2. реакция нәтижесінде бөлінген энергияның өлшемі
3. реакция нәтижесінде бөлінген және сіңірген энергияның өлшемі
4. реакция нәтижесінде өзгерген потенциалды энергияның өлшемі
5. реакция нәтижесінде өзгерген кинетикалық энергияның өлшемі
19. Энтропия ұғымының дұрыс анықтамасын көрсетіңіз:
1. жекеленген жүйенің бір жағдайдан екінші жағдайға ауысқандағы ретсіздіктің немесе хаостың өлшемі
2. еркін энергия өзгерісінің шамасы
3. кинетикалық энергия өзгерісінің шамасы
4. Гиббс энергиясы (DG) өзгерісінің шамасы
5. потенциалдық энергия өзгерісінің шамасы.
20. Термодинамиканың 2-ші заңының негізгі қағидасын көрсетіңіз:
1. DS<D
2. DS=0
3. DS жүйе > DS әлемдік
4. DS әлемдік= DS жүйе+DS қоршаған орта >0
5. DH=DS
21. 4Fe+3O2=Fe2O3 осындай жүйедегі процесс хаосты жағдайды жоғарылата ма?
1. хаосты жағдай жоғарлайды
2. хаосты жағдай төмендейді
3. қыздырғанда хаосты жағдай төмендейді
4. қыздырғанда хаосты жағдай жоғарлайды
5. хаосты жағдайдың өлшемі реакцияға қатынасатын заттардың концентрациясына тәуелді
22. Гесс заңының дұрыс тұжырымдамасын көрсетіңіз:
1. реакцияның жылу эффектісі процестің жүру жолына тәкелді емес, тек жүйенің бастапқы және соңғы күйіне тәуелді.
2. реакцияның жылу эффектісі реакцияның жүру жолына тәуелді
3. реакцияның жылу эффектісі жүйенің бастапқы күйіне тәуелді
4. реакцияның жылу эффектісі жүйенің соңғы күйіне тәуелді
5.реакцияның жылу эффектісі реакцияға қатынасатын заттардың концентрацияна тәуелді
23. Бір мезгілде жүретін реакциялардың жүру жағдайын көрсетіңіз:
1. CaCO3+2HCI® CaO+O2
 CaCI2+CO2+H2O
CaCI2+CO2+H2O
 2. H2+F2®2HF
2. H2+F2®2HF
(HF)n
 3. CO2+CI2® COCI2
3. CO2+CI2® COCI2
C+CI2O
4. 4KCIO3® 4KCI+6O2
 3KCIO3+KCI
3KCIO3+KCI
5. P+O2® P2O5
 P2O3
P2O3
24. Қандай реакциялар бірінен кейін бірі жүретін реакциялар деп аталады?
1. алдыңғы реакциялардың өнімдері, келесі реакцияларға қолданылатын реакциялар
2. реакция өнімдерін реакция сферасынан шығарып жүретін реакциялар
3. газ тәрізді заттарды бөліп алып жүретін реакциялар
4. реагенттері бірнеше заттарға ыдырайтын реакциялар
5. барлық ион алмасу реакциялары бірінен кейін бірі жүретін реакцияларға жатады
25. Гибсс энергиясы қандай өрнекпен өрнектеледі?
1. DН 2. DS 3. -ТDS 4. DG 5. DF
26. 2Рқ+5/2О2(г)=Р2О(г) реакциясында энтропия қалай өзгереді?
1. DS-өзгермейді
2. DS=const
3. DS-ұлғаяды
4. DS-төмендейді
5. DS>DH×T
27. N2(r)+O2(r)=2NO(r) реакциясы, егер жабық ыдыста жүргізілсе, онда қандай процеске жатқызуға болады?
1. изохоралық
2. изотермиялық
3. изобаралық
4. изохоро-изотермиялық
5. изобара-изотермиялық
28. Қоршаған ортаға жылу шығара жүретін заттың жану реакциясының термохимиясын атап өту керек:
1. эндотермиялық
2. экзотермиялық
3. изобаралық
4. изохоралық
5. изобара-изотермиялық
29. Егер С+О2=СО2 реакциясында оттегінің концентрациясын 5 есе ұлғайтса, реакцияның жылдамдығы неше есе ұлғаяды?
1. өзгермейді
2. 2,5 есе
3. 5 есе
4. 10 есе
5. 25 есе
30. Ғ2, СІ2, Вг2, І2 қатарындағы галогендер үшін стандартты энтропия шамасы қалай өзгереді?
1. өзгермейді
2. көбейеді
3. тұрақты болып қалады
4. азаяды
5. қысым жоғарылаған сайын секірмелі азаяды
31. Химиялық реакцияның бағытын анықтайтын функцияны көрсетіңіз:
1. энтальпия DН
2. энтропия DS
3. Гиббстің энергиясы DG
4. энтальпияның температураға көбейтіндісі DНТ
5. энтропияның температураға көбейтіндісі DSТ
32. Қатты зат-сұйық-газ қатарында қайтымды фазалық ауысуда энтропия қалай өзгереді?
1. өзгермейді
2. сұйыққа дейін ұлғайып, әрі қарай төмендейді
3. ұлғаяды
4. азаяды
5. секірмелі ұлғаяды
33. Изобара-изотермиялық процестің дұрыс өрнегін көрсетіңіз:
1. DG=DH+TDS
2. DG =TDS -DH
3. DG=DH-TDS
4. DG=DF-TDS
5. DG=DH ×DS
34. Химиялық тепе-теңдіктің ығысуына қандай факторлар әсер етеді?
1. энергия
2. қысым
3. уақыт
4. жүйе күйі (ашық немесе жабық түрі)
5. концентрация, температура және қысым
35. Мына реакцияның 3H2+N2 Û 2NH3+24 ккал тепе-теңдігін бұзатын үш факторды көрсетіңіз:
1. сыртқы жағдайдағы өзгеруі тепе-теңдікке әсер етпейді
2. DH, DS, DG
3. тығыздық, тұтқырлық, диэлектрлік тұрақтысы
4. концентрация, температура, қысым
5. концентрация, температура, ортаның рН
36. Молекуланың атомдарға және иондарға диссоциациялану реакциясы термодинамикалық реакцияның қай түріне жатады?
1. изобара-изотермиялық
2. эндотермиялық
3. экзотермиялық
4. гидратациялық
5. сольватациялық
37. «Активтендіру энергиясы» ұғымының дұрыс анықтамасын көрсетіңіз:
1. химиялық реакциядағы реагенттердің максималды энергия алуы
2. өнімдер түзу үшін химиялық реакция кезінде реагенттерге қажетті ең аз энергия
3. молекулалар арасындағы тартылыс күшін жеңуге керекті максималды энергия
4. молекуладағы диполь-дипольды әрекеттесетін молекулаларды бұзу үшін керекті минимальды энергия
5. молекулаларды гидратациялау үшін керекті максималды энергия.
38. Қандай термодинамикалық факторлар ерігіштікке қолайлы жағдай туғызады?
1. егер энтальпиялық фактор DH>0
2. егер энтальпиялық фактор DH=0
3. егер энтальпиялық фактор DS>0
4. егер көбейтіндісі DH×T>0
5. егер көбейтіндісі D S ×T<0
39. «Еру жылуы» ұғымының дұрыс ережесін көрсетіңіз:
1. еру кезіндегі заттың кристалдық торының бұзылу жылу эффектісі
2. еру кезіндегі DH×T көбейтіндісі
3. еру кезіндегі DS×T көбейтіндісі
4. еритін заттың белгілі санына сәйкес келетін ерудің жылу эффектісі
5. кристаллогидраттардың түзілу жылу эффектісі
40. Қандай жағдайда зат өздігінен ериді?
1. DH>0
2. DH<0
3. DH×T=const
4. DG=DH-TDS, DG<0
5. DG>0
Дата: 2019-05-29, просмотров: 893.