Ерігіштіктің сандық сипаттамасы ерігіштік коэффициенті (немесе жай ғана ерігіштік), ол берілген температурадағы еріткіште 100 г (немесе 1000 мл) затты ерітуге болатын максималды санын көрсетеді. Ерігіштік коэффициенті К-ға тең болатын ерітінді үшін еріген заттың массалық үлесі тең:
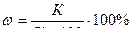
Мысал. Калий хлориді қаныққан ерітіндісінің ерімталдығы мен массалық үлесін (%) анықтаңдар, егер оның 20 мл көлеміндегі масса 20,94 г және ондағы тұз 3,25 г болса.
Шешуі. Еріген тұздың массасын (3,25 г) және ерітіндінің массасын (20,94 г) біле отырып еріткіштің массасын табамыз:
20,94- 3,25 = 17,69 г
Тұздың ерігіштік коэффициентін анықтаймыз:
17,69 г суда – 3,25 г тұз
100 г суда – Х г тұз
Х = 18,37 г
Қанық ерітіндідегі калий хлоридінің массалық үлесін формула бойынша анықтаймыз:
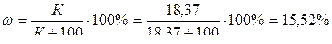
Ендеше, ω(КСІ) = 15,52 %; К(КСІ) = 18,37 г.
Тәжірибелік жолмен ерітінділер тоериясын негіздеп дәлелдегенге дейін ереже қалыптасқан болатын, оған орай әрбір зат өзіне ұқсаста ериді. Айталық, иондық (тұздар, сілтілер) немесе полярлық типтегі байланысы бар болатын заттар полярлы еріткіштерде жақсы ерімтал келеді. Метилді, этилді және пропилді спирттер суда кез келген қатынаста араласады. R-ОН молекуласындағы көмірсутекті радикалдың онан әрі ұзара түсуі салдарынан О-Н байланыстарының полярлылығы азаяды да спирттің судағы және судың судағымен салыстырғанда бір реттілікке жоғары, өйткені олардың (О2 және С6Н6) молекулалары полярлы емес.
Температура төмендеген кездегі ерітіндіден заттың бөлінуін кристалдану деп атайды. Егер ерітіндіде қоспалар болса, онда кристалдағанда зат әр кезде де таза алынады, өйткені ерітінді қоспаларға қатынасы бойынша тіпті температура төмендегенде де қанықпаған күйде қалады да қоспалар тұнбаға түспейді. Қайта кристалдану деп аталатын заттарды тазалаудың әдісі осыған негізделген.
Газдарды суда еріткенде жылу бөлінеді. Сондықтан да, Ле Шателье принципіне сәйкес, газ түріндегі заттардың ерімталдығы температураның жоғарылауымен төмендейді. Бұл еріткіш пен еріген газ молекулаларының арасындағы байланыстың берік еместігімен орайлас. Егер станкандағы салқын газды суды жылы бөлмеде қалдырса, онда біршама уақыт өткен соң стаканның ішкі қабырғасын майда көпіршіктер қаптайды. Бұл температураның жоғарылауымен сұйықтан бөлінетін газ молекулаларының еріткіш бетіне соққылану және онда еру жылдамдығының төмендеуімен түсіндіріледі.
Сұйықтағы газдардың ерімталдығын баян ететін келесі маңызды заңдылықтың бірі, ол Уильям Генри заңы: сұйықтағы газдардың ерімталдығы берілген газдың парциалдық қысымына пропорционалды. Бұл келесі тұжырымға сәйкес, қысым жоғарылаған сайын газдардың сұйықтағы ерігіштігі артады.
Әртүрлі газдардың сұйық ортадағы ерімталдығы, ең алдымен, оттектің, көміртек (ІV) оксидінің және азоттың адам организміндегі физиологиялық процестердің қалыпты өтуі үшін маңызы аса үлкен. Мысалы, қысымның өзгеруіне байланысты туындайтын газдардың қандағы ерімталдығының өзгеруі «кесонды» және «таулық» сияқты ауруға әкеледі. Мұндай аурулар терең су астындағы адамдар су бетіне тез көтерілгенде қысым өзгеріп (қандағы газ ерімталдығы да өзгереді), яғни газдың тез бөлінуі салдарынан пайда болады. Мұндай құбылыстар ғарыштағы кемелер мен скафандрлар тесілгенде де байқалады.
Ерітінділердің концентрациясы.
Ерітінділерді сандық тұрғыдан сипаттау үшін концентрация ұғымын пайдаланады – ол көлем (немесе масса) бірлігіне зат (немесе масса) санының қатынасын көрсететін шама. Ерітінділердің концентрациясы келесідей негізгі әдістермен өрнектеледі:
Еріген заттың массалық үлесі ω (омега) – ол еріген зат массасының ерітіндінің жалпы массасына қатынасын көрсететін шама. Өлшем бірлігі: үлес, %.
 ,
, 
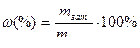 ,
, 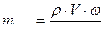
мұндағы mзат – еріген заттың массасы;
mер-ді – ерітіндінің массасы;
mер-ш – еріткіштің массасы;
ρ – ерітіндінің тығыздығы;
V – ерітіндінің көлемі.
Еріген заттың массалық үлесін ерітіндінің пайыздық (проценттік) концентрациясы деп жиі атайды.
Еріген заттың молярлық үлесі c - ол еріген зат мөлшерінің еріген зат пен еріткіштің жалпы мөлшеріне қатынасы.
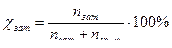 ,
, 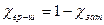
Мысал. 500 г көміртек тетрахлоридінде ССІ4 20 г йод J2 бар, осы ерітіндідегі йодтың молярлық үлесін есептеңдер.
Шешуі. Берілген ерітіндідегі йод пен көміртек тетрахлоридінің зат мөлшерін табамыз:
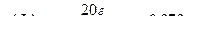
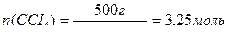
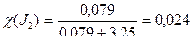
Сонда, көміртек тетрахлоридінің массалық үлесі:
c(ССІ4) = 1 – 0,024 = 0,976
Заттың молярлық концентрациясы. СМ немесе М еріген зат мөлшерінің 1л ерітіндіге қатынасын көрсетеді. Өлшем бірлігі: моль/л.
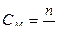 ,
, 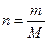 ,
, 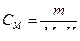
мұндағы n – еріген заттың мөлшері (моль);
V – ерітіндінің көлемі (литр);
m – еріген заттың массасы (кг, г);
М – еріген заттың молярлық массасы (г/моль).
1 М – бір молярлық ерітінді (1 литрде еріген заттың 1 молі болады);
0,5 М – жарты молярлық ерітінді;
0,1 М – децимолярлық ерітінді;
0,01 М – сантимолярлық ерітінді;
0,001 М – миллимолярлық ерітінді.
Мысалы, натрий гидроксидінің 0,1 (децимолярлық) ерітіндісін дайындау үшін 4 г NаОН (0,1 моль . 40 г/моль = 4 г) өлшеп алады да бір литрлік өлшеуіш шыны колбаға салып, дистильденген суды қосып, толық ерітеді. Сосын дистильденген суды белгіге дейін жеткізеді.
Эквиваленттік концентрация немесе нормальдық СН немесе Н – еріген заттың эквиваленті санының ерітінді көлеміне қатынасы. Өлшем бірлігі: моль/л.
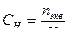
Еріген заттың моляльдік концентрациясы b немесе моляльділік еріген зат мөлшерінің еріткіш массасына (1 кг) қатынасын көрсетеді. Өлшем бірлігі: моль/кг
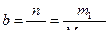
мұндағы п – еріген заттың моль саны;
m1 – еріген заттың массасы;
m2 – еріткіштің массасы;
М – еріген заттың молярлық массасы.
Сұйық сулы ерітінділер үшін молярлық пен моляльділіктің сандық мәндері бірдей, өйткені сұйық ерітінділердің тығыздығы бірге жуық.
Титр Т еріген зат массасының ерітінді көлеміне қатынасын көрсетеді. Өлшем бірлігі: г/мл.
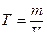 ,
, 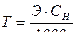
мұндағы m – еріген заттың массасы (г);
V – ерітінді көлемі (мл);
Э – эквиваленттің молярлық массасы;
СН – эквиваленттік концентрация.
Титрі белгілі ерітіндіні (титрленген ерітіндіні) дайындау үшін, қажетті көлемге есептелінген заттың дәл өлшендісін алып, дистильденген суда толық ерітіп, оны керекті көлемге жеткізеді.
Дисперсті жүйе туралы түсінік
Ағылшын химигі Томас Грэм (1860 ж) желім, желатин, альбумин және крахмал сияқты заттар, кәдімгі ерітінділерден пергамент немесе коллодийден дайындалған жарғақтан өту қабілеті бойынша өзгеше болатындығын табады. Егер коллодийден жасалған шағын дорба ішіне қант пен желім ерітіндісін салып, осы дорбашаны ағынды суға салса, дорбаша қабырғасынан қант ерітіндісі жеңіл өтеді де желім дорбашада қалып қояды. Мұндай әдісті диализ (сүзу) дейді. Өтпей қалатын заттарды гректің «kоlla» - «желім» деген сөзіне баламалап коллоидтар деп атайды. Томас Грэм дисперстік жүйенің қасиетін зерттейтін коллоидты химияның негізін қалаушы.
Шын ерітінділер – гомогенді жүйелер, ондағы бөлшектер ион, атом және молекула өлшемдері 5 нм жоғары емес. Жүйедегі бөлшек өлшемдерін бірнеше ондаған есе үлкейткенде гетерогенді жүйеге айналады. Мұндай жүйелерді дисперстік (ұсақ, майдалық) жүйелер дейді, ол екі фазадан тұрады: дисперсті орта және дисперсті фаза – дисперсті ортада аса ұнтақталған бөлшектер.
Дисперстік жүйенің маңызды сипаттамасы дисперстік дәрежесі, яғни дисперстік фаза бөлшектерінің орташа өлшемі. Барлық жүйелер дисперстік дәрежесі бойынша бөлінеді:
1. Молекулалы-дисперсті, ондағы зат бөлшектері ион, атом, молекула түрінде жүреді. Бұл шын ерітінділер.
2. Дисперсті жүйелер, ондағы бөлшектер өлшемі 10-6 м дейін, олар тұрақсыздау және уақыт өткен сайын дисперстік фазаға және дисперстік ортаға бөлінеді.
3. Жоғары дисперсті немесе коллоидты жүйелер, ондағы бөлшектердің орташа диаметрі 10-6 – 10-9
Дисперстік орта мен дисперстік фазаның агрегаттық күйіне байланысты дисперстік жүйе түрлері (3-кесте) болады.
Дисперстік жүйелердің негізгі түрлері
3-кесте
| Дисперстік орта | Дисперстік фаза | Дисперстік жүйе |
| Сұйық | Қатты | Жүзгіндер, зольдер (бояулар) |
| Сұйық | Сұйық | Эмульсия (сүт, майонез) |
| Сұйық | Газ тәрізді | Көбіктер |
| Газ тәрізді | Қатты | Аэрозольдер (түтін, шаң, тұмша) |
| Газ тәрізді | Сұйық | Аэрозольдер (тұман, бұлт) |
| Қатты | Қатты | Тау жыныстары, балқыма, қола |
| Қатты | Сұйық | Қатты эмульсия (май); гель (желе, агар-агар) |
| Қатты | Газ тәрізді | Кеуек материалдар (қыш, пемза ) |
Дисперстік жүйелер арасындағы коллоидтық ерітінділердің (зольдердің) орны ерекше – ол дисперстік ортасы сұйық жоғары дисперстік жүйе. Коллоидтық бөлшектерді мицелла дейді.
Коллоидты ерітінділерге (зольдерге) электролитті қосқанда түйір заряды азаяды, бұл бөлшектердің жабысуына әкеледі. Осылайша коллоидтық бөлшектердің үлкен агрегатқа айналуын ұю (коагуляция) деп атайды.
Ұю нәтижесінде, не салмақтық күш әсерінен бөлшектер тұнбаға түсуі мүмкін (бұл процесті седиментация дейді), ол жартылай қатты серпімді массаға (гель не сірнеге) айналуы мүмкін.
Коллоидты ерітінділер организмдердің тіршілігінде үлкен рөл атқарады және әртүрлі технологиялық процестерде кеңінен қолданылады: сабын қайнатуда, қағаз, тоқыма өнеркәсібінде, дәрі-дәрмек және т.б. өндірістерде.
Дата: 2019-05-29, просмотров: 528.