Опишите пути поступления ферментов в кровь
Кровь содержит множество ферментов, но их количество бывает настолько минимально, что их не удается обнаружить в качестве отдельной электрофоретической фракции. По происхождению ферменты крови принято разделять на три группы:
1. Собственные ферменты крови (секреторные). Ферменты, выполняющие определенные функции в крови. Ферменты свертывающей и антисвертывающей системы крови. Фермент липопротеидлипаза (атакует ЛП), триглицеридлипаза, лицитинхолистеролацилтрансфераза (ЛХАТ) катализирует реакцию этерефикации холистерола
2. Ферменты, поступающие в кровь из тканей в результате гибели клеток или утечки через мембрану. Индикаторные ферменты.
3. Ферменты, поступающие в кровь из выводных протоков различных желез. Экскреторные ферменты. Амилаза и липаза (из поджелудочной железы), щелочная фосфотаза (из печени).
Для клинической практики имеют значение гиперферментемии или гипоферментемии. Чаще встречаются первые.
Вторые встречаются редко, обычно это или результат нарушения поступления секреторных ферментов (при церрозах часто) или результат интоксикации (например снижение активности холиностеразы при поражениях фосфорорганическими средствами). Это может быть результат наследственной патологии, касается это отсутствие некоторых протеиназ системы свертывания крови при гемофилиях.
Выход ферментов в кровь.
Существует несколько факторов определяющих скорость выхода ферментов из поврежденных тканей в кровь:
1. Концентрационный градиент ткань-кровь. Чем выше тем быстрее ферменты уходят в кровь ферменты из поврежденных клеток. Пример: в печени лактатдегидрогиназа (ЛДГ) концентрационный градиент по отношению с кровью 3000:1. Для АсАТ и АлАТ - 10.000:1.
2. Относительная молекулярная масса. Ферменты с меньшей молекулярной массой быстрее выходят из клеток в кровь.
3. Внутриклеточная локализация ферментов. Цитоплазматические ферменты в крови появляются раньше, чем внутримитохондриальные.
Ферменты важны для диагностики заболеваний. Это связано с тем, что ферменты вырабатываются в клетках и при их разрушении поступают в кровь, мочу, пищеварительные соки. Каждый орган или ткань имеет характерный набор ферментов. Появление этих ферментов в крови позволяет установить патологию. Пример: в сердечной мышце содержатся креатинкиназа и аспартатаминотрансфераза. При инфаркте миокарда в крови резко повышается активность креатинкиназы и аспартатаминотрансферазы. Печень содержит преимущественно аланинаминотрансферазу, щелочную фосфатазу. Поэтому при патологии печеночной ткани в крови резко возрастает активность АлАТ и ЩФ. Так как содержание ферментов в крови величина довольно постоянная, то увеличение или снижение активности ферментов указывает на патологию.
Выход ферментов в кровь происходит не только при разрушение клетки, но и при повышении проницаемости клеточных мембран, т. е. в самом начале патологического процесса. Это особенно важно для ранней диагностики. Пример: при развитии инфаркта миокарда активность креатинкиназы резко возрастает уже в первые 2 -3 часа, через 3 часа после начала приступа панкреатита, возрастает активность L-амилазы; активность ЛДГ-4,5 высока ещё в доклинической стадии инфекционного гепатита.
3. Охарактеризуйте медицинское значение изоферментов и методы их определения


Энзимодиагностика
Энзимодиагностика заключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека. Принципы энзимодиагностики основаны на следующих позициях:
· при повреждении клеток в крови или других биологических жидкостях (например, в моче) увеличивается концентрация внутриклеточных ферментов повреждённых клеток;
· количество высвобождаемого фермента достаточно для его обнаружения;
· активность ферментов в биологических жидкостях, обнаруживаемых при повреждении клеток, стабильна в течение достаточно длительного времени и отличается от нормальных значений;
· ряд ферментов имеет преимущественную или абсолютную локализацию в определённых органах (органоспецифичность);
· существуют различия во внутриклеточной локализации ряда ферментов .
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногенности. Тем не менее энзимотерапию активно развивают в следующих направлениях: заместительная терапия – использование ферментов в случае их недостаточности; элементы комплексной терапии – применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани).
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов.
Предпосылкой антилейкемического действия аспарагиназы послужило обнаружение в лейкозных клетках дефектного фермента аспарагинсинтетазы, катализирующего реакцию синтеза аспарагина.
Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если имеющийся в плазме аспарагин разрушать введением аспарагиназы, то в лейкозных клетках наступит дефицит аспарагина и в результате – нарушение метаболизма клетки и остановка прогрессирования заболевания.
Причины:
при центральном (нейрогенном) несахарном диабете нарушение возникает на уровне синтеза вазопрессина, либо на уровне секреции антидиуретического гормона гипофизом в кровь (проба с сухоядением приводит к быстрому развитию обезвоживания);
при почечном (нефрогенном) — нарушение (тубулопатия) происходит на уровне восприятия антидиуретического гормона клетками дистальных отделов канальцев нефрона (проба с сухоядением приводит к быстрому развитию обезвоживания);
несахарный диабет беременных, транзиторный, спонтанно исчезает вскоре после родов;
также встречается инсипидарный синдром (несахарный диабет нервного происхождения), характеризуется преимущественно жаждой, проба с сухоядением быстро прекращает мочеизнурение (полиурию).
Биохимические показатели
При исследовании мочи определяют ее низкую относительную плотность (<1005), гипонатрийурию (гипоосмолярность мочи - 100—200 мосм/кг). В крови выявляются гиперосмолярность (гипернатрийемия) плазмы (> 290 мосм/кг), гиперкальциемия и гипокалиемия. Сахарный диабет исключается определением глюкозы крови натощак. При центральной форме несахарного диабета в крови определяется низкое содержание АДГ.
Причины сахарного диабета
Недостаточный синтез инсулина
Развитие ИЗСД (СД 1 типа) обусловлено недостаточным синтезом инсулина в β-клетках островков Лангерганса поджелудочной железы. Среди причин этого в настоящее время на первый план выдвигаются аутоиммунные поражения и инфицирование β-тропными вирусами (вирусы Коксаки, Эпштейна-Бар, эпидемического паротита).
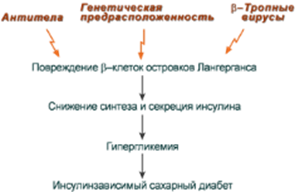
Имеется опасность развития ИЗСД при использовании коровьего молока или молочных смесей для вскармливания младенцев из-за возможного развития иммунного ответа на молочный альбумин и переключения иммунной атаки на β-клетки поджелудочной железы. Происходит это в результате того, что некоторые пептидные участки альбумина коровьего молока и человеческого инсулина схожи между собой. Поэтому при переходе их через кишечный барьер у носителей антигенов главного комплекса гистосовместимо-сти D3/D4 может возникнуть перекрестная иммунная реактивность и, как следствие, аутоиммунный ответ против собственных β-клеток, что приводит к инсулинзависимому сахарному диабету.
Нечувствительность клеток к инсулину
Для ИНЗСД (СД 2 типа) ведущей причиной является инсулинорезистентность из-за снижения чувствительности клеток-мишеней к гормону. Здесь выделяют две глобальные причины:
1) снижение активности рецепторов (рецепторные механизмы),
2) нарушение проведения сигнала от рецептора к внутриклеточным ферментам (пострецепторные механизмы).
1) Рецепторные механизмы
Функциональные нарушения рецепторов - замедляют связывание инсулина и ответ на него:
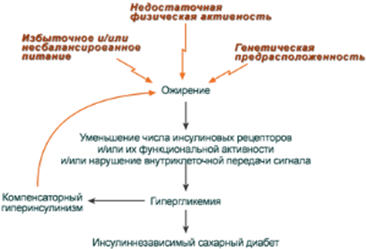
· увеличение диаметра и площади поверхности жировых клеток (ожирение) - снижение скорости образования рецепторных микроагрегатов,
· повышенная вязкость мембран (снижение доли ненасыщенных жирных кислот в фосфолипидах, увеличение содержания холестерина),
· блокирование инсулиновых рецепторов антителами,
· нарушение мембран в результате активации процесов ПОЛ.
Структурные нарушения рецепторов - не позволяют связываться с гормоном или отвечать на его сигнал.
· изменение конформации рецепторов инсулина при воздействии свободных радикалов (продуктов окислительного стресса).
2) Пострецепторные механизмы
Пострецепторные механизмы сопровождаются ослаблением проведения сигнала через фосфоинозитол-3-киназный путь.
В настоящее время ослабление проведения сигнала через IRS-ФИ-3-киназный путь считают главной причиной инсулинорезистентности.
В результате развиваются нарушение работы трансмембранных переносчиков глюкозы (ГлюТ4) и снижение активации белков сигнального пути.
Транспорт глюкозы из крови в клетки. Глюкоза поступает из кровотока в клетки путём облегчённой диффузии с помощью белков-переносчиков - ГЛЮТов. Глюкозные транспортёры ГЛЮТы имеют доменную организацию и обнаружены во всех тканях. Выделяют 5 типов ГЛЮТов:
· ГЛЮТ-1 - преимущественно в мозге, плаценте, почках, толстом кишечнике;
· ГЛЮТ-2 - преимущественно в печени, почках, β-клетках поджелудочной железы, энтероцитах, есть в эритроцитах.
· ГЛЮТ-3 - во многих тканях, включая мозг, плаценту, почки. Обладает большим, чем ГЛЮТ-1, сродством к глюкозе;
· ГЛЮТ-4 - инсулинзависимый, в мышцах (скелетной, сердечной), жировой ткани
· ГЛЮТ-5 - много в клетках тонкого кишечника, является переносчиком фруктозы.
ГЛЮТы, в зависимости от типа, могут находиться преимущественно как в плазматической мембране, так и в цитозольных везикулах. Трансмембранный перенос глюкозы происходит только тогда, когда ГЛЮТы находятся в плазматической мембране. Встраивание ГЛЮТов в мембрану из цитозольных везикул происходит под действием инсулина. При снижении концентрации инсулина в крови эти ГЛЮТы снова перемещаются в цитоплазму. Ткани, в которых ГЛЮТы без инсулина почти полностью находятся в цитоплазме клеток (ГЛЮТ-4, и в меньшей мере ГЛЮТ-1), оказываются инсулинзависимыми (мышцы, жировая ткань), а ткани, в которых ГЛЮТы преимущественно находятся в плазматической мембране (ГЛЮТ-3) - инсулиннезависимыми. Известны различные нарушения в работе ГЛЮТов. Наследственный дефект этих белков может лежать в основе инсулинонезависимого сахарного диабета.
Предложено два механизма нарушения ФИ-3-киназного пути:
a) Фосфорилирование серина (но не тирозина) в составе IRS уменьшает его способность связываться с ФИ-3-киназой и ослабляет ее активирование. Данный процесс катализируется множеством серин-треониновых киназ, активность которых повышается при воспалении, стрессе, гиперлипидемиях, ожирении, переедании, дисфункции митохондрий.
b) Нарушение баланса между количеством субъединиц ФИ-3-киназы (p85 и p110), т.к. эти субъединицы могут конкурировать за одни и те же участки связывания с белком IRS. Этот дисбаланс меняет активность фермента и снижает передачу сигнала. Причиной патологического повышения отношения p85/p110 предполагают высококалорийное питание.
 Развивающуюся при беременности инсулинорезистентность связывают с увеличенной экспрессией в клетках скелетных мышц субъединицы p85, вызванной повышением концентрации человеческого плацентарного гормона роста. Соответственно, изменяется соотношение p85/p110 и ухудшается развертывание быстрых эффектов инсулина.
Развивающуюся при беременности инсулинорезистентность связывают с увеличенной экспрессией в клетках скелетных мышц субъединицы p85, вызванной повышением концентрации человеческого плацентарного гормона роста. Соответственно, изменяется соотношение p85/p110 и ухудшается развертывание быстрых эффектов инсулина.
Биохимические характеристики
1. При сахарном диабете возникает гипергликемия, а затем и глюкозурия. Возникновению гипергликемии способствуют следующие причины: а) отсутствие инсулина приводит к тому, что проницаемость мембран клеток уменьшается и поэтому глюкоза в меньших количествах поступает из крови в клетки и ткани; б) под влиянием контринсулярных гормонов в клетках-мишенях повышается липолиз, продукты гидролиза липидов поступают в кровь, увеличивается концентрация СЖК в крови (что также задерживает поступление глюкозы в ткани). Из крови СЖК попадают в печень, усиливается синтез ТАГ. Тем более, что в печени происходит фосфорилирование глицерина и образование a-глицерофосфата, используемого для липогенеза (в др. тканях образование a-глицерофосфата происходит из диоксиацетонфосфата -продукта распада глюкозы- при его восстановлении), а т.к. СТГ препятствует утилизации глюкозы в мышечной ткани, следовательно, в этой ткани не образуется ДОАФ и a-глицерофосфат. Поступающие в печень СЖК препятствуют проникновению глюкозы в ткань. Усиливающийся липогенез в печени приводит к липемии и жировой инфильтрации печени; в) ГКС повышают количество глюкозы в крови за счёт образования её из продуктов распада аминокислот; г) Катехоламины и глюкагон увеличивают количество глюкозы за счёт распада гликогена, а глюкагон также способствует глюконеогенезу из глицерина.
Таким образом, гипергликемия обусловлена уменьшением утили-зации глюкозы и повышением её синтеза из аминокислот и глицерина. Возникает парадокс - «голод среди изобилия», т.е. глюкозы в крови много, но попасть в клетки и утилизироваться она не может.
Развивающаяся гипергликемия, наряду с уменьшением процессов утилизации глюкозы, приводит к развитию глюкозурии и выведению такого ценного энергетического материала, как глюкоза. Усиленный гликогенолиз, развивающийся под влиянием контринсулярных гормонов в печени, приводит к снижению концентрации гликогена в печени. В белковом обмене наблюдается замедление синтеза РНК, белков, замедление роста и дифференцировки тканей в молодом организме и процессов репарации во взрослом.
2. Сахарный диабет характеризуется гиперкетонемией и кетонурией. Повышенная концентрация СЖК в печени прриводит к тому, что усиливается b-окисление и активные уксусные кислоты используются на образование кетоновых тел (влияние адреналина и глюкагона). Кетогенез имеет биологический смысл. Дело в том, что организм больного сахарным диабетом не может использовать глюкозу как источник энергии, поэтому переходит на продукты распада липидов - кетоновые тела. Кетоновых тел образуется много, попадая в кровь, они вызывают гиперкетонемию,кетоацидоз,кетонурию. У больных сахарным диабетом много больше, чем у здорового человека из ацетоуксусной кислоты образуется ацетона, поэтому появляется фруктовый запах изо рта, пахнет даже кожа. Образование ацетона можно считать компенсаторным явлением, так организм защищается от избытка кислореагирующей ацетоуксусной кислоты.
3. Для сахарного диабета характерны полиурия,полидипсия: сухость во рту, дряблость кожи, увеличение вязкости крови. Полиурия возникает от того, что гипергликемия, увеличивающая осмотическое давление крови, способствует транспорту воды из клеток в кровь, а затем выделению с мочой больших количеств воды с глюкозой мочи. Полиурия обусловливает обезвоживание организма, сухость слизистых тканей, сухость слизистой ротовой полости, раздражение центра жажды, полидипсию. Дряблость кожи, мышц можно объяснить не только повышенным распадом в них белков, но и обезвоживанием указанных тканей.
4. Характерны также азотемия и выделение в больших количествах азотсодержащих веществ. Здесь проявляется действие ГКС: они вызывают распад белков до аминокислот, образовав-шийся при дезаминировании аммиак используется на образование мочевины, последний выделяется с мочой).
5. В некоторые ткани, так называемые инсулин-независимые– нервная ткань, хрусталик, эритроциты, семенные пузырьки, b-клетки, поступает глюкоза (поступление глюкозы не зависит от инсулина, а зависит от концентрации глюкозы в крови), глюкозы поступает много, она не успевает фосфорилироваться и превращается в сорбитол и фруктозу, осмотически активные вещества, наличие которых вызывает повреждение указанных тканей. Если при истинном сахарном диабете во всех клетках-мишенях наблюдается повышенный липолиз, жировая ткань «тает», больной худеет, то при тучном диабете в жировой ткани сохраняется регуляторное влияние инсулина (в ней есть рецепторы связанного инсулина), поэтому в этой ткани продолжают идти процессы липогенеза, больной толстеет.
Факторы риска:
Курение (наиболее опасный фактор); гиперлипопротеинемия (общий холестерин > 5 ммоль/л, ЛПНП > 3 ммоль/л, ЛП(a) > 50 мг/дл); артериальная гипертензия (систолическое АД > 140 мм рт. ст. диастолическое АД > 90 мм рт. ст.); сахарный диабет; ожирение; малоподвижный образ жизни (гиподинамия); эмоциональное перенапряжение; неправильное питание; наследственная предрасположенность и тд.
 Биохимия атеросклероза
Биохимия атеросклероза
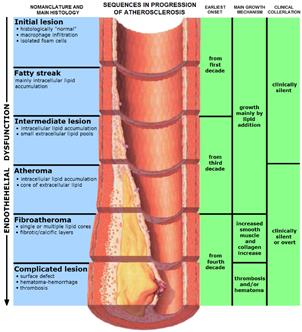
Атеросклероз – это патология, характеризующаяся появлением атерогенных бляшек на внутренней поверхности сосудистой стенки. Одна из основных причин развития такой патологии – нарушение баланса между поступлением холестерола с пищей, его синтезом и выведением из организма. У пациентов, страдающих атеросклерозом, повышены концентрации ЛПНП и ЛПОНП. Существует обратная зависимость между концентрацией ЛПВП и вероятностью развития атеросклероза. Это согласуется с представлениями о функционировании ЛПНП как переносчиков ХС в ткани, а ЛПВП – из тканей.
Базовой метаболической «предпосылкой» развития атеросклероза является гиперхолестеролемия. (повышенное содержание холестерола в крови).
Гиперхолестеролемия развивается:
1. вследствие избыточного поступления ХС, углеводов и жиров;
2. генетической предрасположенности, заключающейся в наследственных дефектах структуры рецепторов ЛПНП или апоВ-100, а также в повышенном синтезе или секреции апоВ-100 (в случае семейной комбинированной гиперлипидемии, при которой в крови повышены концентрации и ХС и ТАГ).
Важную роль в механизмах развития атеросклероза играет модифицирование ЛП. Изменения нормальной структуры липидов и белков в составе ЛПНП делает их чужеродными для организма и поэтому более доступными для захвата фагоцитами.
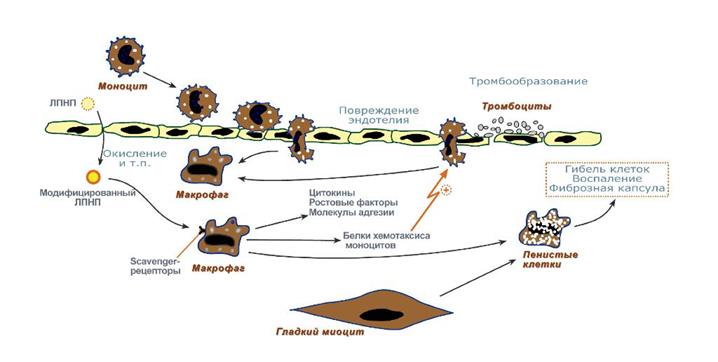
Модифицирование ЛП может происходить по нескольким механизмам:
1. гликозилирование белков, происходящее при увеличении концентрации глюкозы в крови;
2. перекисная модификация, приводящая к изменениям липидов в липопротеинах и структуры апоВ-100;
3. формирование аутоиммунных комплексов ЛП-антитело (изменённые ЛП могут становиться причиной образования аутоантител).
Модифицированные ЛПНП поглощаются макрофагами. Этот процесс не регулируется количеством поглощенного ХС, как в случае его поступления в клетки через специфические рецепторы, поэтому макрофаги перегружаются ХС и превращаются в «пенистые клетки», которые проникают в субэндотелиальное пространство. Это приводит к формированию липидных пятен или полосок в стенке кровеносных сосудов. На этой стадии эндотелий сосудов может сохранять свою структуру. При увеличении количества пенистых клеток происходит повреждение эндотелия. Повреждение способствует активации тромбоцитов. В результате они секретируют тромбоксан, который стимулирует агрегацию тромбоцитов, а также начинают продуцировать тромбоцитарный фактор роста, стимулирующий пролиферацию гладкомышечных клеток. Последние мигрируют из медиального во внутренний слой артериальной стенки, способствуя таким образом росту бляшки. Далее происходит прорастание бляшки фиброзной тканью, клетки под фиброзной оболочкой некротизируются, а ХС откладывается в межклеточном пространстве. На последних стадиях развития бляшка пропитывается солями кальция и становится очень плотной. В области бляшки часто образуются тромбы, перекрывающие просвет сосуда, что приводит к острому нарушению кровообращения в соответствующем участке ткани и развитию инфаркта.
Способы стабилизации уровня
Повышение креатинкиназы не диагностируется как самостоятельное заболевание. Изменение показателей является следствием патологических нарушений целостности мышечных волокон миокарда, скелетных мышц и нервной ткани головного мозга. Первоначально необходимо определить причину, повлиявшую на отклонение значений от нормы.
Имеющиеся в анамнезе заболевания, на фоне которых поднимается уровень КФК, следует лечить согласно принятой терапевтической схемы, дополнить которую рекомендуется диетотерапией.
Некоторые хронические болезни (сахарный диабет, аутоиммунные и генетические патологии) вылечить полностью невозможно. В этом случае врач, занимающийся основным заболеванием. должен скорректировать тактику лечения с учетом результатов биохимического анализа крови.
Независимо от причины, высокий показатель креатинкиназы можно уменьшить, соблюдая следующие рекомендации:
· Избегать психоэмоциональных перегрузок. Дистресс (постоянное нервно-психологическое напряжение) является одной из причин болезней сердца и ЦНС.
· Соблюдать режим труда и отдыха. Для восстановления энергетических ресурсов организму необходим полноценный сон продолжительностью не менее 7–8 часов.
· Рационально планировать занятия спортом и иную физическую активность. Нагрузки на мышечный аппарат (в том числе миокард) должны быть умеренными, но обязательно регулярными.
Пересмотреть ежедневный рацион. Из меню необходимо убрать вредные продукты, заменив их полезными.
Ответ: 1, 2.
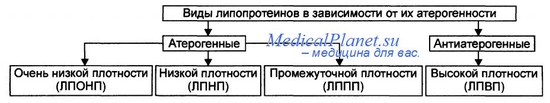
Атерогенность липопротеидов в определенной степени связана с размером самих частиц. Антиатерогенные ЛПВП являются самыми мелкими липопротеидами, поэтому они беспрепятственно проходят сквозь стенки артерий и так же свободно их покидают, не засоряя кровяное русло.
Крупные ЛП – это липопротеиды с очень низкой плотностью. Они, как и хилломикроны, в составе которых много триглицеридов, могут не обладать атерогенными свойствами, но их излишки способствуют развитию панкреатита. ЛП промежуточной плотности при окислении легко задерживаются в сосудах, поэтому их относят к атерогенным.
Повышение концентрации атерогенных липопротеинов увеличивает вероятность развития ИБС как у мужчин, так и у женщин, независимо от склонности к заболеванию. Статистика показывает, что рост уровня ЛПНП всего лишь на один процент увеличивает вероятность развития ИБС до 3%, поэтому снижение показателей атерогенных липопротеидов является стратегической целью профилактики сердечной недостаточности и основной задачей медикаментозной и диетотерапии при дислипидемии.
Кроме концентрации ЛПНП вероятность развития ИБС увеличивает и их размер. Экспериментально установлено, что пациенты, у которых выявлены при обследовании преимущественно ЛПНП фенотипа В (мелкого и плотного вида) рискуют заболеть ИБС в 3 раза больше при любом содержании ЛПНП.
ЛПНП – наиболее атерогенные липопротеины крови. Строгая, независимая прямая связь между уровнем ХС ЛПНП и риском ИБС четко установлена как у мужчин, так и у женщин, у лиц без признаков ИБС и больных ИБС. По расчетам, увеличение концентрации ХС ЛПНП на 1% может привести к увеличению риска ИБС на 2–3 %.
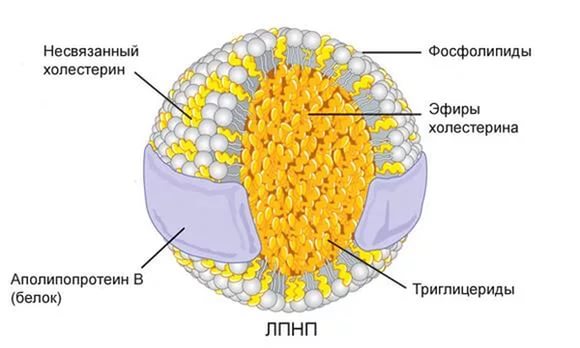
Липопротеины
 Липопротеины плазмы подразделяются на две группы: белки, связанные с липидами ковалентно, и белки, связанные с липидами нековалентными связями. Липид, ковалентно связанный с липопротеином, служит якорем, с помощью которого белки прикрепляются к мембране (см. рис. 231). Липопротеины второй группы не имеют строго определенного состава. Они скорее представляют собой агрегаты липидов с белками. Эти липопротеиновые комплексы имеют переменные размеры и состав. В плазме крови они обеспечивают транспорт водонерастворимых липидов.
Липопротеины плазмы подразделяются на две группы: белки, связанные с липидами ковалентно, и белки, связанные с липидами нековалентными связями. Липид, ковалентно связанный с липопротеином, служит якорем, с помощью которого белки прикрепляются к мембране (см. рис. 231). Липопротеины второй группы не имеют строго определенного состава. Они скорее представляют собой агрегаты липидов с белками. Эти липопротеиновые комплексы имеют переменные размеры и состав. В плазме крови они обеспечивают транспорт водонерастворимых липидов.
Виды липопротеинов
| Вид | Размеры | Функция |
| Липопротеины высокой плотности (ЛВП) | 8-11 нм | Транспорт холестерина от периферийных тканей к печени |
| Липопротеины низкой плотности (ЛНП) | 18-26 нм | Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям |
| Липопротеины промежуточной (средней) плотности ЛПП (ЛСП) | 25-35 нм | Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям |
| Липопротеины очень низкой плотности (ЛОНП) | 30-80 нм | Транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75-1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
У человека, длительно не употреблявшего в пищу жиры, обнаружены дерматит, плохое заживление ран, ухудшение зрения, снижение гонадотропной функции. После назначения рыбьего жира в терапевтических дозах все симптомы исчезли. Объясните эффективность лечения.
Рыбий жир содержит необходимые человеку витамины A и D, а также полиненасыщенные жирные кислоты. Витамин А является противоинфекционным витамином. Он необходим для поддержания целостности и функционирования эпителия. Витамин A нужен нашему организму для сохранения хорошего зрения, поддержания здоровья волос, кожи, слизистых оболочек респираторного тракта и пищеварительной системы, оказывает положительное действие на процессы роста костной ткани и зубной эмали, а также обладает антиоксидантными свойствами.
Витамин D принимает активное участие в поддержании минерального гомеостаза в организме: регулирует фосфорно-кальциевый обмен, способствует проникновению фосфора и кальция в клетки организма, сохраняет и поддерживает оптимальную структуру костей и зубов; предотвращает повышенную нервную возбудимость и судорожные подергивания в мышцах ног. Ведущей функцией витамина D является обеспечение нормального роста костной ткани – адекватная ее минерализация. Он укрепляет иммунную систему. От присутствия в организме витамина D зависит восприимчивость к кожным заболеваниям и болезням сердца. Кроме того, он участвует в метаболизме липидов, регуляции артериального давления и др.
ЭПК и ДГК оказывают влияние на метаболизм липидов, сосудистый тонус и свертывание крови. Благодаря своим противовоспалительным эффектам они оказывают позитивное влияние на течение воспалительного процесса при ряде системных заболеваний соединительной ткани, в том числе при ревматоидном артрите.
ДГК – главный структурный компонент фосфоглицеридов, образующих клеточные мембраны в фоторецепторах сетчатки и, следовательно, влияющих на развитие зрения. Нормальное развитие зрения и когнитивной функции зависит от уровня ДГК в синапсах и фоторецепторах. Дети, получавшие от матерей ДГК в течение беременности, имели существенно лучшее развитие зрительной активности в возрасте 4–6 месяцев.
У пожилого человека после приема в пищу молока наблюдались диспепсические расстройства (тошнота, рвота, диарея). При употреблении в пищу молочнокислых продуктов наблюдаемые явления проходили. Назовите возможные причины заболевания
Лактазная недостаточность – ферментопатия, характеризующаяся неспособностью расщеплять молочный сахар (лактозу) в связи со снижением активности или отсутствием фермента лактазы.
Для диагностики лактазной недостаточности проводится исследование кала (на углеводы, pH), диетодиагностика, генотипирование. В норме молочный сахар (лактоза), поступающий с пищей, расщепляется в тонкой кишке под действием фермента лактазы (лактазофлоризингидролазы) с образованием глюкозы и галактозы, которые затем всасываются в кровь. Глюкоза служит основным энергетическим ресурсом в организме; галактоза входит в состав галактолипидов, необходимых для развития ЦНС. При лактазной недостаточности нерасщепленный молочный сахар поступает в неизменном виде в толстую кишку, где сбраживается микрофлорой, вызывая снижение рН кишечного содержимого, повышенное газообразование и секрецию воды.
В основе первичной врожденной лактазной недостаточности чаще всего лежит генетически детерминированное нарушение синтеза лактазы. Активность фермента лактазы кодируется геном, локализованным на 2-ой хромосоме; а лактазная недостаточность наследуется по аутосомно-рецессивному типу. Кроме этого, встречается конституциональная лактазная недостаточность – возрастное снижение активности лактазы, которое начинается уже в 3-5 лет и продолжается в зрелом возрасте. Учитывая, что у плода активность лактазы достигает максимума в последние недели гестации и к моменту рождения, лактазная недостаточность также обычно свойственна недоношенным детям.
Вторичная лактазная недостаточность возникает при повреждении энтероцитов вследствие заболеваний тонкой кишки (энтерита, ротавирусной инфекции, острых кишечных инфекций, лямблиоза и др.).
Классификация
Таким образом, различают первичную (врожденную) лактазную недостаточность (алактазию, наследственную непереносимость дисахаридов); гиполактазию взрослого типа; транзиторную лактазную недостаточность недоношенных и вторичную лактазную недостаточность, ассоциированную с повреждением энтероцитов.
По степени выраженности ферментной недостаточности принято говорить о гиполактазии (частичном снижении активности фермента) и алактазии (полном отсутствии фермента). Течение лактазной недостаточности может быть транзиторным или персистирующим.
Некоторые авторы к одному из вариантов лактазной недостаточности относят галактоземию, хотя такой взгляд довольно спорен.
Симптомы лактазной недостаточности
Лактазная недостаточность характеризуется непереносимостью молочных продуктов, поэтому все симптомы нарушения пищеварения развиваются на фоне употребления продуктов, богатых лактозой, в первую очередь, цельного молока.
Основным клиническим признаком лактазной недостаточности служит бродильная диарея в виде частого, жидкого, пенистого стула, имеющего кислый запах. Частота дефекации при лактазной недостаточности достигает 10-12 раз в сутки; реже проявлением ферментопатии служат запоры.
Следствием диареи служит дегидратация, недостаточная прибавка массы тела и гипотрофия. Избыточное поступление нерасщепленной лактозы в толстую кишку обусловливает количественное и качественное изменение состава микрофлоры и развитие дисбактериоза.
При лактазной недостаточности развиваются изменения со стороны центральной нервной системы, что объясняется нарушением нутритивного статуса, дефицитом витаминов и минералов, эндогенной интоксикацией вследствие бродильных процессов в ЖКТ. При может отмечаться гипервозбудимость, раздражительность, нарушения сна.
Диагностика
Для достоверной диагностики лактазной недостаточности характерные клинические данные должны быть обязательно подтверждены дополнительными лабораторными исследованиями.
Так называемая «диетодиагностика» основана на исчезновении клинических признаков лактазной недостаточности (диареи, метеоризма) при исключении лактозы из рациона и появлении симптоматики при употреблении молока. После нагрузки лактозой также увеличивается уровень водорода и метана в выдыхаемом воздухе.
При биохимическом исследовании кала определяется снижение pH <5,5, увеличение или появление содержания лактозы и углеводов в кале. Золотым стандартом диагностики лактазной недостаточности считается определение активности лактазы в биоптатах тонкой кишки, однако сложность и инвазивность метода ограничивают его использование на практике. Первичная лактазная недостаточность может быть выявлена в ходе генетического исследования («лактазного генотипирования»).
Лечение лактазной недостаточности
Подход к терапии лактазной недостаточности имеет свои особенности. Базовые принципы строятся на организации лечебного питания, оптимизации расщепления лактозы, предупреждении развития осложнений (гипотрофии, поливитаминной и полиминеральной недостаточности). Из диеты полностью исключаются цельное и сгущенное молоко, кондитерские изделия, содержащие молочные наполнители, некоторые лекарственные препараты (пробиотики) и т. д. При незначительной гиполактазии разрешается употребление кисломолочных продуктов, йогуртов, сливочного масла, если они не вызывают клинических симптомов лактазной недостаточности.
У ребенка младшего возраста с нормальным развитием после приема пищи появилась стойкая диарея, рвота, боли в животе. Исключение из рациона молока не дало положительного результата. После нагрузки сахарозой уровень глюкозы в крови повышался незначительно. Назовите фермент, отсутствие которого приводит к появлению указанных признаков.
Активность КФК( Креатинфосфокиназа ) в сыворотке крови обычно повышена уже в покое и еще больше возрастает после физической нагрузки. Нагрузка приводит также к увеличению содержания аммиака, инозина, гипоксантина и мочевой кислоты в крови.
Гликогеноз типа V наследуется как аутосомно-рецессивный признак. Ген мышечной фосфорилазы расположен на хромосоме 11 ( 11q13 ).
накопления гликогена в миокарде возможна сердечная недостаточность .
Лечение симптоматическое. Клинические симптомы можно предотвратить, исключив чрезмерные физические нагрузки. Однако регулярные умеренные нагрузки улучшают работоспособность. Прием глюкозы или фруктозы внутрь или введение глюкагона также увеличивают переносимость нагрузок. Физическая выносливость возрастает и при потреблении диеты с высоким содержанием белка. В некоторых случаях помогают добавки креатина. На продолжительность жизни заболевание обычно не влияет.
У человека, ведущего сидячий образ жизни, после интенсивной физической нагрузки наблюдаются боли в мышцах. С изменением какого метаболического процесса, обеспечивавшего энергией работающие мышцы, связаны болевые ощущения?
Причиной болевых ощущений в мыщцах после и нтенсивной физической нагрузки является ГЛИКОЛИЗ. Анаэробное окисление глюкозы, которое называется гликолизом, включает реакции постепенного превращения ее молекулы в пировиноградную кислоту, а затем при недостаточности кислорода в тканях — в молочную кислоту. Этот процесс сопровождается образованием АТФ и выделением тепловой энергии. Гликолиз протекает преимущественно в скелетных мышцах при интенсивных физических нагрузках или в условиях гипоксии. Образовавшаяся молочная кислота из мышц поступает в кровь, доставляется в печень, где аэробно окисляется или используется для новообразования глюкозы. Извлечение метаболической энергии из углеводов происходит почти во всех клетках организма человека и включает две основные фазы — бескислородное (анаэробное) окисление, которое протекает в цитозоле преимущественно скелетных мышц и называется гликолизом, и кислородное (аэробное) окисление, протекающее в митохондриях на ферментах цикла лимонной кислоты и дыхательной цепи. Гликолиз и гликогенолиз играют важную роль при мышечной деятельности анаэробного характера. Они обеспечивают энергией интенсивную работу в пределах от 30 с до 2-5 мин. При физических нагрузках усиливается метаболизм, в том числе тех процессов, которые приводят к накоплению кислых продуктов. В скелетных мышцах в процессе гликолиза (анаэробного окисления глюкозы) накапливается молочная кислота. Она поступает в кровь и может изменять кислотно-щелочное равновесие организма. При умеренных (аэробных) физических нагрузках молочная кислота образуется в незначительном количестве, поэтому существенного изменения рН крови не наблюдается. Интенсивные физические нагрузки анаэробной направленности, особенно спринтерские дистанции в беге и плавании, приводят к значительному накоплению молочной кислоты в скелетных мышцах и выходу ее в кровь. При этом в скелетных мышцах и крови рН снижается до 7,0 или даже до 6,5. Закисление внутренней среды организма называется ацидозом.
Ацидотическое состояние может сопровождаться болевыми ощущениями в мышцах и снижением физической работоспособности. .Ацидоз является фактором, вызывающим утомление организма. После прекращения работы рН мышц и крови быстро нормализуется (в пределах 30 мин). Болевые ощущения, связанные с изменением рН внутренней среды организма при физических нагрузках, также исчезают в этот период времени.
У новорожденного выявлена гипогликемия, в крови повышена концентрация лактата. В интервалах между кормлениями появляются судороги. Частое кормление резко улучшает состояние ребенка. Как называется данная патология?
Болезнь Гирке – это наследственная патология, которая обусловлена недостаточностью печеночных ферментов, трансформирующих глюкозо-6-фосфат в глюкозу. Протекает с нарушениями углеводного и липидного обмена, характеризуется гипогликемией, накоплением в печени и почках гликогена. Лечение основано на диетотерапии, обеспечивающей круглосуточное поступление глюкозы в кровоток.
Причины
Заболевание относится к наследственным метаболическим патологиям, передается от поколения к поколению по аутосомно-рецессивному механизму. Причина болезни – мутации генов, которые кодируют печеночный фермент, запускающий процесс превращения гликогена в свободную глюкозу. При изменении гена G6PC нарушено производство глюкозо-6-фосфатазы, при изменении в структуре гена SLC37A4 – синтез глюкозо-6-фосфаттранслоказы.
Для развития гликогенеза необходимо, чтобы ребенок получил мутировавший ген от матери и от отца. Патология развивается при наличии пары измененных рецессивных генов, а если присутствует только один дефектный ген, ребенок остается здоровым, но является носителем заболевания и способен передать его своим будущим детям. Таким образом, вероятность болезни у новорожденного, оба родителя которого – носители мутации, составляет 25%.
Патогенез
При болезни Гирке клетки печени оказываются неспособными производить ферменты, обусловливающие процессы гликогенолиза (расщепления гликогена до глюкозы) и глюконеогенеза (образования глюкозы из неуглеводных соединений). Преобразование поступающей с пищей глюкозы в гликоген, а также его депонирование в печеночной и других тканях остается сохранным. Гликоген накапливается, но не растрачивается на нужды организма, печень увеличивается. В перерывах между приемами пищи развивается гипогликемия из-за невозможности использования энергетических запасов.
Формируется почечная и печеночная недостаточность. В кровотоке повышается концентрация молочной кислоты, возникает ацидоз.
Классификация
По характеру течения болезнь Гирке бывает острой и хронической. Острая форма чаще развивается на первом году жизни ребенка, проявляется выраженной симптоматикой: рвотой, мышечными судорогами, поверхностным частым дыханием, которое сопровождается чувством нехватки воздуха. Для хронической формы характерно постепенное прогрессирование почечной и печеночной недостаточности, отставание в росте, задержка пубертата. Согласно первоначальному ферментному дефекту выделяют два типа гликогеноза:
Симптомы болезни Гирке
Симптоматика заболевания чаще всего разворачивается на 3-4 месяце жизни, реже – с периода новорожденности. Наиболее выражены проявления лактатацидоза и гипогликемии: малыши вялые, сонливые, плохо сосут грудь или соску бутылочки, часто плачут, подолгу не успокаиваются. Сон беспокойный, с частыми пробуждениями, режим дня и ночи не устанавливается, кровяное давление сниженное. Могут отмечаться непроизвольные мышечные подергивания на руках, ногах, веках. К 3 месяцам развиваются судороги. Все эти симптомы более заметны у детей, находящихся на искусственном вскармливании и получающих питание «по часам», а не по требованию. При частых кормлениях глюкоза поступает в организм практически непрерывно, гипогликемия слабовыраженная.
Причины лактатацидоза
Молочнокислый ацидоз может быть вызван усилением производства лактата, его недостаточным выведением через почечные канальцы и/или нарушениями обмена в печени, при которых страдают процессы распада пирувата, образования глюкозы из неуглеводных соединений. Причинами возникновения этих метаболических сдвигов являются:
При избыточном потреблении пищевых сахаров в печени образуется большое количество ацетил-КоА, диоксиацетонфосфата и НАДФН. В результате развиваются атеросклероз и ожирение. В каких процессах используются данные метаболиты?
· В синтезе триацилглицеролов и холестерола
Биосинтез холестерина, кап и всех изопреноидов, начинается с ацетил-КоА. Углеродный скелет С27-стерина строится из С2-звеньев в длинной и сложной последовательности реакций. Биосинтез холестерина можно разделить на четыре этапа. На первом этапе (1) из трех молекул ацетил-КоА образуется мевалонат (С6). На втором этапе (2) мевалонат превращается в «активный изопрен», изопентенилдифосфат. На третьем этапе (3) шесть молекул изопрена полимеризуются с образованием сквалена (С30). Наконец, сквален циклизуется с отщеплением трех атомов углерода и превращается в холестерин (4). На схеме представлены только наиболее важные промежуточные продукты биосинтеза.
Описанный путь биосинтеза локализован в гладком ЭР. Синтез идет за счет энергии, освобождающейся при расщеплении производных кофермента А и энергетически богатых фосфатов. Восстановителем при образовании мевалоната и сквалена, а также на последних стадиях биосинтеза холестерина является НАДФН + Η+. Для этого пути характерно то, что промежуточные метаболиты можно подразделить на три группы: производные кофермента А, дифосфаты и высоко липофильные соединения (от сквалена до холестерина), связанные с переносчиками стеринов. 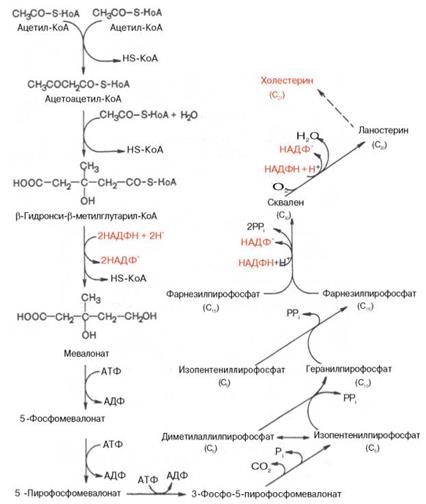
Триацилглицеролы, образующиеся в печени, являются непосредственными предшественниками триацилглицеролов, входящих в состав ЛПОНП. В реакциях биосинтеза можно выделить следующие события:
1. Образование глицерол-3-фосфата через диоксиацетонфосфат из глюкозы или при фосфорилировании свободного глицерола.
2. Биосинтез фосфатидной кислоты — требует наличия глицерол-3-фосфата и жирных кислот. При связывании глицерол-3-фосфата с жирными кислотами синтезируется фосфатидная кислота. Далее фосфатидная кислота может превращаться двумя путями — в ЦДФ-ДАГ или дефосфорилироваться до 1,2-ДАГ.
3. Синтез триацилглицерола — идет из 1,2-ДАГ после дефосфорилирования фосфатидной кислоты. Образованный 1,2-ДАГ ацилируется до ТАГ.
В отличие от других макромолекул образование триацилглицеролов зависит только от наличия субстрата и больше никак не регулируется. Отсутствие тормозящего влияния продукта реакции позволяет жировой клетке накапливать жиры практически в любых количествах.
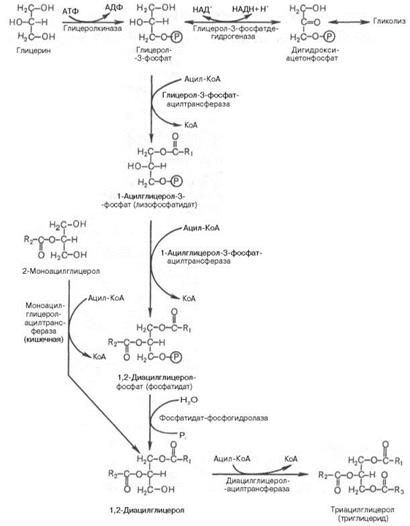
Синтез ТАГ увеличивается при соблюдении хотя бы одного из следующих условий, которые обеспечивают появление избытка ацетил-SКоА:
1. наличие источника «дешевой» энергии. Например,
· диета богатая простыми углеводами (глюкоза, сахароза). При этом концентрация глюкозы в печени и адипоцитах после еды резко повышается, она окисляется до ацетил-SКоА и под влиянием инсулина в этих органах активно происходит синтез жиров;
· наличие этанола, высокоэнергетичного соединения, который окисляется до ацетил-SКоА. «Алкогольный» ацетил используется в печени для синтеза жира при условии нормального питания. Примером может служить «пивное ожирение».
2. повышение концентрации жирных кислот в крови. Например, при усиленном липолизе в жировых клетках под воздействием каких-либо веществ (фармпрепараты, кофеин и т. п.), при эмоциональном стрессе и отсутствии (!) мышечной активности увеличивается поток жирных кислот в гепатоциты. Здесь в результате происходит интенсивный синтез ТАГ.
3. высокие концентрации инсулина и низкие концентрации глюкагона — после приема высокоуглеводной и жирной пищи.
Причиной стенокардии является ишемия и гипоксия миокарда. При этом заболевании для более экономного расхода кислорода в сердечной мышце назначают милдронат – ингибитор синтеза карнитина. Скорость какого биохимического процесса при этом снижается?
β-Окисления жирных кислот
Ишемия миокарда (ИМ) представляет собой метаболическое повреждение, характеризующееся нарушением ионного гомеостаза, прогрессирующим снижением содержания высокоэнергетических фосфатов, накоплением потенциально токсических продуктов метаболизма, таких как лактат, ионы Н+, свободные кислородные радикалы, а также ионов натрия и кальция, что приводит к морфологическому повреждению и в конечном итоге к гибели клетки.
Для адекватного поддержания сократительной функции миокард нуждается в постоянном надежном и достаточном снабжении энергией. В основе энергообеспечения миокарда лежит окислительное фосфорилирование двух основных субстратов: свободных жирных кислот (СЖК) и глюкозы. Кроме того, в качестве источников образования энергии в кардиомиоцитах (КМЦ) могут быть использованы лактат, кетоновые тела, аминокислоты.
СЖК проникают через клеточную мембрану, причем скорость их захвата КМЦ определяется прежде всего концентрацией в крови, которая может значительно варьировать в пределах от 0,1 до 1,5 ммоль/л.
При попадании в цитозоль СЖК частично эстерифицируются с формированием триглицеридов, которые депонируются внутри клетки или ацилируются и превращаются в активную форму – ацил-коэнзим А (ацил-КоА). Для этого нужны две богатые энергией ангидридные связи АТФ
Транспортировка жирных кислот уже ацил-коэнзим А через плотную митохондриальную мембрану осуществляется посредством карнитина. В наружной мембране митохондрий находится фермент карнитинацилтрансфераза I (карнитин-пальмитоилтрансфераза I, CPT1, КФ2.3.1.21), катализирующий реакцию с образованием ацилкарнитина (ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина (карнитин-СOR)), который диффундирует через внутреннюю митохондриальную мембрану:
R-CO~SКоА + карнитин ↔ карнитин-COR + КоА-SH
Образовавшийся ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью фермента карнитин-ацилкарнитин-транслоказы (CACT).
После прохождения ацилкарнитина (карнитин-СOR) через мембрану митохондрии происходит обратная реакция — расщепление ацилкарнитина при участии Кофермента А (КоА-SH) и фермента митохондриальной карнитинацил-КоА-трансферазы или карнитинацилтрансферазы II (карнитин-пальмитоилтрансфераза II, CPT2, КФ 2.3.1.21):
КоА-SH + карнитин-COR ↔ R-CO~SКоА + карнитин
Таким образом, ацил-КоА становится доступным для ферментов β-окисления. Свободный карнитин возвращается на цитоплазматическую сторону внутренней мембраны митохондрии той же транслоказой
Глюкоза проникает через клеточную мембрану КМЦ с помощью специального белка-переносчика – GLUT4. В цитозоле КМЦ глюкоза и лактат в процессе анаэробного гликолиза превращаются в пируват. При этом из одной молекулы глюкозы образуются 4 молекулы аденозинтрифосфата (АТФ), однако 2 из них расходуются в процессе реакции. Поэтому анаэробный гликолиз может обеспечить не более 2% общего количества АТФ, в норме потребляемого миокардом.
Пируват, синтезирующийся из глюкозы и лактата в цитозоле, поступает в митохондрии, где при участии фермента пируватдегидрогеназы превращается в ацетил-КоА, который составляет общий пул с ацетил-КоА, образующимся из СЖК. Далее ацетил-КоА поступает в цикл Кребса, где окисляется с участием кислорода до CO2 с образованием АТФ.
АТФ с помощью фермента-переносчика адениннуклеотидтранслоказы перемещается из митохондрий в цитозоль, где используется в различных метаболических реакциях [33].
Продукты β-окисления СЖК – восстановленный никотинамидадениндинуклеотид (НАД·Н) и ацетил-КоА являются естественными ингибиторами пируватдегидрогеназы и соответственно препятствуют окислению глюкозы. Поэтому при возрастании содержания СЖК в плазме и их усиленном поступлении в КМЦ параллельно со снижением активности упомянутого фермента уменьшается утилизация глюкозы миокардом.00
В условиях нормального кровоснабжения миокарда основным источником его энергообеспечения является утилизация СЖК. При этом образуется 80-90% всего АТФ, потребляемого сердечной мышцей. Данный факт обусловлен тем, что утилизация СЖК дает максимальный выход энергии на единицу субстрата. Так, при полном окислении одной молекулы пальмитиновой кислоты образуется 134, а стеариновой – 147 молекул АТФ, в то время как при аэробном окислении одной молекулы глюкозы – 32 молекулы АТФ, а при анаэробном гликолизе – только 2 [27]. Хотя при использовании СЖК как субстрата эффективность энергообеспечения миокарда на 30% больше, чем при использовании глюкозы, однако утилизация СЖК сопряжена с более высоким потреблением кислорода, в связи с чем при ишемии предпочтительным субстратом окисления становится глюкоза.
В результате дефицита кислорода в КМЦ происходит накопление промежуточных продуктов обмена СЖК – ацилкарнитина, ацил-КоА, НАД·Н, угнетается пируватдегидрогеназа, соответственно устраняется возможность утилизации пирувата, в результате чего он практически полностью превращается в лактат. Лактат накапливается в цитозоле вместе с Н+, что приводит к снижению внутриклеточного рН и нарушению функции КМЦ. Помимо этого, промежуточные продукты обмена СЖК угнетают адениннуклеотидтранслоказу митохондрий и затрудняют перенос макроэргических фосфатов через их мембрану, содействуя снижению энергодефицита КМЦ и дальнейшей активации гликолиза. Выраженность этих процессов увеличивается по мере возрастания тяжести ИМ, что способствует возникновению тяжелого ацидоза, который сочетается с развитием вначале функциональных нарушений, а затем и с гибелью клеток миокарда вследствие повреждения клеточных мембран.
Кроме того, СЖК обладают аритмогенным действием и способствуют возникновению фибрилляции желудочков.
Таким образом, вследствие снижения коронарного кровотока нарушается процесс образования энергии в миокарде и ее запасы уменьшаются. Аэробный метаболизм прекращается при падении коронарного кровотока ниже 0,56 мл/мин/кг [19]. При усугублении ИМ основным механизмом синтеза АТФ становится анаэробный гликолиз с образованием АТФ и лактата. Формирующийся тканевый лактатацидоз вызывает разобщение окислительного фосфорилирования и перегрузку КМЦ ионами кальция [18], активирует фосфолипазу А2 с последующим инициированием процессов перекисного окисления липидов и повреждением мембранных структур [3, 35]. При отсутствии ранней реперфузии вначале обратимые нарушения метаболизма неизбежно приобретают необратимый характер и приводят к гибели клеток .
Предупредить вредное влияние СЖК при ишемии помогают парциальные ингибиторы окисления жирных кислот (partial fatty acid oxidation inhibitors — p–FOX), снижающие окисление жирных кислот до определенного уровня Представители этой группы препаратов либо тормозят скорость окисления жирных кислот внутри митохондрий (карнитин, триметазидин, ранолазин), либо ограничивают их транспорт в митохондрии. К последним принадлежит оригинальный препарат Милдронат® (мельдоний) производства АО «Гриндекс» (Латвия).
Благодаря этому организм использует другой источник энергии - сжигает глюкозу. Этот путь экономит 12-13% кислорода на каждую произведенную молекулу АТФ. В связи с увеличением потребности в глюкозе увеличивается ее синтез в печени (глюконеогенез), вследствие чего здесь активизируется сжигание жиров (липолиз).
Общий белок
В сыворотке здоровых людей содержится 65–78 г/л общего белка. Это на 2–4 г/л меньше, чем в плазме крови – из-за отсутствия фибриногена. Общее количество белка может понижаться, и тогда врачи говорят о гипопротеинемии, которая наблюдается при:
· недостаточном поступлении белка в организм;
· повышенной потере белка;
· нарушении образования белка.
Альбумины
Благодаря различиям белков по аминокислотному составу и физико-химическим свойствам их можно разделить на отдельные фракции. Точнее всего такое разделение получается методом электрофореза.
У здоровых людей содержание альбумина составляет 56,5–66,8 %, б1-глобулина 3,5–6,0 %, б2-глобулина 6,9–10,5 %, в-глобулина 7,3–12,5 %, г-глобулина 12,8–19,0 %.
Показания к использования этого анализа для диагностики патологических процессов:
• острые и хронические воспаления;
• заболевания печени;
• злокачественные образования;
• парапротеинемии;
• нефротический синдром;
• нарушение обмена липидов;
• недостаток антител.
Остаточный азот
Процесс синтеза или распада белков является основным компонентом азотистого обмена в организме и также влияет на состав сыворотки крови. Для оценки состояния азотистого обмена в сыворотке определяют фракции остаточного азота. Это так называемый небелковый азот, который остается в центрифугате сыворотки крови после осаждения белков соответствующими реактивами. В его состав входит ряд азотсодержащих веществ (мочевина, аминоазот (азот аминокислот), мочевая кислота, креатинин, индикан и др.). О методах исследования этих веществ будет рассказано ниже.
В норме содержание остаточного азота колеблется в пределах 0,2–0,4 г/л. Увеличение концентрации остаточного азота больше 0,4–0,5 г/л называется азотемией и считается признаком того, что азотистые шлаки либо задерживаются в крови (из-за нарушения работы почек), либо вырабатываются с повышенной скоростью (внепочечная азотемия).
С-реактивный белок (СРБ)
С-реактивный белок, или СРБ – очень чувствительный элемент крови, быстрее других реагирующий на повреждения тканей. Наличие реактивного белка в сыворотке крови – признак воспалительного процесса, травмы, проникновения в организм чужеродных микроорганизмов – бактерий, паразитов, грибов. С-реактивный белок стимулирует защитные реакции, активизирует иммунитет.
Содержание СРБ в сыворотке крови до 0,5 мг/л считается нормой. Уже через 4–6 часов после того, как в организм проникает инфекция, развивается воспалительный процесс, который может сопровождаться отеками, а уровень СРБ начинает быстро расти. Чем острее воспалительный процесс, активнее заболевание, тем выше С-реактивный белок в сыворотке крови. Когда заболевание в хронической форме переходит в фазу ремиссии, то содержание С-реактивного белка в крови практически не обнаруживается. Когда наступает обострение, СРБ снова начинает расти. Определение СРБ используется для диагностики острых инфекционных заболеваний и опухолей. Также анализ СРБ используется для контроля над процессом лечения, эффективностью антибактериальной терапии и т. д. Биохимический анализ крови СРБ может показать рост С-реактивного белка в крови в следующих случаях:
• ревматические заболевания;
• заболевания желудочно-кишечного тракта;
• рак;
• инфаркт миокарда;
• сепсис новорожденных;
• туберкулез;
• менингит;
• послеоперационные осложнения.
Повышение СРБ происходит при приеме эстрогенов и оральных контрацептивов.
Гомоцистеин
В процессе формирования атеросклероза состояние сосудистой стенки играет не меньшую роль, чем нарушения липидного обмена. Среди факторов, повреждающих стенки сосудов, в последнее время особое внимание привлекает гомоцистеин – промежуточный продукт обмена незаменимой аминокислоты метионина. В норме гомоцистеин живет в организме очень недолго и под действием ферментов с длинными названиями превращается обратно в метионин или в следующий продукт обмена, цистатионин. Различные нарушения в организме приводят к тому, что гомоцистеин в нем накапливается и вызывает ряд патологических эффектов, в частности – поражает внутреннюю стенку артерий. В результате образуются разрывы эндотелия (внутреннего слоя сосудистой стенки), которые организм пытается заживить. Для этого он и использует холестерин и другие липиды. Возможно, образование атеросклеротических бляшек – это патологическое развитие защитной реакции, направленной на устранение дефекта в стенке сосуда, и холестерин здесь не причина, а следствие, или даже защитник целостности стенок наших сосудов. Работа ферментов, участвующих в биохимических превращениях гомоцистеина, невозможна без кофакторов («помощников») – витаминов B6, B12 и B9 (фолиевой кислоты). В этом кроется возможный подход к профилактике и лечению атеросклероза с помощью витаминов группы B, прежде всего – фолиевой кислоты. Гомоцистеиновая теория весьма убедительно объясняет причины возникновения атеросклероза. Но пока холестериновая теория остается общепринятой, врачи и пациенты вопреки фактам, здравому смыслу и биохимии организма насмерть (в прямом смысле этого слова) бьются с веществом, без которого жизнь просто невозможна.
Норма гомоцистеина составляет 5–15 мкмоль/л. При концентрации гомоцистеина в плазме крови 15–30 мкмоль/л определяется умеренная степень гомоцистеинемии, 30–100 мкмоль/л – средняя, более 100 – тяжелая. Умеренная гомоцистеинемия в возрасте до 40 лет, как правило, протекает бессимптомно, однако изменения в коронарных и мозговых артериях уже происходят. Повышение гомоцистеина на 5 мкмоль/л увеличивает риск атеросклеротического повреждения сосудов сердца на 80 % у женщин и на 60 % у мужчин.
Для максимально правильного расчета риска сосудистых осложнений необходимо применять схему: гомоцистеин + фибриноген + С-реактивный белок + расширенный комплекс исследования липидного обмена (триглицериды, холестерин ЛПВП, ЛПНП, ЛПОНП, аполипротеин-А и В, индекс атерогенности).
Общий белок
Суммарная концентрация белков сыворотки крови, она складывается в основном из концентрации 2-х основных белковых фракций: альбуминов и глобулинов. Белки участвуют в поддержании pHи осмотического давления крови, в реакциях свертывания и иммунитета (иммуноглобулины, белки острой фазы), а также переносят липиды, билирубин, стероидные гормоны в органы и ткани (транспортные белки). Величина концентрации общего белка – важный диагностический параметр для многих заболеваний, особенно связанных с нарушениями метаболизма.
Норма: 64–84 г/л.
Повышение концентрации может говорить об инфекционном заболевании, аутоиммунных заболеваниях (ревматоидный артрит, ревматизм, системная красная волчанка) или онкологическом заболевании. Также она повышается при дегидратации, то есть потере воды (длительный понос, особенно у детей, упорная рвота, обширные ожоги).
Снижение концентрации может происходить из-за недостаточного поступления белка с пищей, при болезнях печени, кишечника, почек или онкологических заболеваниях, тиреотоксикозе, а также вследствие длительных физических нагрузок.
Глюкоза
Важнейший компонент крови, основной участник углеводного обмена. Больше половины энергии наш организм получает в реакциях окисления глюкозы. Глюкоза поступает в наш организм с пищей, образуется в клетках организма из аминокислот и лактата, избыток глюкозы откладывается организмом «про запас» в печени в виде гликогена. Определяют концентрацию глюкозы в крови, в первую очередь, для диагностики сахарного диабета 1 и 2 типов. Рекомендуется проводить это исследование (даже если нет никаких симптомов) всем людям старше 45 лет, потому что изменение уровня глюкозы происходит за несколько лет до того, как появятся клинические признаки диабета. Измерение концентрации глюкозы также имеет большое значение в диагностике болезней щитовидной железы, надпочечников, гипофиза, а также у пациентов с ожирением и у беременных.
Норма: 3,30–5,50 ммоль/л.
Повышение концентрации глюкозы наблюдается при диабете 1 или 2 типа, при нарушении толерантности к глюкозе, гормональных нарушениях, остром или хроническом панкреатите, хронических заболеваниях печени и почек.
Понижение концентрации происходит при опухолях поджелудочной железы, некоторых эндокринных заболеваниях, тяжелых поражениях печени (цирроз, опухоли) и др.
Мочевина
Основной продукт распада белков, ее содержание в крови зависит от характера питания (преобладание мясной пищи приводит к его увеличению, растительной – уменьшению), возраста (увеличивается у пожилых людей).
Норма: 2,5–8,3 ммоль/л.
Повышение концентрации мочевины в сыворотке крови может быть следствием плохой работы почек, сердечной недостаточности, опухолевого процесса, кровотечения, кишечной непроходимости или непроходимости мочевыводящих путей. Краткосрочное повышение содержания мочевины может возникать после интенсивных тренировок или физических нагрузок.
Снижение концентрации наблюдается при заболеваниях печени (нарушается синтез мочевины); нарушении всасывания в кишечнике, при беременности.
Креатинин
Креатинин – это конечный продукт метаболизма креатинфосфата, участвующего в энергетическом обмене мышц и других тканей. Выделяется почками, поэтому его концентрация является показателем работы почек.
Норма (зависит от мышечной массы): мужчины – 62–115 мкмоль/л, женщины – 53–97 мкмоль/л.
Повышение концентрации, как правило, указывает на почечную недостаточность или гипертиреоз, также наблюдается при массивном повреждении мышечной ткани (травма, операции, синдром длительного сдавливания).
Снижение концентрации креатинина происходит при голодании, значительном снижении мышечной массы, во время 1 и 2 триместра беременности.
Билирубин
Желто-красный пигмент, один из основных компонентов желчи, в сыворотке крови присутствует в виде двух фракций: прямого (связанного с белками, или конъюгированного) и непрямого (свободного, или несвязанного) билирубина, которые вместе составляют общий билирубин.В сыворотке крои, как правило, определяют концентрацию общего и прямого билирубина, разница между этими показателями составляет величину свободного (неконъюгированного, непрямого) билирубина. Определение этого показателя имеет большое значение для дифференциальной диагностики желтух различного происхождения.
Норма (общий билирубин): 5–-20 мкмоль/л. При повышении его концентрации до значений выше 27 мкмоль/л возникает желтуха.
Повышение концентрации общего билирубина происходит при заболеваниях печени (рак, гепатит, отравления, цирроз), желчекаменной болезни, холестазе, а также на фоне гемолитических анемий, недостатка витамина В12.
Липаза
Фермент, расщепляющий нейтральные жиры (триглицериды) в тонком кишечнике. При воспалении поджелудочной железы – пакреатите этот фермент попадает в кровь, поэтому определение активности липазы в сыворотке крови играет важную роль в диагностике этого заболевания. Одновременное определение липазы и еще одного фермента – амилазы позволяет диагностировать поражение поджелудочной железы в 98% случаев.
Норма: 0–190 Ед/л.
Увеличение активности липазы в крови указывает на заболевание поджелудочной железы. Также его активность повышается при болезнях желчевыводящих путей, серьезном повреждении кишечника, перитоните, ожирении, сахарном диабете.
Уменьшение активности происходит на фоне избытка триглицеридов (неправильное питание или наследственные болезни), а также при онкологических заболеваниях (кроме рака поджелудочной железы).
Амилаза
Фермент, расщепляющий углеводы пищи. Содержится в слюнных железах и поджелудочной железе. Существует в двух изоформах: альфа-амилаза (диастаза) и панкреатическая амилаза.
Норма: (альфа-амилаза) – 28–100 Ед/л, панкреатическая амилаза – 0–50 Ед/л.
Повышение активности амилазы в сыворотке крови указывает на: перитонит, панкреатит, сахарный диабет, кисту поджелудочной железы, холецистит, почечную недостаточность и некоторые другие заболевания.
Снижение активности амилазы (величина, близкая к нулю) происходит при недостаточности функции поджелудочной железы, панкреонекрозе, хирургическом удалении поджелудочной железы, остром и хроническом гепатите, токсикозе беременных, муковисцидозе.
При обследовании работников объединения «Химчистка» у одной работницы было обнаружено увеличение активности аланинамино- трансферазы (АЛТ) в крови в 5,7 раза, а аспартатаминотрансферазы (АСТ) – в 1,5 раза. Врач-практикант А предположил, что это - следствие увеличенного потребления мясных продуктов накануне, и причин для беспокойства нет. Врач-практикант Б предложил госпитализировать эту работницу, предполагая у нее поражение печени органическими растворителями. Кто из них прав и почему?
Аланин-аминотрансфераза (АлАт) — это фермент, повышение которого в крови может указывать на повреждения печени. Соотношение показателей АлАт и АсАт (аспартат-аминотрансферазы) дает возможность провести дифференциальную диагностику различных заболеваний внутренних органов.
АЛАТ Фермент присутствует во всех клетках организма, но наибольшая его концентрация отмечается в сердце, печени и почках. В меньшем количестве он локализован в тканях селезенки, поджелудочной железы и легких. Синтезируясь внутри клеток, это биологически активное вещество участвует в образовании большого количества различных аминокислот. Оно задействовано в азотистом и энергетическом обменах. В крови здорового человека аланин-аминотрансфераза представлена в минимальной концентрации.
АЛТ является внутриклеточным ферментом, и его содержание в сыворотке крови здоровых людей невелико. Но при повреждении или разрушении клеток, богатых АЛТ (печень, мышца сердца и др.), происходит выброс этого фермента в кровяное русло, что приводит к повышению его активности в крови. Увеличение активности АЛТ в плазме указывает скорее на повреждение клеток, чем на нарушение функции органа. Фермент не обладает органной специфичностью, поэтому уровень его сывороточной активности не всегда коррелирует с тяжестью поражения органа. Как правило, определяют активность одновременно двух аминотрансфераз — АЛТ и АСТ. В норме соотношение АСТ/АЛТ (коэффициент де Ритиса).
Аспартатаминотрансфераза (АСТ) – это фермент, который находится во всех клетках организма, однако главным образом в сердце и печени и в меньшей степени в почках и мышцах. У здоровых пациентов активность АСТ в крови невелика и норма АСТ имеет низкие значения. При повреждении печени или мышц АСТ высвобождается, содержание АСТ в крови повышается. В связи с этим активность данного фермента является показателем повреждений печени. Анализ на АСТ входит в состав так называемых печеночных проб — исследований, диагностирующих нарушения в работе печени.
Печень является жизненно важным органом, который расположен в верхней правой части брюшной полости. Она участвует в осуществлении многих важных функций организма – помогает в переработке питательных веществ, производстве желчи, синтезе многих важных белков, таких как факторы свертывающей системы крови, а также расщепляет потенциально токсичные соединения до безопасных веществ.
Ряд заболеваний приводит к повреждению клеток печени, что способствует повышению активности АСТ.
Наиболее часто анализ на АСТ назначают, чтобы проверить, не повреждена ли печень из-за гепатита, приема токсичных препаратов, цирроза.
При подозрении на наличие серьезных повреждений печеночных тканей больному может быть назначен анализ на аланин-аминотрансферазу в совокупности с рядом других исследований: на АсАт, ЛДГ, ГГТ, билирубин и др. Так, если АсАт превышает значение АлАт, это свидетельствует о наличии у больного сердечной патологии, а если наоборот, то у специалистов есть все основания считать, что пациент страдает заболеванием печени.
Обоснуйте выбор ответа : заболевание, связаное с врожденным дефицитом глюкозо-6-фосфатазы называется 1) галактоземия 2) гликогеноз (болезнь Гирке) 3) агликогеноз 4) сахарный диабет. Дайте биохимическую характеристику заболевания
Болезнь Гирке — гликогеноз вызванная недостаточностью глюкозо-6-фосфатазы.
Недостаточность этого фермента приводит к невозможности превращения глюкозо-6-фосфата в глюкозу, что сопровождается накоплением гликогена в печени и почках.Болезнь Гирке характеризуется генетически обусловленной почти полной неспособностью клеток продуцировать глюкозо-6-фосфатазу — ключевой фермент как гликогенолиза, так и глюконеогенеза. Болезнь наследуется по аутосомно-рецессивному типу. Поступление глюкозы в организм с пищей, являющееся нормальным возмещающим процессом, в принципе даёт возможность поддерживать в крови нормальный уровень глюкозы, однако для этого поступление пищи, содержащей глюкозу, должно быть практически непрерывным. В реальных условиях существования, то есть при отсутствии непрерывного поступления глюкозы, в здоровом организме депонируется и при необходимости используется гликоген, образующийся при её полимеризации.
При болезни Гирке сохраняется способность к преобразованию глюкозы в гликоген и депонированию последнего в тканях различных органов, в основном печени. Однако теряется способность к обратному процессу при уменьшении в крови концентрации глюкозы — к обратному переходу гликогена в глюкозу. Таким образом, физиологически трансформация глюкозы в гликоген оказывается противоестественным процессом, который в конечном итоге не только не приносит организму пользу, но и является причиной дополнительных серьёзных патологических явлений.
60. У больного с острым приступом болей в животе определяется повышение в сыворотке активности амилазы. Выберите вариант наиболее вероятного диагноза: 1) острый панкреатит; 2) острый вирусный гепатит; 3) почечная колика; 4) инфаркт миокарда. Ответ обоснуйте.
Ответ: 1) острый панкреатит
Референтные величины активности а-амилазы: в сыворотке крови — 25-220 МЕ/л; в моче — 10-490 МЕ/л.
а-Амилаза относится к группе гидролаз, катализирующих гидролиз полисахаридов, включая крахмал и гликоген, до простых моно- и дисахаридов. Наиболее богаты амилазой поджелудочная и слюнные железы. Амилаза секретируется в кровь главным образом из этих органов. Плазма крови человека содержит а-амилазы двух типов: панкреатическую (Р-тип), вырабатываемую поджелудочной железой, и слюнную (S-тип), продуцируемую слюнными железами.
В физиологических условиях активность данного фермента в сыворотке крови на 40% представлена панкреатической амилазой, на 60% — слюнной амилазой.
Определение активности а-амилазы имеет важное значение в диагностике заболеваний поджелудочной железы. Повышение активности а-амилазы в сыворотке крови в 2 раза и более следует расценивать как симптом поражения поджелудочной железы. Небольшая гиперамилаземия даёт основание заподозрить патологию поджелудочной железы, но иногда возможна при заболеваниях других органов.
С мочой выделяется в основном P-тип а-амилазы, что считают одной из причин большей информативности амилазы мочи, чем сыворотки крови в плане оценки функционального состояния поджелудочной железы. Полагают, что 65% активности фермента в мочи обусловлено панкреатической амилазой. Этим объясняется то обстоятельство, что при остром панкреатите именно она увеличивается в сыворотке крови (до 89%) и особенно в моче (до 92%), без изменений показателей амилазы слюнных желёз.
При остром панкреатите активность амилазы крови и мочи увеличивается в 10-30 раз. Гиперамилаземия наступает в начале заболевания (уже через 4-6 ч), достигает максимума через 12-24 ч, затем быстро снижается и приходит к норме на 2-6-й день. Уровень повышения активности сывороточной амилазы не коррелирует с тяжестью панкреатита.
Активность амилазы в моче начинает повышаться через 6-10 ч после острого приступа панкреатита и возвращается к норме через 3 сут. В некоторых случаях активность амилазы в моче имеет две волны повышения в течение 3 сут. Диагностическая чувствительность определения амилазы в сыворотке крови для острого панкреатита составляет 95%, специфичность — 88%.
Острые панкреатиты могут протекать без повышения активности амилазы (в частности, при панкреонекрозе). В первые сутки от начала заболевания нормальный уровень активности амилазы мочи выявляют у 25% больных абортивным панкреатитом, у 20% — жировым, у 10% — геморрагическим. Более точную информацию получают при исследовании активности амилазы в суточном объёме мочи. Важное, а в ряде случаев и решающее значение для распознавания рецидивирующей формы острого панкреатита имеет повторное повышение активности амилазы крови и мочи во время повторяющихся рецидивов болевого синдрома. При различных формах острого панкреатита динамика повышения а-амилазы в крови и моче носит различный характер. Так, для отёчного панкреатита характерна кратковременная амилаземия на 1-3-и сутки заболевания; для жирового панкреонекроза — высокая и длительная амилаземия, а для геморрагического панкреонекроза — кратковременная гиперамилаземия на 3-и сутки заболевания. Патогенетически гиперамилаземия развивается в результате блокады отёчной интерстициальной тканью выводных протоков поджелудочной железы и наиболее характерна для жирового панкрео-некроза. При геморрагическом панкреонекрозе отмечают резкое повышение активности а-амилазы в крови с последующим быстрым её снижением, что отражает прогрессирование некроза.
Гиперамилаземия и гиперамилазурия — важные, но не специфические для острого панкреатита признаки; кроме того, повышение их активности может быть кратковременным. Для повышения информативности полученных результатов исследования полезно определение активности амилазы крови и мочи сочетать с параллельным определением концентрации креатинина в моче и сыворотке крови. На основании этих данных рассчитывают индекс амилазо-креатининового клиренса. В норме амилазо-креатининовый индекс не более 3, его повышение считают признаком панкреатита, так как при панкреатите повышается уровень истинно панкреатической амилазы, и её клиренс осуществляется на 80% быстрее клиренса амилазы слюны. Тем не менее установлено, что при остром панкреатите значительно увеличивается клиренс и P-, и S-амилазы, что объясняют следующим образом. У здоровых людей амилаза сыворотки вначале фильтруется в почечных клубочках, а затем реабсорбируется канальцевым эпителием. При остром панкреатите механизм канальцевой реабсорбции подавляется вследствие избыточной экскреции Р- и S-амилазы. Поскольку амилазная активность сыворотки при остром панкреатите обусловлена, в основном, Р-амилазой, то при повышении клиренса общей амилазы повышается клиренс Р-ами-лазы. При остром панкреатите активность амилазы сыворотки и показатель амилазо-креатининового клиренса обычно повышены за счёт подавления почечного механизма канальцевой реабсорбции амилазы. При заболеваниях, протекающих под маской панкреатита, активность амилазы сыворотки может увеличиваться, но показатель амилазо-креатининового клиренса остаётся нормальным, так как отсутствует канальцевый дефект. Очень важно для этого исследования проводить забор крови и мочи в одно и то же время.
Обоснуйте применение в энзимодиагностике секреторных, экскреторных и индикаторных ферментов.
Ферменты (энзимы) – это специфические белки, которые исполняют в организме роль биологических катализаторов и обеспечивают нормальное протекание всех химических реакций в организме. Ферменты содержатся во всех клетках организма, где их концентрация значительно выше, чем в плазме крови. Наиболее часто в качестве объекта для исследования используется сыворотка крови, ферментный состав которой относительно постоянен и имеет разнообразное происхождение. Нормальные уровни активности ферментов в сыворотке крови отражают соотношение между биосинтезом и высвобождением ферментов (при обычном обновлении клеток), а также их клиренсом из кровотока. Повышение скорости обновления ферментов, повреждения клеток или их индуцирование обычно приводят к повышению активности ферментов в сыворотке крови. В сыворотке крови выделяют три группы ферментов: клеточные, секреторные и экскреторные.
Секреторные ферменты,синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза
Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (лактатдегидрогеназа, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток «вымываются» в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей.
Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается.
Особый интерес энзимодиагностики представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутират-дегидрогеназы.
При заболеваниях печени, в частности при вирусном гепатите в сыворотке крови значительно увеличивается активность АлАТ и АсАТ, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах. Органоспецифическими ферментамидля печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствует о поражении печеночной ткани.
В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5 . Установлено, что у больных с острым инфарктом миокарда в сыворотке крови резко повышается активность изоферментов ЛДГ1 и отчасти ЛДГ2. Изоферментный спектр ЛДГ в сыворотке крови при инфаркте миокарда напоминает изоферментный спектр сердечной мышцы. Напротив, при паренхиматозном гепатите в сыворотке крови значительно возрастает активность изоферментов ЛДГ4 и ЛДГ5 и уменьшается активность ЛДГ1 и ЛДГ2.
Диагностическое значение имеет также исследование активности изоферментов креатинкиназы в сыворотке крови. Существуют по крайней мере 3 изофермента креатинкиназы: ВВ, ММ и MB. В мозговой ткани в основном присутствует изофермент ВВ (от англ. brain – мозг), в скелетной мускулатуре – ММ-форма (от англ. muscle – мышца). Сердце содержит гибридную МВ-форму, а также ММ-форму. Изоферменты креатинкиназы особенно важно исследовать при остром инфаркте миокарда, так как МВ-форма в значительном количестве содержится практически только в сердечной мышце. Повышение активности МВ-формы в сыворотке крови свидетельствует о поражении именно сердечной мышцы.
Уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэстеразы и некоторых других органоспецифических ферментов (например, гистидазы, уроканиназы, глицинамидинотрансферазы) в сыворотке крови при патологии костной ткани, печени, метастатических карциномах
Возрастание активности ферментов сыворотки крови при многих патологических процессах объясняется: выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося их биосинтеза в поврежденных тканях; одновременным повышением каталитической активности некоторых ферментов, переходящих в кровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществ связано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов.
Повышение уровня внутриклеточных ферментов в плазме крови прямо зависит от природы повреждающего воздействия, времени действия и степени повреждения биомембран клеток и субклеточных структур органов. В оценке ферментных тестов для диагностических целей особое значение имеет знание периода полужизни (полураспада) в плазме крови каждого из диагностических ферментов, что делает важным выбор точного времени для ферментного анализа крови. Весьма существенным является также знание особенностей распределения ферментов в индивидуальных органах и тканях, а также их внутриклеточной локализации.
Дата: 2019-05-28, просмотров: 599.