Геномика микроорганизмов имеет прямое отношение к клинической медицине. Закономерности геномной организации патогенных бактерий и вирусов позволяют лучше понять природу инфекционного процесса, определить направление создания вакцин, уточнить патогенные мишени микроорганизмов для создания лекарств.
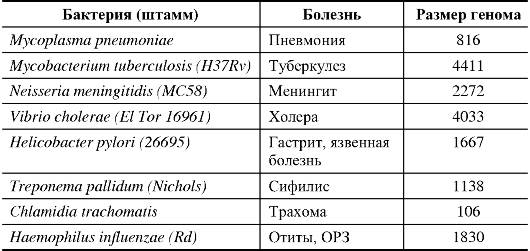
Секвенирование генома бактерий началось в конце 80-х годов XX века, когда уже были методические предпосылки для этого. Первым секвенированным бактериальным геномом стал геном Mycoplasma genitalium (1995). За последние 8 лет список полностью секвенированных геномов бактерий увеличился до 40 видов, среди которых представители Streptococcus, Staphylococcus, Corynebacterium, Yersinia и др. В табл. 1.9 представлены некоторые примеры расшифрованных геномов бактерий.
Как показали геномные исследования, патогенные бактерии весьма разнообразны по комбинаторике генов, определяющих патогенность. У них имеются специфические гены, контролирующие синтез факторов вирулентности (адгезины, инвазины, порины, токсины, гемолизины). Большинство таких генов собрано в кластеры («островки патогенности»). Они могут быть локализованы в хромосоме бактерии или в плазмидах. «Островки патогенности» участвуют в
Таблица 1.9. Перечень патогенных бактерий, геномы которых секвенированы
 геномных перестройках, что и определяет приспособляемость и широкую внутривидовую вариабельность бактерий.
геномных перестройках, что и определяет приспособляемость и широкую внутривидовую вариабельность бактерий.
Поскольку геномы бактерий небольшие (от 100 000 до 4 млн п.н.), многое удалось уже сделать в области функциональной геномики; и структурные, и функциональные исследования геномов патогенных бактерий показывают их высокую пластичность. Эти представления имеют практическое значение, во-первых, для разработки экспресс-методов типирования бактерий и оценки риска бактериальной контаминации; во-вторых, для создания лекарств, нацеленных на специфические мишени, блокирующие работу генов патогенности; в-третьих, для более целенаправленного создания вакцин.
Что касается геномики вирусов, то у большинства патогенных для человека вирусов (возбудителей вирусных гепатитов, ВИЧ и СПИДа, герпес-вирусных инфекций, натуральной оспы, гриппа и др.) уже известна первичная нуклеотидная последовательность полноразмерного генома (структурная геномика). Более того, накоплено много данных по функциональной геномике (роль отдельных фрагментов в формировании вторичной структуры генома, в образовании белков вирионов, в репликации и сборке вирионов). Геномные исследования вирусов позволили объяснить их высокую пластичность (способность к рекомбинации, наличие гипервариабельных областей). Многие вирусы формируют длительную персистентную инфекцию, в результате которой происходит селекция новых вариантов вируса с измененной первичной последовательностью и в результате с измененными патогенными и антигенными свойствами.
Несмотря на интенсивные поиски участков в геномах вирусов (сайтов), ответственных за патогенные свойства вирусов, они до сих пор не обнаружены, т.е. функциональная геномика вирусов еще не достигла такого уровня, как структурная. Результаты исследований позволяют с большой вероятностью думать о том, что патогенные свойства вирусов являются полифункциональным признаком, детерминируемым многими сайтами генома.
Практическое приложение сведений о нуклеотидной последовательности геномов многих патогенных вирусов уже широко реализуется. Генно-инженерным путем создаются непатогенные фрагменты геномов вирусов в составе плазмидных векторов. Такие векторы с вирусом способны к экспрессии в высоких концентрациях белков вирусов, которые необходимы для приготовления диагностических и вакцинных препаратов. Развивается технология
получения ДНК-вакцин против СПИДа, гепатита С и других вирусных инфекций. Создана эффективная рекомбинантная вакцина против гепатита В.
Как и в геномике патогенных бактерий, сведения о функциональных свойствах отдельных участков геномов вирусов служат основой для молекулярного дизайна лекарственных средств, эффективно подавляющих размножение вируса в клетке.
Заключение
Последние 15 лет интенсивного развития геномики человека обеспечили новый этап в развитии медицины и переход ее на молекулярный уровень. Геномика человека является основой молекулярной медицины. Резкое увеличение геномной информации стало началом переосмысления процессов развития человека и его болезней. Развитие патологии прослеживается на молекулярном уровне от первичного продукта гена до исхода заболевания.
Полные данные по нуклеотидной последовательности генома ускоряют генетический анализ человека. В связи с этим изменяются направления биомедицинских исследований.
1. В предыдущие годы основное внимание в изучении наследственности человека было сосредоточено на структурной геномике (секвенировании генома). Теперь исследования направлены на функциональную геномику (межгенные сети, протеомика).
2. С середины 80-х годов XX века обнаружение генов (их идентификация вплоть до нуклеотидной последовательности) осуществлялось главным образом через картирование генов (метод позиционного клонирования). Сведения по геному человека позволяют обнаруживать гены на уровне нуклеотидных последовательностей быстрее и точнее.
3. До последнего времени акцент в изучении наследственной патологии был на моногенных болезнях и на анализе одного гена. Теперь он сдвигается в сторону мультифакториальных болезней, анализа множественных генов и мониторинга предрасположенности.
4. Изучение действия гена (первичных продуктов) всегда считалось высшим пилотажем в генетике, но теперь исследования должны больше концентрироваться на механизмах регуляции действия гена.
5. С точки зрения общей патологии достижения геномики направляют мысль от изучения этиологии наследственных болезней (специфические мутации) к их патогенезу (механизмы формирования патологического фенотипа).
При обсуждении значимости секвенирования генома человека нередко звучат необоснованные обещания. В науке (например, в онкологии) не раз вполне объективно прогнозируемые результаты разработок не сбывались, потому что проблема (явление, болезнь) оказывалась сложнее и прямая экстраполяция прогресса не оправдывалась. Знание генома человека, несомненно, приведет к прогрессу во многих (если не во всех) разделах медицины, но маловероятно, что это единственное направление развития медицины.
Исходя из уже применяемых в практическом здравоохранении достижений генетики, можно прогнозировать следующие перспективы использования результатов геномных исследований:
• широкое применение генодиагностики наследственных болезней, в том числе пренатальной;
• техническая доступность предымплантационной диагностики в основных медико-генетических центрах;
• генетическое тестирование на болезни с наследственной предрасположенностью и принятие профилактических мер;
• новые подходы и методы лечения, в том числе генная терапия отдельных заболеваний;
• создание новых типов лекарств на основе геномной информации (фармакогеномика).
Накопление генетической информации будет проверяться медициной в широком плане и использоваться здравоохранением для разных контингентов населения. Новорожденных будут обследовать на болезни, беременных - на патологию плода. Уже есть предпосылки для выявления детей с высоким риском раннего атеросклероза, чтобы начать их лечение на ранних этапах и предупредить изменения в сосудах во взрослом состоянии. Супруги могут получить сведения о своем генетическом статусе в отношении наследственной болезни у ребенка до планирования деторождения. Население среднего и более старшего возраста может быть обследовано по риску многих болезней, которые удастся предупредить (или облегчить) путем диетических рекомендаций или лекарственного лечения. Проверку индивидуальной чувствительности к лекарствам можно проводить молекулярно-генетическими методами, и это должно стать стандартной процедурой перед началом лечения.
Ключевые слова и понятия
Аксиомы медицинской генетики Генетика человека
Генетические технологии в медицине Евгеника
Клиническая генетика Медицинская генетика Менделизм в генетике человека Молекулярная медицина Причины детской смертности Частота наследственной патологии
Контрольные вопросы
1. Использование концепции менделизма в генетике человека началось:
а) с середины XIX века (Г. Мендель; В.М. Флоринский; Ф. Гальтон);
б) с конца XIX века (А. Вейсман; А.А. Остроумов);
в) с начала XX века (переоткрытие законов Г. Менделя);
г) в 1910-1920 гг. (Т.Х. Морган; хромосомная теория наследственности);
д) в 1940-1950 гг. (открытие информационной роли и структуры ДНК);
е) в 1950-1960 гг. (новая эра цитогенетики человека).
2. Объектом изучения клинической генетики являются:
а) больной человек;
б) больной и больные родственники;
в) больной и все члены его семьи, в том числе и здоровые.
3. Генетические технологии в медицине и здравоохранении применяются для:
а) изучения причин клинического полиморфизма болезней;
б) создания новых вакцин;
в) диагностики наследственных и инфекционных болезней.
4. Основоположник клинической генетики в России:
а) Н.К. Кольцов;
б) А.С. Серебровский;
в) С.Н. Давиденков;
г) Н.В. Тимофеев-Ресовский;
д) Н.П. Дубинин.
5. Наследственная отягощенность человеческой популяции включает в себя:
а) накопленные в процессе эволюции патологические мутации;
б) вновь возникающие мутации в соматических клетках;
в) вновь возникающие мутации в половых клетках;
г) распространенность наследственных болезней.
6. Частота наследственных и врожденных заболеваний среди новорожденных составляет:
а) 5-5,5%;
б) 3-3,5%;
в) 9-10%;
г) 0,1-1,0%.
7. Негативная евгеника - это:
а) раздел генетики человека по изучению причин ухудшения природы человека;
б) освобождение человечества от наследственной патологии путем насильственной стерилизации;
в) улучшение природы человека путем отбора лучших представителей человечества и их предпочтительного размножения;
г) насильственное ограничение репродуктивной свободы человека.
8. Число известных клинических форм наследственных заболеваний составляет примерно:
а) до 3000;
б) 4000-4500;
в) 6000-10 000;
г) 80 000-100 000.
9. Исключите неправильные утверждения:
а) нет таких признаков, которые бы зависели только от наследственности или только от среды;
б) наследственная изменчивость, ведущая к вариациям нормальных признаков и ведущая к наследственным болезням, - два разных вида изменчивости;
в) в ближайшее время ожидается резкий рост частоты наследственной патологии вследствие увеличения мутагенной нагрузки, миграции населения и других популяционных факторов;
г) новые мутации могут закрепляться в популяции путем естественного
отбора.
10. Доля наследственных и врожденных болезней среди причин смерти детей на 1-м году жизни составляет:
а) 50%;
б) 70%;
в) 25%;
г) 5%.
Дата: 2019-05-28, просмотров: 333.