ВВЕДЕНИЕ В КЛИНИЧЕСКУЮ ГЕНЕТИКУ
Основные понятия
Генетика наряду с морфологией, физиологией и биохимией служит теоретическим фундаментом современной медицины. Наследственность лежит в основе всех жизненных проявлений. Без наследственности и изменчивости была бы невозможна эволюция жизни на Земле. Поскольку человек - продукт длительной эволюции живой природы, все общебиологические закономерности отражены в его формировании как биологического вида Человек разумный (Homo sapiens).
Генетика человека изучает явления наследственности и изменчивости на всех уровнях его организации и существования: молекулярном, клеточном, организменном, популяционном, биохорологическом, биогеохимическом. С периода зарождения (начало XX века) и особенно в период интенсивного подъема (50-е годы XX века) генетика человека развивалась не только как теоретическая, но и как клиническая дисциплина, постоянно подпитываясь как общебиологическими концепциями (эволюционное учение, онтогенез), так и генетическими открытиями (законы наследования признаков, хромосомная теория наследственности, информационная роль ДНК). В то же время на процесс становления генетики человека как науки постоянно и существенно влияли достижения теоретической и клинической медицины. Человек как биологический объект изучен детальнее, чем любой другой высокоорганизованный организм (дрозофила, мышь и др.). Изучение патологических вариаций (предмет врачебной профессии) служило основой для познания наследственности человека. В свою очередь развитие генетики человека ускоряло развитие теоретических дисциплин (например, молекулярной биологии) и клинической медицины (например, новой области в медицине - учения о хромосомных болезнях).
Взаимодействие генетики человека с фундаментальными науками и медициной отражено на рис. 1.1.
Медицинская генетика изучает роль наследственности в патологии человека, закономерности передачи от поколения к поколению наследственных болезней, разрабатывает методы диагности-
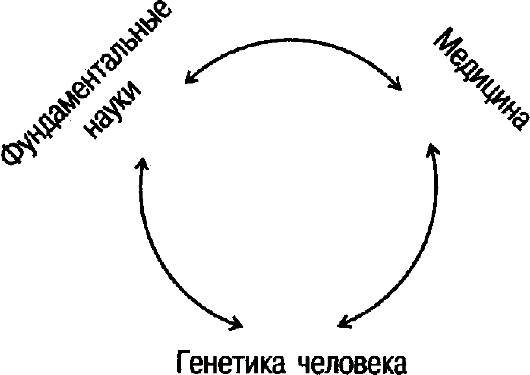 Рис. 1.1. Взаимовлияние наук.
Рис. 1.1. Взаимовлияние наук.
ки, лечения и профилактики наследственной патологии, включая болезни с наследственной предрасположенностью. Это направление синтезирует медицинские и генетические открытия и достижения, направляя их на борьбу с болезнями и улучшение здоровья людей.
Медицинская генетика, составляя важнейшую часть теоретической медицины, рассматривает в связи с патологией вопросы:
• какие наследственные механизмы поддерживают гомеостаз организма и определяют здоровье индивида;
• каково значение наследственных факторов (мутации или сочетание определенных аллелей) в этиологии болезней;
• каково соотношение наследственных и средовых факторов в патогенезе болезней;
• какова роль наследственных факторов в определении клинической картины болезней (и наследственных, и ненаследственных);
• влияет ли (и если влияет, то как) наследственная конституция на процесс выздоровления человека и исход болезни;
• как наследственность определяет специфику фармакологического и других видов лечения.
Как теоретическая и клиническая дисциплина медицинская генетика продолжает интенсивно расширяться в разных направлениях: изучение генома человека, цитогенетика, молекулярная и биохимическая генетика, иммуногенетика, генетика развития, популяционная генетика, клиническая генетика.
Образование по медицинской генетике включает основы общей генетики (менделизм, учение о хромосомах, химические основы наследственности), основные положения генетики человека (человек как объект генетического исследования) и клиническую генетику.
Клиническая генетика в строгом смысле слова - прикладной раздел медицинской генетики, т.е. применение ее достижений к клиническим проблемам у пациентов или в их семьях: какая болезнь у пациента (диагноз), как ему помочь (лечение), как предупредить рождение больного потомства (прогноз и профилактика). В настоящее время клиническая генетика основывается на геномике, ци-
тогенетике, биохимической генетике, иммуногенетике, формальной генетике, включая популяционную и эпидемиологическую, генетике соматических клеток и молекулярной генетике.
Генный уровень
Основное внимание в генетике всегда уделялось гену. Благодаря комплексному подходу к изучению генов (от фенотипа на уровне организма до расшифровки нуклеотидной последовательности) накопилась обширная информация о строении и функции генов. Под термином «ген» теперь понимают последовательность нуклеотидов в ДНК, которая обусловливает определенную функцию в организме или обеспечивает транскрипцию другого гена.
На основе данных по секвенированию определено, что в геноме человека 30 000-40 000 генов, а не 70 000-100 000, как считали ранее. Сотни генов, вероятно, получены человеком в результате горизонтальной передачи, начиная от бактерий. Более 6500 генов человека (примерно 1/6 часть генома) охарактеризованы экспериментально (по функции продукта, наличию мутаций, тканеспецифичности, размеру транскрипта). Хромосомная локализация установлена для 14 000 генов (рис. 1.9).
Гены человека более комплексные, чем у других изученных организмов (например, у дрозофилы). Благодаря альтернативному сплайсингу число синтезируемых белковых продуктов, очевидно, в 1,5- 2 раза больше, чем число генов. Явление альтернативного сплайсинга заключается в следующем. Из одного и того же первичного РНК-транскрипта в процессинге РНК в разных тканях образуется не один, а несколько разных по длине мРНК-транскриптов. Соответственно синтезированные полипептиды также будут различными. Таким образом, одна и та же ДНК-последовательность может кодировать не один, а несколько разных белковых продуктов.
Размер генов человека, число экзонов и интронов в них варьируют в широких пределах (табл. 1.5).
Большинство генов имеет размеры до 50 000 п.н. (табл. 1.6). Средняя длина участка хромосомы, приходящегося на ген, составляет 27 000 п.н. Однако есть гены, размер которых в 100 раз меньше или в 100 раз больше этой средней величины.
Как известно из менделевской генетики, различные аллели могут проявляться в доминантном, рецессивном и кодоминантном вариантах. В геноме человека это правило в отдельных случаях нарушается.
В табл. 1.7 приведены примеры то доминантного, то рецессивного проявления одних и тех же фенотипов, обусловленных различными мутациями в одном и том же гене.
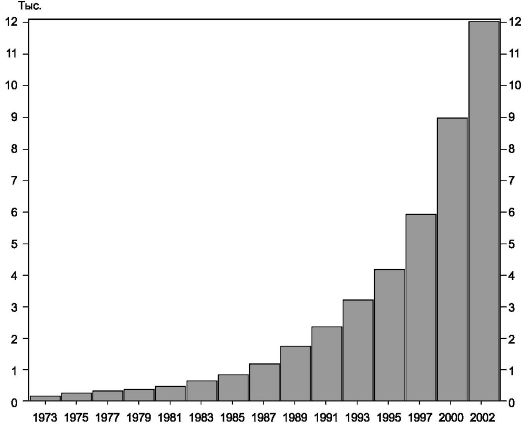 Рис. 1.9. Динамика картирования генов человека.
Рис. 1.9. Динамика картирования генов человека.
Эти данные необходимо принимать во внимание при медикогенетическом консультировании, когда родословная не будет укладываться в рамки привычных типов наследования.
Функции генов. Накопленные сведения о генах человека позволяют выделить их группы по функциям первичного продукта: ферменты; модуляторы белковой функции; рецепторы; транскрипционные факторы; белки внутриклеточного матрикса; белки внеклеточного матрикса; трансмембранные переносчики; структуры ионных каналов; молекулы клеточных сигналов; гормоны; экстраклеточные переносчики; иммуноглобулины.
Безусловно, есть еще и гены с неизвестным пока действием.
Наибольшую функциональную категорию (31,2% общего числа) составляют гены, кодирующие ферменты. В 2 раза меньше геновмодуляторов белковой функции (13,6%). Они стабилизируют, ак-
Таблица 1.5. Классификация генов человека по размеру (примеры)
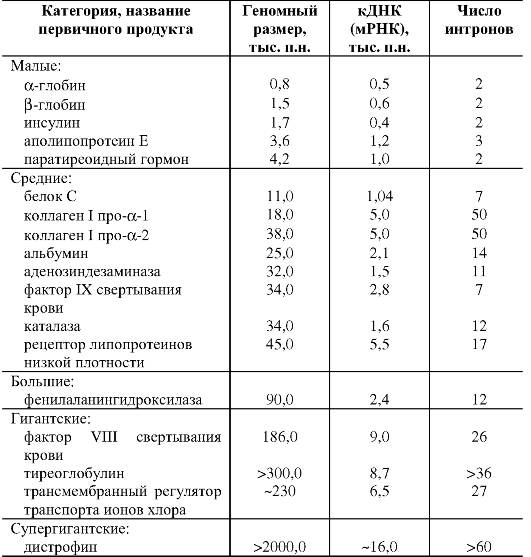 Таблица 1.6. Распределение генов человека по размеру
Таблица 1.6. Распределение генов человека по размеру
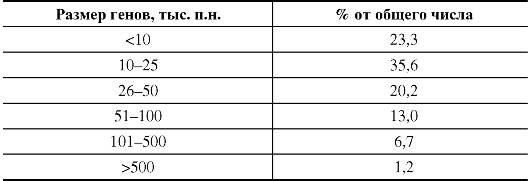 Таблица 1.7. Доминантные и рецессивные формы одних и тех же патологических состояний, обусловленные различными мутациями в одном и том же гене
Таблица 1.7. Доминантные и рецессивные формы одних и тех же патологических состояний, обусловленные различными мутациями в одном и том же гене
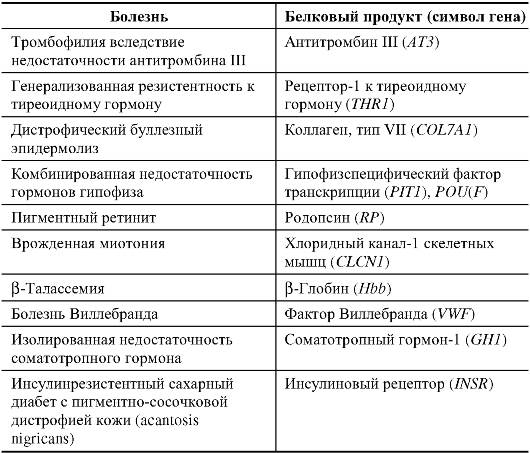 тивируют, свертывают полипептидные цепи или влияют на другие функции белка. Каждая из остальных категорий генов составляет менее 10% общего числа.
тивируют, свертывают полипептидные цепи или влияют на другие функции белка. Каждая из остальных категорий генов составляет менее 10% общего числа.
Сроки развития наследственных болезней во многом зависят от функции вовлеченного в патологию гена. Болезни, ассоциированные с генами, кодирующими белки во всех функциональных категориях, могут проявляться в любом периоде жизни. Гены, кодирующие транскрипционные факторы, избыточно представлены среди генов, вызывающих болезни с началом во внутриутробном периоде. Эта концентрация болезней, идущих от аномалий транскрипционных факторов, вероятно, отражает важную роль этих белков в оркестровке развития на ранних стадиях онтогенеза. Неудивительно, что гены, кодирующие транскрипционные факторы, составляют более 30% генов, ассоциируемых с фенотипами врожденных пороков развития.
Особенно высока доля болезней с началом на 1-м году жизни, вызванных дефектами в генах, кодирующих ферменты (47%). В принципе это полностью соответствует прогнозированию биологических эффектов и клиническим наблюдениям. Развивающийся плод имеет доступ к материнской метаболической системе гомеостаза через плаценту. Таким образом, дети с врожденными нарушениями, вызванными недостаточностью ферментов, обычно нормальны при рождении, симптомы нарушения гомеостаза развиваются после реализации дефекта в собственной системе метаболизма.
Болезни, вызванные дефектами генов, кодирующих ферменты, наследуются по аутосомно-рецессивному типу, а вызванные генами, кодирующими модуляторы белковой функции или рецепторы, - по аутосомно-рецессивному или аутосомно-доминантному. Болезни, вызванные генами транскрипционных факторов, относятся к группе аутосомно-доминантных.
Временные закономерности формирования наследственных болезней строго соответствуют роли и месту первичных продуктов в онтогенезе. Болезни транскрипционных факторов развиваются внутриутробно, патология ферментов - в течение 1-го года жизни, рецепторов - в возрасте от 1 года до пубертатного периода, модуляторов белковой функции - у взрослых до 50 лет.
Клетка функционирует благодаря строго скоординированным функциям генов. Количественное распределение генов, участвующих в основных процессах типичной клетки человека, следующее: синтез РНК и белков - 22%; клеточное деление - 12%; клеточные
сигналы - 12%; защита клетки - 12%; обмен (метаболизм) - 17%; клеточные структуры - 8%; неизвестная функция - 17%.
Одним из основных правил наследования признаков является правило эквивалентности реципрокных скрещиваний, т.е. равнозначной функции аллеля, полученного от отца или от матери. Однако, как показали подробные исследования, это правило может не соблюдаться. Функции генов взаимосвязаны и могут изменяться вплоть до дифференциального выключения одного из аллелей на протяжении всего онтогенеза. Такие случаи наследования объясняют генетическим импринтингом.
Генетический импринтинг - это эпигенетический процесс, дифференциально маркирующий локусы хромосом одного из родителей, что приводит к выключению экспрессии генов, в них расположенных. Следовательно, в участках генома, подверженных импринтингу, обнаруживается моноаллельная (а не биаллельная) экспрессия генов, т.е. если импринтирован материнский ген, то экспрессируется только отцовский, и наоборот. Неэквивалентный вклад родителей в геном потомства обусловливает отклонение от строгих менделевских законов, согласно которым вклад каждого из родителей в наследственность потомков равнозначен. Таким образом, фенотипические проявления конкретного гена могут меняться из-за трех причин: его делеции, мутации в нем и эпигенетического выключения экспрессии. Речь идет о стойких функциональных различиях экспрессии гомологичных генов у потомства. Механизмом импринтинга наиболее вероятно является специфическое метилирование цитозиновых оснований ДНК, которое выключает транскрипцию гена.
Известно около 30-ти генов в геноме человека, подверженных импринтингу и имеющих тканеспецифическую моноаллельную экспрессию, а также 3 кластера генов, локализованных в хромосомах 7q32, 11p15, 15q 11.2-13. Они имеют прямое отношение к наследственной патологии (опухоли, синдромы Прадера-Вилли, Ангельмана и др.).
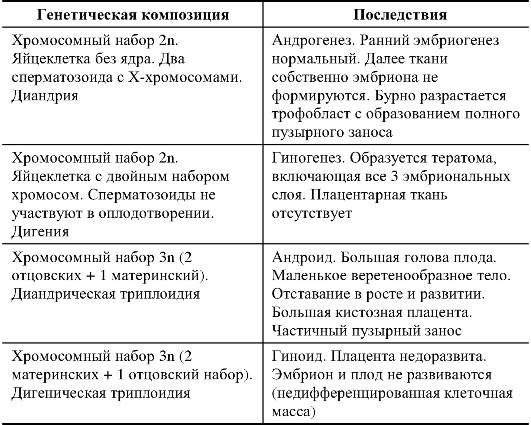
Генетический импринтинг может проявляться не только на уровне гена или кластера генов. Он может затрагивать целую хромосому (однородительские дисомии) и даже геномы. Эффекты геномного импринтинга у человека изучены на примере пузырного заноса (табл. 1.8).
Из представленных в табл. 1.8 данных можно сделать вывод, что развитие плаценты обеспечивается геномом отца, а раннее развитие эмбриональных структур обеспечивается геномом матери.
Таблица 1.8. Последствия разных вариантов импринтинга целого генома у человека
 Генетические карты хромосом
Генетические карты хромосом
Частью сведений о геноме человека наряду с нуклеотидной последовательностью стали генетические карты хромосом, т.е. схемы, отражающие порядок расположения генов и других генетических элементов на хромосоме с указанием расстояния между ними. Генетическое расстояние измеряется по частоте рекомбинаций между гомологичными хромосомами и выражается в сантиморганидах (сМ). Одна сМ соответствует частоте рекомбинаций, равной 1%. Длина всего генома человека равна примерно 3000-3500 сМ.
Изучение групп сцепления и составление карт хромосом первоначально основывались на анализе расщепления фенотипов в потомстве формально-генетическими методами. Результат генетического картирования зависит от трех основных условий: точности клинического диагноза; обширных родословных; использования
информативных генетических маркеров. Соблюдение этих условий и международный обмен информацией обеспечили фундамент для составления карт.
Применение молекулярно-генетических методов значительно ускорило картирование генов, а секвенирование генома позволяет составить полные генетические карты для всех хромосом, как сделано для хромосом 21 и 22.
На рис. 1.10 представлена в качестве примера карта хромосомы 3 по генам, патологические мутации в которых ведут к наследственным болезням. Такие карты называют патологической анатомией генома человека. Это далеко не полная карта, которая постоянно пополняется, как и по другим хромосомам.
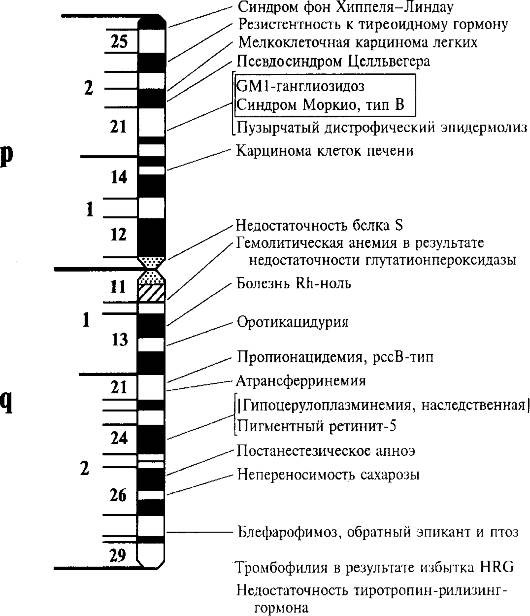 Рис. 1.10. Патологическая анатомия хромосомы 3.
Рис. 1.10. Патологическая анатомия хромосомы 3.
Примером полной генетической карты может быть геном митохондрий (рис. 1.11), наиболее точно расшифрованный и секвенированный.
На рис. 1.11 видно, что каждый ген митохондрий занимает свое положение. Известны все особенности генома митохондрий (см. выше).
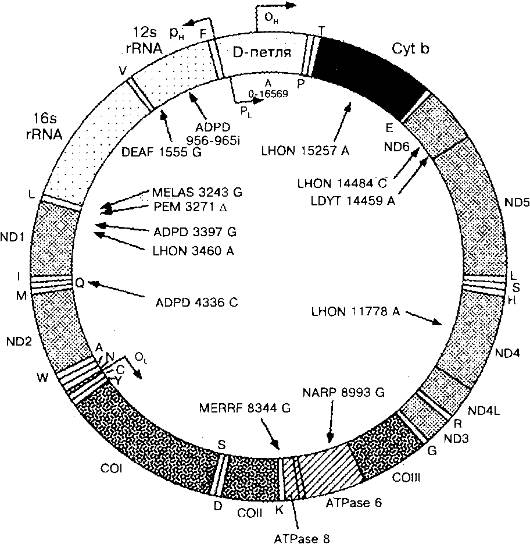 Рис. 1.11. Структура митохондриального генома и примеры митохондриальных болезней. ADPD - Болезнь Альцгеймера/болезнь Паркинсона; DEAF - нейросенсорная потеря слуха; LHON - наследственная нейроофтальмопатия Лебера; LDYT - LHON и дистония MELAS (митохондриальная миопатия, энцефалопатия, молочно-кислый ацидоз и приступы судорог); MERRF - миоклональная эпилепсия в сочетании с необычно красными мышечными волокнами; NARP - нейропатия, атаксия и пигментный ретинит; PEM - летальная прогрессирующая энцефаломиопатия.
Рис. 1.11. Структура митохондриального генома и примеры митохондриальных болезней. ADPD - Болезнь Альцгеймера/болезнь Паркинсона; DEAF - нейросенсорная потеря слуха; LHON - наследственная нейроофтальмопатия Лебера; LDYT - LHON и дистония MELAS (митохондриальная миопатия, энцефалопатия, молочно-кислый ацидоз и приступы судорог); MERRF - миоклональная эпилепсия в сочетании с необычно красными мышечными волокнами; NARP - нейропатия, атаксия и пигментный ретинит; PEM - летальная прогрессирующая энцефаломиопатия.
Знание генетических карт необходимо в разных разделах медицинской генетики для диагностики болезней методом сцепления, оценки патологических эффектов хромосомных транслокаций, решения вопросов эволюционной и популяционной генетики.
Заключение
Последние 15 лет интенсивного развития геномики человека обеспечили новый этап в развитии медицины и переход ее на молекулярный уровень. Геномика человека является основой молекулярной медицины. Резкое увеличение геномной информации стало началом переосмысления процессов развития человека и его болезней. Развитие патологии прослеживается на молекулярном уровне от первичного продукта гена до исхода заболевания.
Полные данные по нуклеотидной последовательности генома ускоряют генетический анализ человека. В связи с этим изменяются направления биомедицинских исследований.
1. В предыдущие годы основное внимание в изучении наследственности человека было сосредоточено на структурной геномике (секвенировании генома). Теперь исследования направлены на функциональную геномику (межгенные сети, протеомика).
2. С середины 80-х годов XX века обнаружение генов (их идентификация вплоть до нуклеотидной последовательности) осуществлялось главным образом через картирование генов (метод позиционного клонирования). Сведения по геному человека позволяют обнаруживать гены на уровне нуклеотидных последовательностей быстрее и точнее.
3. До последнего времени акцент в изучении наследственной патологии был на моногенных болезнях и на анализе одного гена. Теперь он сдвигается в сторону мультифакториальных болезней, анализа множественных генов и мониторинга предрасположенности.
4. Изучение действия гена (первичных продуктов) всегда считалось высшим пилотажем в генетике, но теперь исследования должны больше концентрироваться на механизмах регуляции действия гена.
5. С точки зрения общей патологии достижения геномики направляют мысль от изучения этиологии наследственных болезней (специфические мутации) к их патогенезу (механизмы формирования патологического фенотипа).
При обсуждении значимости секвенирования генома человека нередко звучат необоснованные обещания. В науке (например, в онкологии) не раз вполне объективно прогнозируемые результаты разработок не сбывались, потому что проблема (явление, болезнь) оказывалась сложнее и прямая экстраполяция прогресса не оправдывалась. Знание генома человека, несомненно, приведет к прогрессу во многих (если не во всех) разделах медицины, но маловероятно, что это единственное направление развития медицины.
Исходя из уже применяемых в практическом здравоохранении достижений генетики, можно прогнозировать следующие перспективы использования результатов геномных исследований:
• широкое применение генодиагностики наследственных болезней, в том числе пренатальной;
• техническая доступность предымплантационной диагностики в основных медико-генетических центрах;
• генетическое тестирование на болезни с наследственной предрасположенностью и принятие профилактических мер;
• новые подходы и методы лечения, в том числе генная терапия отдельных заболеваний;
• создание новых типов лекарств на основе геномной информации (фармакогеномика).
Накопление генетической информации будет проверяться медициной в широком плане и использоваться здравоохранением для разных контингентов населения. Новорожденных будут обследовать на болезни, беременных - на патологию плода. Уже есть предпосылки для выявления детей с высоким риском раннего атеросклероза, чтобы начать их лечение на ранних этапах и предупредить изменения в сосудах во взрослом состоянии. Супруги могут получить сведения о своем генетическом статусе в отношении наследственной болезни у ребенка до планирования деторождения. Население среднего и более старшего возраста может быть обследовано по риску многих болезней, которые удастся предупредить (или облегчить) путем диетических рекомендаций или лекарственного лечения. Проверку индивидуальной чувствительности к лекарствам можно проводить молекулярно-генетическими методами, и это должно стать стандартной процедурой перед началом лечения.
Ключевые слова и понятия
Аксиомы медицинской генетики Генетика человека
Генетические технологии в медицине Евгеника
Клиническая генетика Медицинская генетика Менделизм в генетике человека Молекулярная медицина Причины детской смертности Частота наследственной патологии
Контрольные вопросы
1. Использование концепции менделизма в генетике человека началось:
а) с середины XIX века (Г. Мендель; В.М. Флоринский; Ф. Гальтон);
б) с конца XIX века (А. Вейсман; А.А. Остроумов);
в) с начала XX века (переоткрытие законов Г. Менделя);
г) в 1910-1920 гг. (Т.Х. Морган; хромосомная теория наследственности);
д) в 1940-1950 гг. (открытие информационной роли и структуры ДНК);
е) в 1950-1960 гг. (новая эра цитогенетики человека).
2. Объектом изучения клинической генетики являются:
а) больной человек;
б) больной и больные родственники;
в) больной и все члены его семьи, в том числе и здоровые.
3. Генетические технологии в медицине и здравоохранении применяются для:
а) изучения причин клинического полиморфизма болезней;
б) создания новых вакцин;
в) диагностики наследственных и инфекционных болезней.
4. Основоположник клинической генетики в России:
а) Н.К. Кольцов;
б) А.С. Серебровский;
в) С.Н. Давиденков;
г) Н.В. Тимофеев-Ресовский;
д) Н.П. Дубинин.
5. Наследственная отягощенность человеческой популяции включает в себя:
а) накопленные в процессе эволюции патологические мутации;
б) вновь возникающие мутации в соматических клетках;
в) вновь возникающие мутации в половых клетках;
г) распространенность наследственных болезней.
6. Частота наследственных и врожденных заболеваний среди новорожденных составляет:
а) 5-5,5%;
б) 3-3,5%;
в) 9-10%;
г) 0,1-1,0%.
7. Негативная евгеника - это:
а) раздел генетики человека по изучению причин ухудшения природы человека;
б) освобождение человечества от наследственной патологии путем насильственной стерилизации;
в) улучшение природы человека путем отбора лучших представителей человечества и их предпочтительного размножения;
г) насильственное ограничение репродуктивной свободы человека.
8. Число известных клинических форм наследственных заболеваний составляет примерно:
а) до 3000;
б) 4000-4500;
в) 6000-10 000;
г) 80 000-100 000.
9. Исключите неправильные утверждения:
а) нет таких признаков, которые бы зависели только от наследственности или только от среды;
б) наследственная изменчивость, ведущая к вариациям нормальных признаков и ведущая к наследственным болезням, - два разных вида изменчивости;
в) в ближайшее время ожидается резкий рост частоты наследственной патологии вследствие увеличения мутагенной нагрузки, миграции населения и других популяционных факторов;
г) новые мутации могут закрепляться в популяции путем естественного
отбора.
10. Доля наследственных и врожденных болезней среди причин смерти детей на 1-м году жизни составляет:
а) 50%;
б) 70%;
в) 25%;
г) 5%.
ВВЕДЕНИЕ В КЛИНИЧЕСКУЮ ГЕНЕТИКУ
Основные понятия
Генетика наряду с морфологией, физиологией и биохимией служит теоретическим фундаментом современной медицины. Наследственность лежит в основе всех жизненных проявлений. Без наследственности и изменчивости была бы невозможна эволюция жизни на Земле. Поскольку человек - продукт длительной эволюции живой природы, все общебиологические закономерности отражены в его формировании как биологического вида Человек разумный (Homo sapiens).
Генетика человека изучает явления наследственности и изменчивости на всех уровнях его организации и существования: молекулярном, клеточном, организменном, популяционном, биохорологическом, биогеохимическом. С периода зарождения (начало XX века) и особенно в период интенсивного подъема (50-е годы XX века) генетика человека развивалась не только как теоретическая, но и как клиническая дисциплина, постоянно подпитываясь как общебиологическими концепциями (эволюционное учение, онтогенез), так и генетическими открытиями (законы наследования признаков, хромосомная теория наследственности, информационная роль ДНК). В то же время на процесс становления генетики человека как науки постоянно и существенно влияли достижения теоретической и клинической медицины. Человек как биологический объект изучен детальнее, чем любой другой высокоорганизованный организм (дрозофила, мышь и др.). Изучение патологических вариаций (предмет врачебной профессии) служило основой для познания наследственности человека. В свою очередь развитие генетики человека ускоряло развитие теоретических дисциплин (например, молекулярной биологии) и клинической медицины (например, новой области в медицине - учения о хромосомных болезнях).
Взаимодействие генетики человека с фундаментальными науками и медициной отражено на рис. 1.1.
Медицинская генетика изучает роль наследственности в патологии человека, закономерности передачи от поколения к поколению наследственных болезней, разрабатывает методы диагности-
 Рис. 1.1. Взаимовлияние наук.
Рис. 1.1. Взаимовлияние наук.
ки, лечения и профилактики наследственной патологии, включая болезни с наследственной предрасположенностью. Это направление синтезирует медицинские и генетические открытия и достижения, направляя их на борьбу с болезнями и улучшение здоровья людей.
Медицинская генетика, составляя важнейшую часть теоретической медицины, рассматривает в связи с патологией вопросы:
• какие наследственные механизмы поддерживают гомеостаз организма и определяют здоровье индивида;
• каково значение наследственных факторов (мутации или сочетание определенных аллелей) в этиологии болезней;
• каково соотношение наследственных и средовых факторов в патогенезе болезней;
• какова роль наследственных факторов в определении клинической картины болезней (и наследственных, и ненаследственных);
• влияет ли (и если влияет, то как) наследственная конституция на процесс выздоровления человека и исход болезни;
• как наследственность определяет специфику фармакологического и других видов лечения.
Как теоретическая и клиническая дисциплина медицинская генетика продолжает интенсивно расширяться в разных направлениях: изучение генома человека, цитогенетика, молекулярная и биохимическая генетика, иммуногенетика, генетика развития, популяционная генетика, клиническая генетика.
Образование по медицинской генетике включает основы общей генетики (менделизм, учение о хромосомах, химические основы наследственности), основные положения генетики человека (человек как объект генетического исследования) и клиническую генетику.
Клиническая генетика в строгом смысле слова - прикладной раздел медицинской генетики, т.е. применение ее достижений к клиническим проблемам у пациентов или в их семьях: какая болезнь у пациента (диагноз), как ему помочь (лечение), как предупредить рождение больного потомства (прогноз и профилактика). В настоящее время клиническая генетика основывается на геномике, ци-
тогенетике, биохимической генетике, иммуногенетике, формальной генетике, включая популяционную и эпидемиологическую, генетике соматических клеток и молекулярной генетике.
Дата: 2019-05-28, просмотров: 376.