Общее количество ДНК в соматической клетке составляет 6,4?109 пар оснований, следовательно, гаплоидный набор состоит из 3,2?109 пар нуклеотидов. Основное количество ДНК локализовано в хромосомах (99,5%). Внехромосомная часть генома человека - это ДНК митохондрий (0,5%). Совсем небольшое количество составляют отдельные кольцевые молекулы ДНК в ядре и цитоплазме.
Структурные классы ДНК представлены на рис. 1.7.
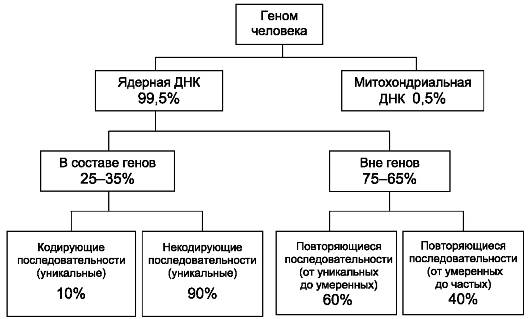 Рис. 1.7. Структурные классы ДНК человека.
Рис. 1.7. Структурные классы ДНК человека.
В ядерной или хромосомной ДНК только 25-35% составляют гены и их регуляторные участки (это уникальные последовательности). Лишь 10% относящейся к генам ДНК является кодирующей. Следовательно, лишь 2,5-3,5% всей ядерной ДНК имеют отношение к синтезу белков. Что делает покоящаяся часть генома, неизвестно. Однако вряд ли она не имеет функций.
Повторы. Участки с повторяющимися последовательностями различаются по длине каждого повтора и числу повторов (их называют тандемными). Если повтор состоит из 2-8 пар нуклеотидов (п.н.), то такие повторы называют микросателлитами. Другая группа повторов варьирует от 10 до 100 000 п.н., иногда больше. Эти повторы называют минисателлитами.
Различают умеренно повторяющиеся последовательности (до 1000 повторов в одном локусе) и высокоповторяющиеся (свыше 1000 повторов). Они могут быть локализованы в одном локусе или во многих локусах одной или разных хромосом.
Одна и та же последовательность может повторяться в разных локусах разное число раз. Такие повторы называют гипервариабельными тандемными повторами.
Мини- и микросателлитные тандемные повторы разбросаны по всему геному и представляют собой уникальную для каждого человека комбинацию по числу тандемных повторов в разных локусах и по числу таких локусов. Их выявление характеризует генетический полиморфизм каждого человека, оценка которого используется в медико-генетических и судебно-медицинских целях (см. главу 8).
Внехромосомные и кольцевые молекулы ДНК обнаруживаются в цитоплазме и ядре. У человека они изучены еще недостаточно. В строгом смысле они являются не составными элементами генома, а его продуктом. Их размер колеблется от 150 п.н. до 20 000 п.н. Являются ли эти молекулы продуктом фрагментации хромосомной ДНК в клетке или они образуются в результате других генетических процессов (гомологичная рекомбинация, обратная транскрипция), пока неясно. Исследованные к настоящему времени у млекопитающих большие кольцевые ДНК размером от 150 до 900 000 п.н., локализованные только в ядрах, представляют собой амплифицированные участки онкогенов или генов устойчивости к ядам и антиметаболитам. С этими молекулами предположительно связывают устойчивость клеток к лекарствам и способность клеток к неограниченному росту. Их происхождение объясняют делециями соответствующих областей хромосом.
Полиморфизм. Любые изменения в структуре ДНК (в хромосомах или митохондриях) ведут к генетическому полиморфизму. Под полиморфизмом понимают такие варианты последовательностей ДНК, которые распространены в общей популяции с частотой не менее 1%. Эти изменения могут быть качественными, когда они обусловлены заменой или потерей нуклеотидов, или количественными, когда в определенном локусе варьирует число нуклеотидных повторов различной протяженности. И те и другие варианты генетического полиморфизма встречаются как в смысловых (внутриэкзонных), так и в несмысловых (внегенных или интронных) последовательностях молекулы ДНК.
Главной формой генетического полиморфизма является однонуклеотидный полиморфизм (ОНП). Под этим термином понимают варианты последовательностей ДНК у разных людей с вовлечением одной пары оснований (рис. 1.8). На схеме представлены 3 фрагмента последовательностей от 2 индивидов. В прямоугольниках выделены однонуклеотидные различия в геномных последовательностях. ОНП - наиболее общий источник вариаций между людьми. Эти вариации встречаются на протяжении всей ДНК (в экзонах, интронах, межгенных промежутках, повторах) и отражают прошлые мутации.
Секвенированием геномов или их частей разных людей установлено, что однонуклеотидные различия обнаруживаются на протя-
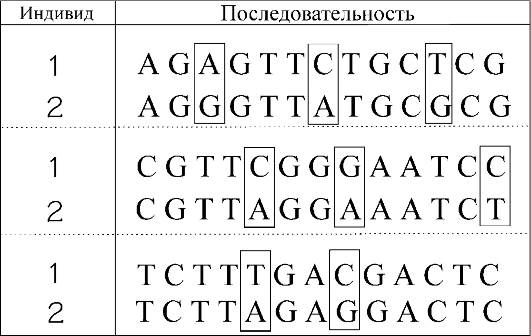 Рис. 1.8. Примеры однонуклеотидного полиморфизма у двух индивидов (объяснение в тексте).
Рис. 1.8. Примеры однонуклеотидного полиморфизма у двух индивидов (объяснение в тексте).
жении 1000-2000 пар оснований нуклеотидной длины. Это означает, что на всю длину генома (3,2 млрд п.н.) должно быть 1,6-3,2 млн однонуклеотидных различий, к 2003 г. уже было идентифицировано и картировано более 2 млн. Расчеты показывают, что 2 человека на 99,9% идентичны по нуклеотидным последовательностям, т.е. только 0,1% различий по одному нуклеотиду создает огромные индивидуальные фенотипические вариации.
Предполагают, что различия по одному основанию между определенными отрезками геномов лежат в основе не только генных болезней (миссенс-мутации), но и чувствительности к возбудителям или защиты от них, в основе приспособительных реакций и наследственной предрасположенности к мультифакториальным болезням.
Число ОНП на ген у человека колеблется от 0 до 29, причем в кодирующих последовательностях гена содержится в среднем по 4 полиморфных сайта. В генах человека около 50% некодирующих ОНП, 25% синонимичных кодирующих (не изменяющих аминокислоту в кодируемом белке) и 25% несинонимичных кодирующих ОНП. Типичный индивидуум гетерозиготен примерно по 24 000- 40 000 несинонимичных замен. Хотя информация об ОНП еще неполная (основные сведения получены в последние 4 года), уже известно, что все гены содержат ОНП.
Главное использование карты ОНП - это выяснение вклада индивидуальных генов в болезни комплексной (многофакторной) и полигенной природы. Сравнение частот определенных типов ОНП у пациентов и в контрольных группах позволяет идентифицировать ОНП, с которыми ассоциируется заболевание. Несмотря на большие перспективы, которые открываются для объяснения заболеваний человека с пониманием природы и размаха ОНП, необходимо помнить об опасности геномомании. Гены и геномы действуют не в вакууме. Среда не менее важна для биологии человека, чем гены. Карты ОНП при правильном использовании позволяют лучше понять роль природы (генотипа) и среды в широком понимании в развитии человека в целом и патологии в частности.
Выше представлены характеристики основной части генома человека, локализованного в хромосомах. Наряду с этим во всех клетках активно функционирует та часть генома, которая локализована в митохондриях. Имеются некоторые отличия в организации генома митохондрий по сравнению с хромосомным.
Митохондриальный геном. Митохондрии содержат кольцевую двухцепочечную ДНК, которую обозначили хромосомой 25 человека
(мтДНК). В каждой соматической клетке в среднем содержится около 1000 митохондрий. Суммарно ДНК митохондрий составляет не более 0,5% общего количества ДНК в организме. ДНК митохондрий реплицируется (транскрибируется) полуавтономно от ядерной ДНК.
Геном митохондрий человека был полностью секвенирован еще в 1981 г. Он содержит 16 569 пар оснований и кодирует 2 рибосомные РНК (12S и 16S), 22 транспортные РНК и 13 полипептидов. Полипептиды являются субъединицами ферментативных комплексов окислительного фосфорилирования. Другие 66 субъединиц дыхательной цепи кодируются в ядре.
Митохондриальный геном как целое отличается от ядерного генома несколькими признаками.
• мтДНК наследуется по материнскому типу. Доля отцовских мтДНК в зиготе составляет от 1 до 4 митохондрий, а материнских - 25 000. К тому же не исключается, что после оплодотворения репликация отцовских митохондрий вообще блокируется.
• Комбинативная изменчивость мтДНК (мейоз) отсутствует. Нуклеотидная последовательность меняется в поколениях только в результате мутаций.
• Митохондриальный геном непрерывен, т.е. не содержит интронов. В нем имеется всего лишь несколько межгенных пар оснований (или их вообще нет). Известно только одно исключение - около 1000 п.н. является интроном в области промоторов (Д-петля). В мтДНК нет защитных гистонов и системы репарации ДНК. Такая организация определяет примерно в 10 раз большую скорость мутирования по сравнению с ядерной ДНК.
• Большинство генов мтДНК чередуются с 1 геном транспортной РНК или более, которые служат разделяющими сигналами для дальнейшего процессинга первичных транскриптов.
• Внутри одной клетки могут функционировать митохондрии с разными типами мтДНК. Это состояние называют гетероплазмией. Присутствие в клетках митохондрий с одним типом мтДНК называется гомоплазмией.
• В мтДНК транскрибируются или транслируются обе цепи. Код мтДНК лишь частично отличается от универсального (UGA кодирует триптофан, AUA кодирует метионин, AGA и AGG являются стоп-кодонами).
Мутации генов мтДНК лежат в основе митохондриальных болезней, отличающихся от моногенных болезней не только особенностями передачи из поколения в поколение по материнской линии, но и своеобразными общими чертами клинической картины.
Патологические мутации мтДНК открыты в каждом типе митохондриальных генов.
Генный уровень
Основное внимание в генетике всегда уделялось гену. Благодаря комплексному подходу к изучению генов (от фенотипа на уровне организма до расшифровки нуклеотидной последовательности) накопилась обширная информация о строении и функции генов. Под термином «ген» теперь понимают последовательность нуклеотидов в ДНК, которая обусловливает определенную функцию в организме или обеспечивает транскрипцию другого гена.
На основе данных по секвенированию определено, что в геноме человека 30 000-40 000 генов, а не 70 000-100 000, как считали ранее. Сотни генов, вероятно, получены человеком в результате горизонтальной передачи, начиная от бактерий. Более 6500 генов человека (примерно 1/6 часть генома) охарактеризованы экспериментально (по функции продукта, наличию мутаций, тканеспецифичности, размеру транскрипта). Хромосомная локализация установлена для 14 000 генов (рис. 1.9).
Гены человека более комплексные, чем у других изученных организмов (например, у дрозофилы). Благодаря альтернативному сплайсингу число синтезируемых белковых продуктов, очевидно, в 1,5- 2 раза больше, чем число генов. Явление альтернативного сплайсинга заключается в следующем. Из одного и того же первичного РНК-транскрипта в процессинге РНК в разных тканях образуется не один, а несколько разных по длине мРНК-транскриптов. Соответственно синтезированные полипептиды также будут различными. Таким образом, одна и та же ДНК-последовательность может кодировать не один, а несколько разных белковых продуктов.
Размер генов человека, число экзонов и интронов в них варьируют в широких пределах (табл. 1.5).
Большинство генов имеет размеры до 50 000 п.н. (табл. 1.6). Средняя длина участка хромосомы, приходящегося на ген, составляет 27 000 п.н. Однако есть гены, размер которых в 100 раз меньше или в 100 раз больше этой средней величины.
Как известно из менделевской генетики, различные аллели могут проявляться в доминантном, рецессивном и кодоминантном вариантах. В геноме человека это правило в отдельных случаях нарушается.
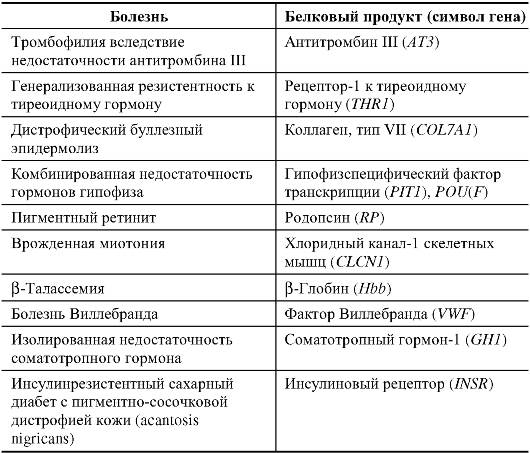
В табл. 1.7 приведены примеры то доминантного, то рецессивного проявления одних и тех же фенотипов, обусловленных различными мутациями в одном и том же гене.
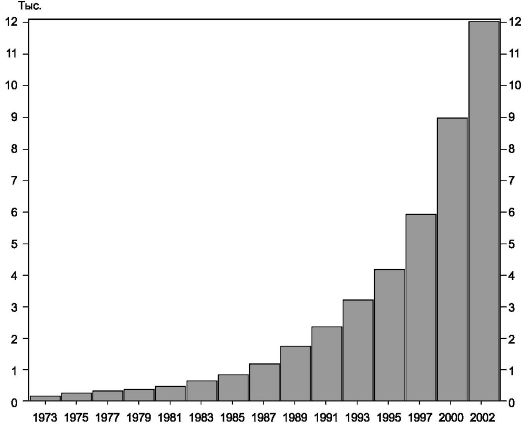 Рис. 1.9. Динамика картирования генов человека.
Рис. 1.9. Динамика картирования генов человека.
Эти данные необходимо принимать во внимание при медикогенетическом консультировании, когда родословная не будет укладываться в рамки привычных типов наследования.
Функции генов. Накопленные сведения о генах человека позволяют выделить их группы по функциям первичного продукта: ферменты; модуляторы белковой функции; рецепторы; транскрипционные факторы; белки внутриклеточного матрикса; белки внеклеточного матрикса; трансмембранные переносчики; структуры ионных каналов; молекулы клеточных сигналов; гормоны; экстраклеточные переносчики; иммуноглобулины.
Безусловно, есть еще и гены с неизвестным пока действием.
Наибольшую функциональную категорию (31,2% общего числа) составляют гены, кодирующие ферменты. В 2 раза меньше геновмодуляторов белковой функции (13,6%). Они стабилизируют, ак-
Таблица 1.5. Классификация генов человека по размеру (примеры)
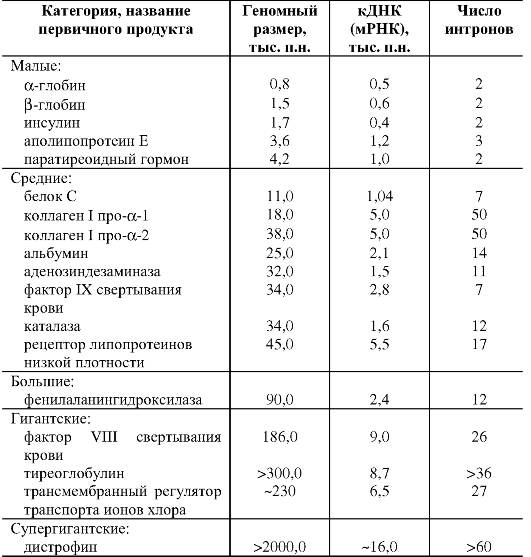 Таблица 1.6. Распределение генов человека по размеру
Таблица 1.6. Распределение генов человека по размеру
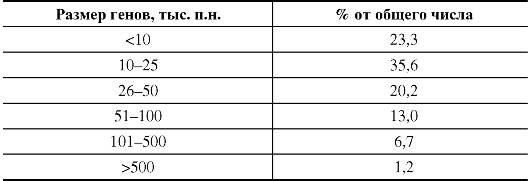 Таблица 1.7. Доминантные и рецессивные формы одних и тех же патологических состояний, обусловленные различными мутациями в одном и том же гене
Таблица 1.7. Доминантные и рецессивные формы одних и тех же патологических состояний, обусловленные различными мутациями в одном и том же гене
 тивируют, свертывают полипептидные цепи или влияют на другие функции белка. Каждая из остальных категорий генов составляет менее 10% общего числа.
тивируют, свертывают полипептидные цепи или влияют на другие функции белка. Каждая из остальных категорий генов составляет менее 10% общего числа.
Сроки развития наследственных болезней во многом зависят от функции вовлеченного в патологию гена. Болезни, ассоциированные с генами, кодирующими белки во всех функциональных категориях, могут проявляться в любом периоде жизни. Гены, кодирующие транскрипционные факторы, избыточно представлены среди генов, вызывающих болезни с началом во внутриутробном периоде. Эта концентрация болезней, идущих от аномалий транскрипционных факторов, вероятно, отражает важную роль этих белков в оркестровке развития на ранних стадиях онтогенеза. Неудивительно, что гены, кодирующие транскрипционные факторы, составляют более 30% генов, ассоциируемых с фенотипами врожденных пороков развития.
Особенно высока доля болезней с началом на 1-м году жизни, вызванных дефектами в генах, кодирующих ферменты (47%). В принципе это полностью соответствует прогнозированию биологических эффектов и клиническим наблюдениям. Развивающийся плод имеет доступ к материнской метаболической системе гомеостаза через плаценту. Таким образом, дети с врожденными нарушениями, вызванными недостаточностью ферментов, обычно нормальны при рождении, симптомы нарушения гомеостаза развиваются после реализации дефекта в собственной системе метаболизма.
Болезни, вызванные дефектами генов, кодирующих ферменты, наследуются по аутосомно-рецессивному типу, а вызванные генами, кодирующими модуляторы белковой функции или рецепторы, - по аутосомно-рецессивному или аутосомно-доминантному. Болезни, вызванные генами транскрипционных факторов, относятся к группе аутосомно-доминантных.
Временные закономерности формирования наследственных болезней строго соответствуют роли и месту первичных продуктов в онтогенезе. Болезни транскрипционных факторов развиваются внутриутробно, патология ферментов - в течение 1-го года жизни, рецепторов - в возрасте от 1 года до пубертатного периода, модуляторов белковой функции - у взрослых до 50 лет.
Клетка функционирует благодаря строго скоординированным функциям генов. Количественное распределение генов, участвующих в основных процессах типичной клетки человека, следующее: синтез РНК и белков - 22%; клеточное деление - 12%; клеточные
сигналы - 12%; защита клетки - 12%; обмен (метаболизм) - 17%; клеточные структуры - 8%; неизвестная функция - 17%.
Одним из основных правил наследования признаков является правило эквивалентности реципрокных скрещиваний, т.е. равнозначной функции аллеля, полученного от отца или от матери. Однако, как показали подробные исследования, это правило может не соблюдаться. Функции генов взаимосвязаны и могут изменяться вплоть до дифференциального выключения одного из аллелей на протяжении всего онтогенеза. Такие случаи наследования объясняют генетическим импринтингом.
Генетический импринтинг - это эпигенетический процесс, дифференциально маркирующий локусы хромосом одного из родителей, что приводит к выключению экспрессии генов, в них расположенных. Следовательно, в участках генома, подверженных импринтингу, обнаруживается моноаллельная (а не биаллельная) экспрессия генов, т.е. если импринтирован материнский ген, то экспрессируется только отцовский, и наоборот. Неэквивалентный вклад родителей в геном потомства обусловливает отклонение от строгих менделевских законов, согласно которым вклад каждого из родителей в наследственность потомков равнозначен. Таким образом, фенотипические проявления конкретного гена могут меняться из-за трех причин: его делеции, мутации в нем и эпигенетического выключения экспрессии. Речь идет о стойких функциональных различиях экспрессии гомологичных генов у потомства. Механизмом импринтинга наиболее вероятно является специфическое метилирование цитозиновых оснований ДНК, которое выключает транскрипцию гена.
Известно около 30-ти генов в геноме человека, подверженных импринтингу и имеющих тканеспецифическую моноаллельную экспрессию, а также 3 кластера генов, локализованных в хромосомах 7q32, 11p15, 15q 11.2-13. Они имеют прямое отношение к наследственной патологии (опухоли, синдромы Прадера-Вилли, Ангельмана и др.).
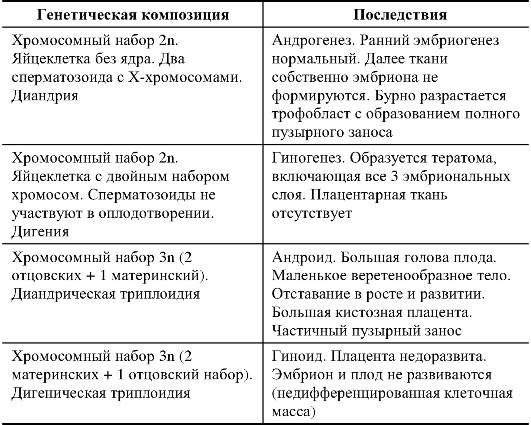
Генетический импринтинг может проявляться не только на уровне гена или кластера генов. Он может затрагивать целую хромосому (однородительские дисомии) и даже геномы. Эффекты геномного импринтинга у человека изучены на примере пузырного заноса (табл. 1.8).
Из представленных в табл. 1.8 данных можно сделать вывод, что развитие плаценты обеспечивается геномом отца, а раннее развитие эмбриональных структур обеспечивается геномом матери.
Таблица 1.8. Последствия разных вариантов импринтинга целого генома у человека
 Генетические карты хромосом
Генетические карты хромосом
Частью сведений о геноме человека наряду с нуклеотидной последовательностью стали генетические карты хромосом, т.е. схемы, отражающие порядок расположения генов и других генетических элементов на хромосоме с указанием расстояния между ними. Генетическое расстояние измеряется по частоте рекомбинаций между гомологичными хромосомами и выражается в сантиморганидах (сМ). Одна сМ соответствует частоте рекомбинаций, равной 1%. Длина всего генома человека равна примерно 3000-3500 сМ.
Изучение групп сцепления и составление карт хромосом первоначально основывались на анализе расщепления фенотипов в потомстве формально-генетическими методами. Результат генетического картирования зависит от трех основных условий: точности клинического диагноза; обширных родословных; использования
информативных генетических маркеров. Соблюдение этих условий и международный обмен информацией обеспечили фундамент для составления карт.
Применение молекулярно-генетических методов значительно ускорило картирование генов, а секвенирование генома позволяет составить полные генетические карты для всех хромосом, как сделано для хромосом 21 и 22.
На рис. 1.10 представлена в качестве примера карта хромосомы 3 по генам, патологические мутации в которых ведут к наследственным болезням. Такие карты называют патологической анатомией генома человека. Это далеко не полная карта, которая постоянно пополняется, как и по другим хромосомам.
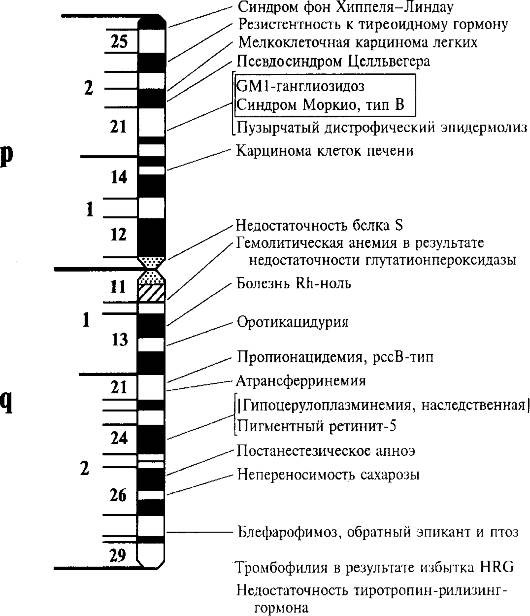 Рис. 1.10. Патологическая анатомия хромосомы 3.
Рис. 1.10. Патологическая анатомия хромосомы 3.
Примером полной генетической карты может быть геном митохондрий (рис. 1.11), наиболее точно расшифрованный и секвенированный.
На рис. 1.11 видно, что каждый ген митохондрий занимает свое положение. Известны все особенности генома митохондрий (см. выше).
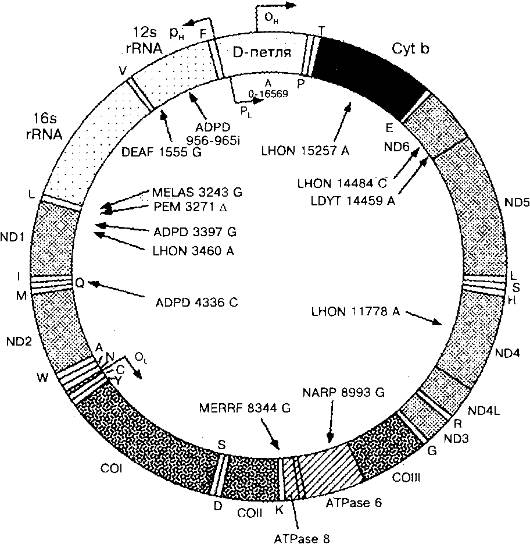 Рис. 1.11. Структура митохондриального генома и примеры митохондриальных болезней. ADPD - Болезнь Альцгеймера/болезнь Паркинсона; DEAF - нейросенсорная потеря слуха; LHON - наследственная нейроофтальмопатия Лебера; LDYT - LHON и дистония MELAS (митохондриальная миопатия, энцефалопатия, молочно-кислый ацидоз и приступы судорог); MERRF - миоклональная эпилепсия в сочетании с необычно красными мышечными волокнами; NARP - нейропатия, атаксия и пигментный ретинит; PEM - летальная прогрессирующая энцефаломиопатия.
Рис. 1.11. Структура митохондриального генома и примеры митохондриальных болезней. ADPD - Болезнь Альцгеймера/болезнь Паркинсона; DEAF - нейросенсорная потеря слуха; LHON - наследственная нейроофтальмопатия Лебера; LDYT - LHON и дистония MELAS (митохондриальная миопатия, энцефалопатия, молочно-кислый ацидоз и приступы судорог); MERRF - миоклональная эпилепсия в сочетании с необычно красными мышечными волокнами; NARP - нейропатия, атаксия и пигментный ретинит; PEM - летальная прогрессирующая энцефаломиопатия.
Знание генетических карт необходимо в разных разделах медицинской генетики для диагностики болезней методом сцепления, оценки патологических эффектов хромосомных транслокаций, решения вопросов эволюционной и популяционной генетики.
Дата: 2019-05-28, просмотров: 369.