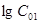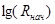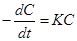Выбираем опыты, в которых начальная концентрация реагента А2 изменяется, а концентрация А1 постоянна. Эти данные приведены в таблице 7.
Таблица 7. Начальные концентрации и скорости, и их логарифм для опытов №9,№8,№2,№4,№5.
| опыт | Rнач,моль/л*мин | C02,моль/л |
|
|
| 0 | 0 | 0 | 0 | 0 |
| 3 | 0.079 | 0,4 | -0.699 | -1.1024 |
| 4 | 0.147 | 0,6 | -0.3979 | -0.832684 |
| 5 | 0.24 | 0,6 | -0.2218 | -0.61979 |
По данным таблицы 7 строим график зависимости 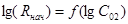 , который представлен на рисунке 5.
, который представлен на рисунке 5.
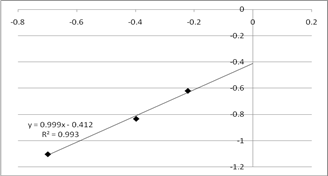
Рис. 5. График зависимости 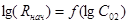 .
.
Порядок реакции по реагенту А2 определяем как тангенс угла наклона линии аппроксимации. 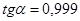 , следовательно порядок реакции по реагенту А2 равен 1.
, следовательно порядок реакции по реагенту А2 равен 1.
Определим порядок по реагенту А2. интегральным методом. По предыдущему расчету определили, что порядок реакции по данному компоненту первый. Тогда кинетическое уравнение будет иметь вид:
|
|
|
| |
Интегрируя его и учитывая начальное условие (при t=0, C2=C02), получаем уравнение:  . Данное уравнение представляет собой уравнение прямой в координатах
. Данное уравнение представляет собой уравнение прямой в координатах 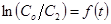 . Зависимости
. Зависимости 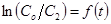 для каждого опыта представлены на рисунках 6-9.
для каждого опыта представлены на рисунках 6-9.
Опыт №1. Зависимость 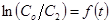 .
.
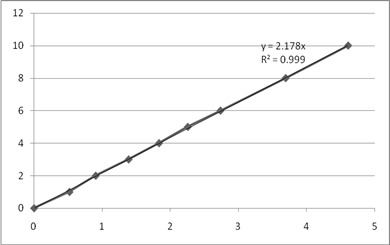
Опыт №2. Зависимость 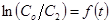 .
.

Опыт №3. Зависимость 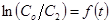 .
.
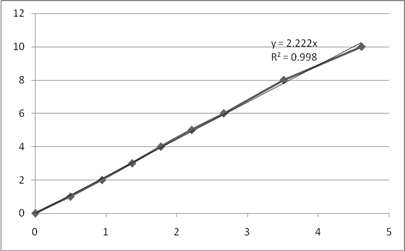
Рис. 6. Графики зависимости 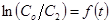 для опытов 1-3.
для опытов 1-3.
Опыт №4. Зависимость 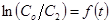 .
.
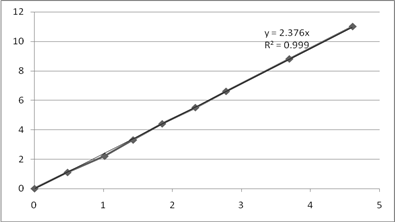
Опыт №5. Зависимость 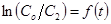 .
.
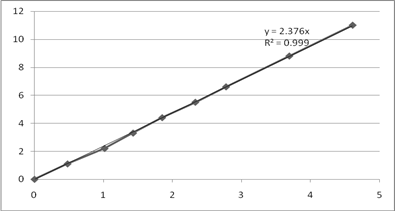
Опыт №6. Зависимость 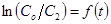 .
.
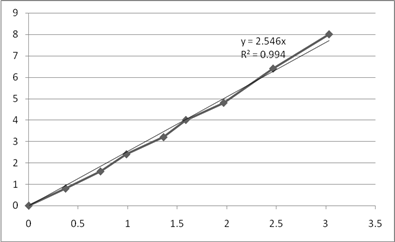
Рис. 7. Графики зависимости 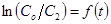 для опытов 4-6.
для опытов 4-6.
Опыт №7. Зависимость 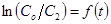 .
.
Опыт №8. Зависимость 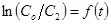 .
.
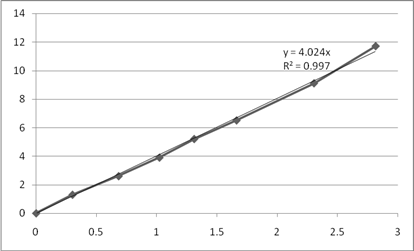
Опыт №9. Зависимость 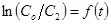 .
.
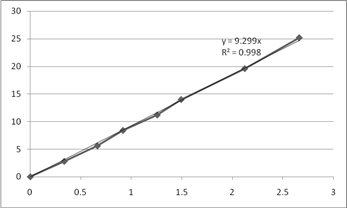
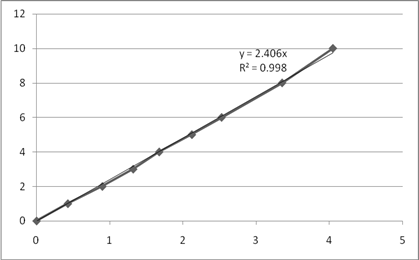
Рис. 8. Графики зависимости 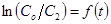 для опытов 7-9.
для опытов 7-9.
Все точки, включая начало координат аппроксимируются прямой с высокой точностью, следовательно, порядок по реагенту А2 равен 1.
Итоговый вид кинетического уравнения
Обобщая данные п. 3.1.-3.2., можем сделать вывод, что кинетическое уравнение данной реакции имеет вид:
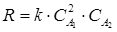
Определение параметров кинетического уравнения. Проверка адекватности модели
Определение константы скорости реакции k по первым 3-м опытам
Из вида кинетического уравнения следует, что его единственным параметром является константа скорости реакции k. Для определения значения константы скорости воспользуемся статистическим методом регрессионного анализа экспериментальных данных. Для оценки адекватности полученной модели будем использовать опыты с одинаковыми начальными данными. Исходя из плана эксперимента, такими опытами являются опыты №№1-3.
Последовательность обработки регрессионным методом
1. Выбор полиномиальной функции для обработки
2. Определение коэффициентов полинома
3. Проверка адекватности полученной функции
4. Оценка значимости коэффициентов
Выбор функции для обработки
При описании кинетического уравнения полиномом первой степени теряется физический смысл: скорость реакции постоянна в любой момент времени. Используя полином второй степени можем получить отрицательные концентрации при бесконечном времени реакции. Для описания экспериментальной зависимости выберем полином третьей степени, так как он наипростейший из не противоречащих физическому смыслу.
В общем случае полиномиальная зависимость будет иметь вид:
С2 = b0 + b1∙t + b2∙t2 + b3∙t3.
Заменив С2 на у, t на хi, где индекс i соответствует степени t, получим:
у = b0x0 + b1x1+b2x2 + b3x3.
Дата: 2019-05-28, просмотров: 284.