Вариант 4
Выполнил: Степанов В.Н.
Проверил: Темкин О.Н.
Москва, 2007г.
Оглавление
Определение вида кинетического уравнения
1. Определение текущих концентраций веществ
2. Определение начальных скоростей
3. Определение вида кинетического уравнения и порядков реакции по реагентам
4. Определение константы скорости реакции k по первым 3-м опытам
4.1 Последовательность обработки регрессионным методом
4.2 Выбор функции для обработки
4.3 Определение коэффициентов полинома
4.4 Проверка адекватности полученной модели и расчет константы скорости
4.6Значение константы скорости, рассчитанное по опытам №№ 1-3
5. Расчет констант скорости по остальным опытам
5.2Обработка кинетического уравнения
6. Оценка значимости найденного значения константы скорости. Определение доверительного интервала
6.1 Определение дисперсии константы скорости
6.2 Оценка значимости параметра модели
6.3 Определение доверительного интервала
6.4 Значение константы скорости
7. Итоговый вид кинетического уравнения
Задание
При исследовании кинетики реакции: PhNH2 (A1) + PhC ≡ CH (A2)→ PhNC(Ph)=CH2 (A3)
в растворе хлорбензола реализован следующий эксперимент (400С):
В опытах получены следующие зависимости концентрации (в моль/л) А2 от времени:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| С(А10), моль/л | 4 | 4 | 4 | 4 | 4 | 4 | 3 | 2 | 1 |
| С(А20), моль/л | 0,2 | 0,2 | 0,2 | 0,4 | 0,6 | 0,4 | 0,2 | 0,2 | 0,2 |
| С(А30), моль/л | 0 | 0 | 0 | 0 | 0 | 0,1 | 0 | 0 | 0 |
Найти кинетическое уравнение и параметры, адекватно описывающие экспериментальные кинетические зависимости. Предложить механизм реакции.
В опытах получены зависимости концентрации А2 от времени, представленные в таблице 2.
Таблица 2. Концентрации А2
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 1 | 0.119 | 0.081 | 0.05 | 0.032 | 0.021 | 0.013 | 0.005 | 0.002 |
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 2 | 0.13 | 0.082 | 0.052 | 0.031 | 0.021 | 0.014 | 0.006 | 0.002 |
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 3 | 0.122 | 0.078 | 0.051 | 0.034 | 0.022 | 0.014 | 0.006 | 0.002 |
| t,мин | 1.1 | 2.2 | 3.3 | 4.4 | 5.5 | 6.6 | 8.8 | 11 |
| опыт 4 | 0.248 | 0.145 | 0.096 | 0.063 | 0.039 | 0.025 | 0.01 | 0.004 |
| t,мин | 0.8 | 1.6 | 2.4 | 3.2 | 4 | 4.8 | 6.4 | 8 |
| опыт 5 | 0.414 | 0.291 | 0.224 | 0.154 | 0.123 | 0.084 | 0.051 | 0.029 |
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 6 | 0.261 | 0.163 | 0.107 | 0.075 | 0.048 | 0.032 | 0.014 | 0.007 |
| t,мин | 1.3 | 2.6 | 3.9 | 5.2 | 6.5 | 9.1 | 11.7 |
|
| опыт 7 | 0.148 | 0.101 | 0.072 | 0.054 | 0.038 | 0.02 | 0.012 |
|
| t,мин | 2.8 | 5.6 | 8.4 | 11.2 | 14 | 19.6 | 25.2 |
|
| опыт 8 | 0.143 | 0.103 | 0.08 | 0.057 | 0.045 | 0.024 | 0.014 |
|
| t,мин | 13 | 26 | 39 | 52 | 65 | 91 | 117 |
|
| опыт 9 | 0.139 | 0.097 | 0.077 | 0.054 | 0.04 | 0.024 | 0.015 |
|
Найти кинетическое уравнение и его параметры, адекватно описывающие экспериментальные кинетические зависимости. Предложить механизм реакции.
Определение вида кинетического уравнения
Определение текущих концентраций веществ
Найдем текущие концентрации всех веществ, участвующих в реакции, с помощью формулы: 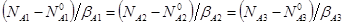 , где Ni – количество i-того вещества, β – стехиометрический коэффициент.
, где Ni – количество i-того вещества, β – стехиометрический коэффициент.
Для реагентов β = -1, а для продукта β = 1. В нашем случае, можно заменить количества веществ на их концентрации. Формула для расчета концентраций будет иметь вид: СА10-СА1 = СА20-СА2 = СА3-СА30. По экспериментально полученным зависимостям изменения концентрации А2 вычислим изменение концентрации остальных участников реакции. Результаты представлены в таблице 3.
Таблица 3.
| Опыт | Точки отбора | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| t, мин | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 | |
| 1 | С1, моль/л | 4 | 3.919 | 3.881 | 3.85 | 3.832 | 3.821 | 3.813 | 3.805 | 3.802 |
| С2, моль/л | 0.2 | 0.119 | 0.081 | 0.05 | 0.032 | 0.021 | 0.013 | 0.005 | 0.002 | |
| С3, моль/л | 0 | 0.081 | 0.119 | 0.15 | 0.168 | 0.179 | 0.187 | 0.195 | 0.198 | |
| t, мин | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 | |
| 2 | С1, моль/л | 4 | 3.93 | 3.882 | 3.852 | 3.834 | 3.822 | 3.814 | 3.806 | 3.802 |
| С2, моль/л | 0.2 | 0.13 | 0.082 | 0.052 | 0.031 | 0.021 | 0.014 | 0.006 | 0.002 | |
| С3, моль/л | 0 | 0.07 | 0.118 | 0.148 | 0.169 | 0.179 | 0.186 | 0.194 | 0.198 | |
| t, мин | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 | |
| 3 | С1, моль/л | 4 | 3.922 | 3.878 | 3.851 | 3.834 | 3.822 | 3.814 | 3.806 | 3.802 |
| С2, моль/л | 0.2 | 0.122 | 0.078 | 0.051 | 0.034 | 0.022 | 0.014 | 0.006 | 0.002 | |
| С3, моль/л | 0 | 0.078 | 0.122 | 0.149 | 0.166 | 0.178 | 0.186 | 0.194 | 0.198 | |
| t, мин | 0 | 1.1 | 2.2 | 3.3 | 4.4 | 5.5 | 6.6 | 8.8 | 11 | |
| 4 | С1, моль/л | 4 | 3.848 | 3.745 | 3.696 | 3.663 | 3.639 | 3.625 | 3.61 | 3.604 |
| С2, моль/л | 0.4 | 0.248 | 0.145 | 0.096 | 0.063 | 0.039 | 0.025 | 0.01 | 0.004 | |
| С3, моль/л | 0 | 0.152 | 0.255 | 0.304 | 0.337 | 0.361 | 0.375 | 0.39 | 0.396 | |
| t, мин | 0 | 0.8 | 1.6 | 2.4 | 3.2 | 4 | 4.8 | 6.4 | 8 | |
| 5 | С1, моль/л | 4 | 3.814 | 3.691 | 3.624 | 3.554 | 3.523 | 3.484 | 3.451 | 3.429 |
| С2, моль/л | 0.6 | 0.414 | 0.291 | 0.224 | 0.154 | 0.123 | 0.084 | 0.051 | 0.029 | |
| С3, моль/л | 0 | 0.186 | 0.309 | 0.376 | 0.446 | 0.477 | 0.516 | 0.549 | 0.571 | |
| t, мин | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 | |
| 6 | С1, моль/л | 4 | 3.861 | 3.763 | 3.707 | 3.675 | 3.648 | 3.632 | 3.614 | 3.607 |
| С2, моль/л | 0.4 | 0.261 | 0.163 | 0.107 | 0.075 | 0.048 | 0.032 | 0.014 | 0.007 | |
| С3, моль/л | 0.1 | 0.239 | 0.337 | 0.393 | 0.425 | 0.452 | 0.468 | 0.486 | 0.493 | |
| t, мин | 0 | 1.3 | 2.6 | 3.9 | 5.2 | 6.5 | 9.1 | 11.7 |
| |
| 7 | С1, моль/л | 3 | 2.948 | 2.901 | 2.872 | 2.854 | 2.838 | 2.82 | 2.812 |
|
| С2, моль/л | 0.2 | 0.148 | 0.101 | 0.072 | 0.054 | 0.038 | 0.02 | 0.012 |
| |
| С3, моль/л | 0 | 0.052 | 0.099 | 0.128 | 0.146 | 0.162 | 0.18 | 0.188 |
| |
| t, мин | 0 | 2.8 | 5.6 | 8.4 | 11.2 | 14 | 19.6 | 25.2 |
| |
| 8 | С1, моль/л | 2 | 1.943 | 1.903 | 1.88 | 1.857 | 1.845 | 1.824 | 1.814 |
|
| С2, моль/л | 0.2 | 0.143 | 0.103 | 0.08 | 0.057 | 0.045 | 0.024 | 0.014 |
| |
| С3, моль/л | 0 | 0.057 | 0.097 | 0.12 | 0.143 | 0.155 | 0.176 | 0.186 |
| |
| t, мин | 0 | 13 | 26 | 39 | 52 | 65 | 91 | 117 |
| |
| 9 | С1, моль/л | 1 | 0.939 | 0.897 | 0.877 | 0.854 | 0.84 | 0.824 | 0.815 |
|
| С2, моль/л | 0.2 | 0.139 | 0.097 | 0.077 | 0.054 | 0.04 | 0.024 | 0.015 |
| |
| С3, моль/л | 0 | 0.061 | 0.103 | 0.123 | 0.146 | 0.16 | 0.176 | 0.185 |
|
Определение вида кинетического уравнения и порядков реакции по реагентам
Итоговый вид кинетического уравнения
Обобщая данные п. 3.1.-3.2., можем сделать вывод, что кинетическое уравнение данной реакции имеет вид:
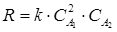
Определение параметров кинетического уравнения. Проверка адекватности модели
Выбор функции для обработки
При описании кинетического уравнения полиномом первой степени теряется физический смысл: скорость реакции постоянна в любой момент времени. Используя полином второй степени можем получить отрицательные концентрации при бесконечном времени реакции. Для описания экспериментальной зависимости выберем полином третьей степени, так как он наипростейший из не противоречащих физическому смыслу.
В общем случае полиномиальная зависимость будет иметь вид:
С2 = b0 + b1∙t + b2∙t2 + b3∙t3.
Заменив С2 на у, t на хi, где индекс i соответствует степени t, получим:
у = b0x0 + b1x1+b2x2 + b3x3.
Значение константы скорости
Значение константы скорости представляется в виде: К = К ± ∆ .
К = 0,03180 ± 0,01496
Для сравнения представим значение константы скорости, рассчитанное по опытам №№ 1-3:
k = 0,04564 ± 0,00222.
По сравнению с результатами для трех первых опытов, ошибка определения константы скорости для всего эксперимента увеличилась на порядок.
Механизм реакции
Вариант 4
Выполнил: Степанов В.Н.
Проверил: Темкин О.Н.
Москва, 2007г.
Оглавление
Определение вида кинетического уравнения
1. Определение текущих концентраций веществ
2. Определение начальных скоростей
3. Определение вида кинетического уравнения и порядков реакции по реагентам
4. Определение константы скорости реакции k по первым 3-м опытам
4.1 Последовательность обработки регрессионным методом
4.2 Выбор функции для обработки
4.3 Определение коэффициентов полинома
4.4 Проверка адекватности полученной модели и расчет константы скорости
4.6Значение константы скорости, рассчитанное по опытам №№ 1-3
5. Расчет констант скорости по остальным опытам
5.2Обработка кинетического уравнения
6. Оценка значимости найденного значения константы скорости. Определение доверительного интервала
6.1 Определение дисперсии константы скорости
6.2 Оценка значимости параметра модели
6.3 Определение доверительного интервала
6.4 Значение константы скорости
7. Итоговый вид кинетического уравнения
Задание
При исследовании кинетики реакции: PhNH2 (A1) + PhC ≡ CH (A2)→ PhNC(Ph)=CH2 (A3)
в растворе хлорбензола реализован следующий эксперимент (400С):
В опытах получены следующие зависимости концентрации (в моль/л) А2 от времени:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| С(А10), моль/л | 4 | 4 | 4 | 4 | 4 | 4 | 3 | 2 | 1 |
| С(А20), моль/л | 0,2 | 0,2 | 0,2 | 0,4 | 0,6 | 0,4 | 0,2 | 0,2 | 0,2 |
| С(А30), моль/л | 0 | 0 | 0 | 0 | 0 | 0,1 | 0 | 0 | 0 |
Найти кинетическое уравнение и параметры, адекватно описывающие экспериментальные кинетические зависимости. Предложить механизм реакции.
В опытах получены зависимости концентрации А2 от времени, представленные в таблице 2.
Таблица 2. Концентрации А2
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 1 | 0.119 | 0.081 | 0.05 | 0.032 | 0.021 | 0.013 | 0.005 | 0.002 |
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 2 | 0.13 | 0.082 | 0.052 | 0.031 | 0.021 | 0.014 | 0.006 | 0.002 |
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 3 | 0.122 | 0.078 | 0.051 | 0.034 | 0.022 | 0.014 | 0.006 | 0.002 |
| t,мин | 1.1 | 2.2 | 3.3 | 4.4 | 5.5 | 6.6 | 8.8 | 11 |
| опыт 4 | 0.248 | 0.145 | 0.096 | 0.063 | 0.039 | 0.025 | 0.01 | 0.004 |
| t,мин | 0.8 | 1.6 | 2.4 | 3.2 | 4 | 4.8 | 6.4 | 8 |
| опыт 5 | 0.414 | 0.291 | 0.224 | 0.154 | 0.123 | 0.084 | 0.051 | 0.029 |
| t,мин | 1 | 2 | 3 | 4 | 5 | 6 | 8 | 10 |
| опыт 6 | 0.261 | 0.163 | 0.107 | 0.075 | 0.048 | 0.032 | 0.014 | 0.007 |
| t,мин | 1.3 | 2.6 | 3.9 | 5.2 | 6.5 | 9.1 | 11.7 |
|
| опыт 7 | 0.148 | 0.101 | 0.072 | 0.054 | 0.038 | 0.02 | 0.012 |
|
| t,мин | 2.8 | 5.6 | 8.4 | 11.2 | 14 | 19.6 | 25.2 |
|
| опыт 8 | 0.143 | 0.103 | 0.08 | 0.057 | 0.045 | 0.024 | 0.014 |
|
| t,мин | 13 | 26 | 39 | 52 | 65 | 91 | 117 |
|
| опыт 9 | 0.139 | 0.097 | 0.077 | 0.054 | 0.04 | 0.024 | 0.015 |
|
Найти кинетическое уравнение и его параметры, адекватно описывающие экспериментальные кинетические зависимости. Предложить механизм реакции.
Определение вида кинетического уравнения
Дата: 2019-05-28, просмотров: 304.