Нитрование углеводородов.

Ароматические нитросоединения получают, как правило, прямым нитрованием аренов и ароматических гетероциклических соединений. Нитрометан также может быть получен нитрованием метана.
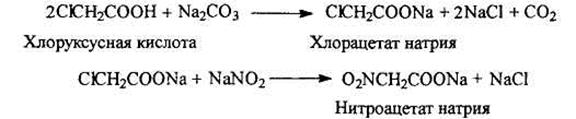
Синтез нитросоединений из галогенуглеводородов

Синтез нитрометана из хлоруксусной кислоты
Нитрометан обычно получают из хлоруксусной кислоты по следующей схеме:
Реакции нитросоединений
Таутомерия алифатических нитросоединений
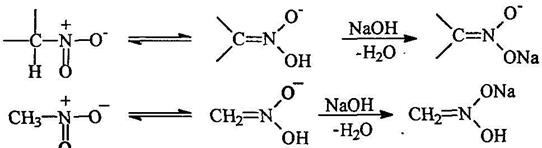

 Вследствие сильных электроноакцепторных свойств нитрогруппы а-атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами.
Вследствие сильных электроноакцепторных свойств нитрогруппы а-атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами.
Конденсация алифатических нитросоединений с альдегидами
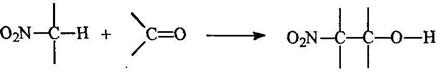
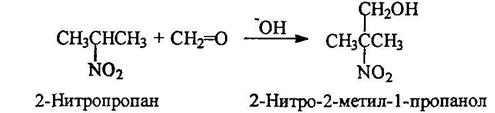
Практическое значение имеет триметилолнитрометан, получаемый из нитрометана и формальдегида:
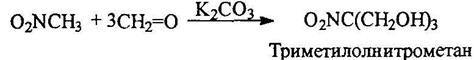
Ароматические нитросоальдегиды конденсируются с нитрометаном с отщеплением воды:
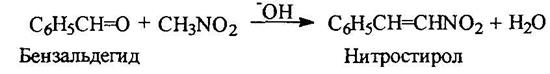
Восстановление нитросоединений.
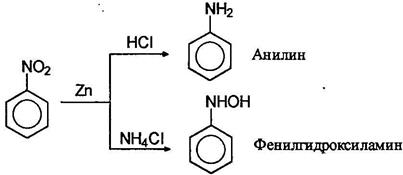
Важнейшее практическое значение имеют реакции восстановления нитрогруппы в нитроаренах. В зависимости от рН среды и используемого восстановителя могут быть получены различные продукты. В нейтральной и щелочной среде активность обычных восстанавливающих агентов по отношению к нитро соединениям меньше, чем в кислой среде. Характерным примером может служить восстановление нитробензола цинком. В избытке соляной кислоты цинк восстанавливает нитробензол в анилин, в то время как в буферном растворе аммонийхлорида - в фенилгидроксиламин:
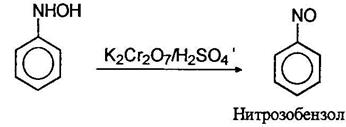
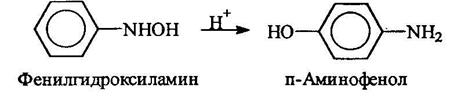
Фенилгидроксиламин далее может быть окислен до нитрозобензола:
Восстановлением нитробензола хлоридом олова (II) получают азобензол, а цинком в щелочной среде - гидразобензол; восстановлением спиртом в щелочной среде можно получить азоксибензол:
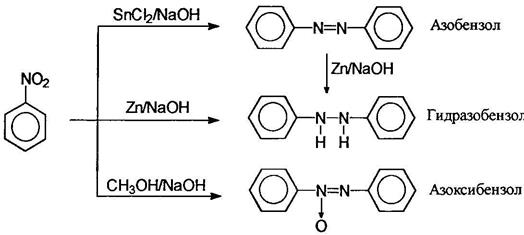
Азоксибензол получают обработкой нитробензола раствором щелочи в метаноле, при этом метанол окисляется в муравьиную кислоту. В кислой среде арилгидроксиламины подвергаются перегруппировке:
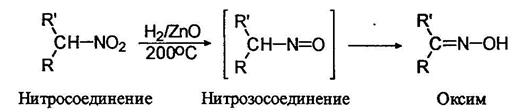
Известны методы неполного восстановления и нитроалканов:
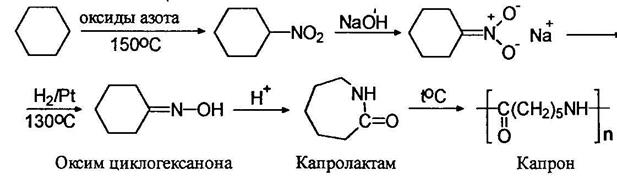
На этом основан один из промышленных методов получения капрона. Нитрованием циклогексана получают нитроциклогексан, который восстановлением переводят в оксим циклогексанона и далее с помощью перегруппировки Бекмана – в капролактам и полиамид – исходное вещество для приготовления волокна – капрона:
Амины
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил или ариламины.
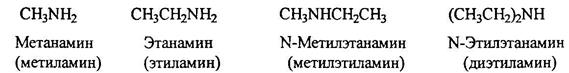
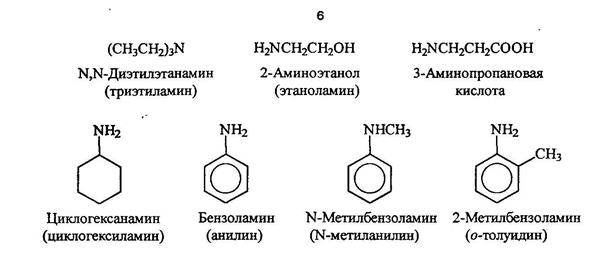
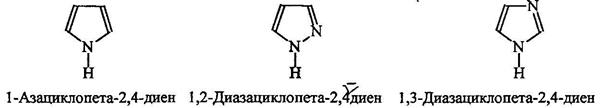
Гетероциклические амиы называют по соответствующему углеводороду вставляя приставку аза-, диаза- или триаза для обозачения количества атомов азота.
Аминами являются многие биологически активные соединения, обладающие, например, физиологическим и психологическим действием. Некоторые из них являются производными 2-фенилэтиламинна. Амфетамин является мощным стимулятором. Мескалин является галюциногеном.
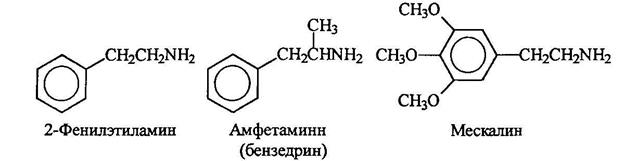
Адреналин и норадреналин являются гормонами, поступающими в кровь, когда животные ощущают опасность. Адреналин вызывает повышение кровяного давления, учащение пульса и расширение подходов к легким. Норадреналин также повышает кровяное давление. Он участвует в передаче импульса от ондого конца нервного волокна к другому.
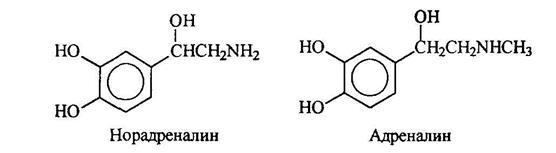
Серотонин поддерживает нормальный уровень умственной деятельности. Предполагается, что шизофрения связана с нарушением метаболизма серотонина.
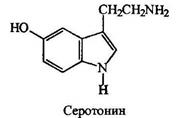
Основность аминов
Аммиак и амины благодаря наличию на их атомах азота неподеленной пары электронов обладают нуклеофильными свойствами, т.е. предоставляют эту пару обедненному электронами атому углерода. Они способны предоставлять ее и протону, т.е. обладать основностью.
Все простейшие алифатические амины взаимодействуя с водой генерируют гидроксид-анион и, следовательно, окрашивают лакмус в синий цвет:
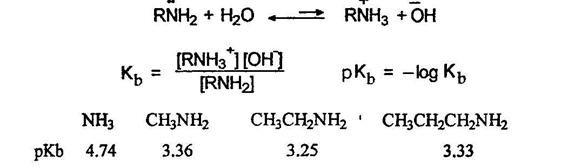
Подобно аммиаку амины при действии минеральных кислот превращаются в соли:
Основные свойства аминов обусловлены способностью свободных (неподеленных) электронов атомов азота присоединять протон.

Основность аминов тем выше, чем больше электронная плотность на атоме азота (чем выше электронодонорный характер атома азота).
Алифатические амины - более сильные основания, чем аммиак, поскольку алкильные группы обладают +1-эффектом. Их основность последовательно возрастает при переходе от первичных аминов ко вторичным, но несколько падает при переходе к третичным.
Нуклеофильность и основность аминов изменяются, как правило, симбатно: они уменьшаются с уменьшением электроннной плотности на атоме азота или при его пространственном экранировании и увеличиваются с увеличением электронной плотности на атоме азота или с увеличением его доступности. В качестве примера можно привестиосновность метиламинов. По силе основности они располагаются в следующий ряд:
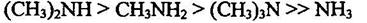
Влияние пространственного фактора на основность и на нуклеофильность аминов наглядно демонстрируется сравнением свойств некоторых вторичных аминов.
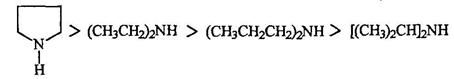
Анилин и другие ароматические амины являются слабыми основаниями. В отличие от алифатических аминов они не окрашивают водные растворы лакмуса в синий цвет, т.е. не генерируют гидроксид-анион при взаимодействии с водой. Анилин не образует солей с такими слабыми кислотами, как угольная, синильная, сероводород и др. Гидрохлорид анилина гидролизуется в воде, а сульфат анилина в воде не растворим.
Методы получения
Дата: 2019-05-28, просмотров: 354.