АМИЛОВЫЙ ЭФИР АЗОТИСТОЙ КИСЛОТЫ
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
Введение
Общие сведения
Практическое применение
Амилнитрит, как противоядие при отравлениях
Проблема нитратов и нитритов
Методика синтеза
Литературный обзор.
Неорганические нитриты
Органические нитриты
Нитросоединения
Способы получения нитросоединений
Реакции нитросоединений
Амины
Основность аминов
Методы получения
Реакции аминов
Диазо- и азосоединения
Реакции солей арилдиазония
Выводы
Список литературы
Введение
Общие сведения
Амилнитрит C5H11NO2 (изоамиловый эфир азотистой кислоты). Молекулярная масса (в а. е. м.): 117,15. Температура кипения (в °C): 104. Прозрачная желтоватая, легкоподвижная, весьма летучая жидкость фруктового запаха. Легко воспламеняется. Очень мало растворим в воде; смешивается во всех соотношениях со спиртом, эфиром, хлороформом. Плотность 0,8528 (20°C, г/см3).
Практическое применение
Амилнитрит, как противоядие при отравлениях
Амилнитрит является основным представителем органических нитритов. Еще в конце 60-х годов прошлого века было обнаружено свойство этого соединения вызывать при вдыхании паров расширение кровеносных сосудов и купировать приступы грудной жабы (стенокардии). Уже в те годы было рекомендовано больным грудной жабой смачивать кусочек ткани несколькими каплями (5 – 10) амилнитрита и вдыхать его пары. Препарат начинал действовать через 30 - 60 с. Одновременно с прекращением загрудинных болей отмечалось покраснение лица и развивалась головная боль (в связи с расширением сосудов мозга). С появлением нитроглицерина и обнаружением его эффективности при стенокардии, амилнитрит в связи с выраженными побочными явлениями и кратковременностью действия, стали назначать реже. В настоящее время амилнитрит как антиангинальное средство практически не применяется. Лишь в исключительных случаях, при отсутствии других антиангинальных средств, он может быть временно использован для купирования приступов стенокардии. Вместе с тем амилнитрит, нашел применение как противоядие при отравлении синильной кислотой и ее солями, что объясняется способностью амилнитрита (и других нитритов) образовывать в крови метгемоглобин, связывающий ион СN, и предупреждать этим поражения тканевых дыхательных ферментов. Применяют амилнитрит путем вдыхания после нанесения его на носовой платок, небольшой кусок ваты или марли. Назначают взрослым по 2 - 3 капли, детям (старше 5 лет) - по 1 – 2 капли. Высшие дозы для взрослых (для вдыхания): разовая 0,1 мл (6 капель); суточная 0,5 мл (30 капель). При отравлениях цианидами его применяют повторно в указанных выше дозах (до общей дозы 0,5 – 1 мл). Противопоказания такие же, как для нитроглицерина. Форма выпуска: в обычных ампулах и в ампулах с ватно-марлевой оплеткой (по 0,5 мл). Вскрытие ампул сопровождается легким взрывом в связи с давлением паров, образующихся в ампуле при хранении и нагревании. Пары амилнитрита образуют с воздухом взрывоопасные смеси. Хранение: список Б. В запаянных ампулах в прохладном, защищенном от света месте.
Методика синтеза
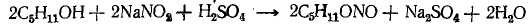
Реактивы: амиловый спирт 77 г, нитрит натрия 38 г, серная кислота концентрированная 25 г, бикарбонат натрия 1 г, сульфат натрий, безводный 1 г, хлористый натрий.
Аппаратура.
Колба круглодонная, трехгорлая емк. 500 мл. Воронка капельная. Воронка Бюхнера. Прибор для перегонки в вакууме. Мешалка.
В круглодонную трехгорлую колбу, снабженную мешалкой, капельной воронкой и термометром, достигающим почти до дна колбы, помещенную в охладительную смесь, вливают раствор 38 г (0,55 моля) нитрита натрия в 150 мл воды. Когда температура раствора понизится до 0°, к нему по каплям приливают смесь 15 мл воды, 25 г (0,5 моля) концентрированной серной кислоты и 77 г (0,5 моля) амилового спирта. Колебания температуры не должны превышать ± 1°, приливание смеси к раствору нитрита длится около 2 часов. После 15-часового стояния отфильтровывают выделившийся осадок сульфата натрия, в делительной воронке отделяют слегка желтоватый слой амилнитрита от воды (примечание 1), промывают его раствором бикарбоната натрия, раствором хлористого натрия, сушат безводным сульфатом натрия и перегоняют в вакууме: т. кип. 29°/40 мм рт. ст., 104°/760 мм рт. ст.
Выход – 45 г (80% от теоретического).
Примечание
Вдыхание паров амилнитрита вызывает головные боли и боли в сердце. Его следует хранить в сухом и холодном месте не более двух недель с момента получения. Продукты разложения амилнитрита содержат воду, окислы азота, амиловый спирт и полимеры валерианового альдегида
Литературный обзор.
Неорганические нитриты
Неорганические нитриты, соли азотистой кислоты HNO2. Используют прежде всего нитриты щелочных металлов и аммония, меньше – щелочно-земельных и Зd-металлов, Рb и Ag. О нитритах остальных металлов имеются только отрывочные сведения.
Нитриты металлов в степени окисления +2 образуют кристаллогидраты с одной, двумя или четырьмя молекулами воды. Нитриты образуют двойные и тройные соли, напр. CsNO2xAgNO3 или Ba(NO2)2•Ni(NO2)2•2KNO3, а также комплексные соединения, например Na3[Co(NO2)6].
Кристаллические структуры известны лишь для нескольких безводных нитритов. Анион NО2-- имеет нелинейную конфигурацию; угол ONO 115°, длина связи N—О 0,115 нм; тип связи М—NО2 ионно-ковалентный.
СВОЙСТВА НЕКОТОРЫХ НЕОРГАНИЧЕСКИХ НИТРИТОВ
Показатель KNO2 AgNO2 Ca(NO2)2 Ba(NO2)2
Сингония Моноклинная Ромбическая Кубическая Гексагональная
Темп. пл., °С 440 120 220 277
(с разд.) (с разл.)
Р-римость
в воде,г в 100 г 306,7 0,41 84,5 67,5
(20°С) (25°С) (18°С) (20°С)
Хорошо растворимы в воде нитриты К, Na, Ва, плохо – нитриты Ag, Hg, Сu. С повышением температуры растворимость нитритов увеличивается. Почти все нитриты плохо растворимы в спиртах, эфирах и малополярных растворителях.
Нитриты термически малоустойчивы; плавятся без разложения только нитриты щелочных металлов, нитриты остальных металлов разлагаются при 25-300°С. Механизм разложения нитриты сложен и включает ряд параллельно-последовательных реакций. Основные газообразные продукты разложения – NO, NO2, N2 и О2, твердые – оксид металла или элементный металл. Выделение большого количества газов обусловливает взрывное разложение некоторых нитритов, например NH4NO2, который разлагается на N2 и Н2О.
Характерные особенности нитритов связаны с их термической нестойкостью и способностью нитрит-иона быть как окислителем, так и восстановителем, в зависимости от среды и природы реагентов. В нейтральной среде нитриты обычно восстанавливаются до NO, в кислой окисляются до нитратов. Кислород и СО2 не взаимодействуют с твердыми нитритами и их водными растворами. Нитриты способствуют разложению азотсодержащих органических веществ, в частности аминов, амидов и др. С органическими галогенидами RX нитриты реагируют с образованием как нитритов RONO, так и нитросоединений RNO2.
Промышленное получение нитритов основано на абсорбции нитрозного газа (смеси NO + NO2) растворами Na2CO3 или NaOH с послед, кристаллизацией NaNO2; нитриты остальных металлов в промышленности и лабораториях получают обменной реакцией солей металлов с NaNO2 или восстановлением нитратов этих металлов.
Анализ нитритов на нитрит-ион основан на его восстановлении сплавом Деварда (50% Сu, 45% А1, 5% Zn) до NH3 и поглощении NH3 титрованными растворами кислот.
Нитриты применяют для синтеза азокрасителей, в производстве капролактама, в качестве окислителей и восстановителей в резинотехнике, текстильной и металлообрабатывающей промышленности, как консерванты пищевых продуктов. Нитриты, например NaNO2 и KNO2, токсичны, вызывают головную боль, рвоту, угнетают дыхание и т.д. При отравлении NaNO2 в крови образуется метгемоглобин, повреждаются мембраны эритроцитов. Возможно образование нитрозаминов из NaNO2 и аминов непосредственно в желудочно-кишечном тракте.
Органические нитриты
Органические нитриты, эфиры азотистой кислоты HNO2. Содержат одну или несколько групп —О—N=O, связанных ковалентной связью с атомом углерода органического радикала. Низшие алкилнитриты – газы, остальные – бесцветные или желтоватые жидкости, не растворимые в воде, смешиваются с обычными органическими растворителями. Органические нитриты более летучи, чем изомерные им нитросоединения. Физические свойства некоторых органические нитритов приведены в таблице.
СВОЙСТВА НЕКОТОРЫХ ОРГАНИЧЕСКИХ НИТРИТОВ
Соединение Т.кип, °С 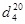
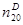
Метилнитрит CH3ONO - 12 0,991
Пропилнитрит C3H7ONO 48,5 0,935 1,3604
Бутилнитрит C4H9ONO 77,8 0,8823 1,3768
Изобутилнитрит C4H9ONO 67 0,8699 1,3715
Изопентилнитрит (изоамил-
нитрит) (CH3)2CHCH3CH2ONO 99,2 0,8828 1,3918
Вращение вокруг связи О—N заметно заторможено (барьер вращения ∆G* 34 кДж/моль), поэтому s-циc- и s-транс-конформеры спектрально различимы. ИК спектр органических нитритов имеет характеристические полосы 1613-1625 и 1653-1681 см-1 (N=O) соотв. для s-цис- и s-транс-форм.
При комнатной температуре органические нитриты медленно разлагаются, на свету низшие органические нитриты могут взрываться. В кислой среде легко гидролизуются; это позволяет использовать органические нитриты в качестве мягких нитрозирующих агентов (для получения малостабильных солей диазония, дезаминирования алкиламинов, нитрозирования фенолов и СН-кислот и т.п.). Органические нитриты, имеющие активированный атом Н при β-углеродном атоме, могут отщеплять HNO2, например:
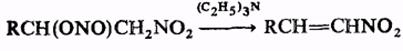
При действии N2O5 органические нитриты окисляются в нитраты, при действии гидразина или LiAlH4 восстанавливаются в соответствующие спирты. Органических нитриты, содержащие в молекуле более трех атомов С, претерпевают фотохимическую перегруппировку в нитрозосоединения (Бартона реакция), напр.:
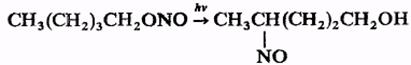
Реакция идет стереоселективно и используется для введения функциональных групп в неактивные участки сложных молекул, например, стероидов.
Получают органические нитриты взаимодействием спиртов с различными нитрозирующими агентами [NaNO2/H2SO4, NaNO2/Al2(SO4)3, оксиды азота, NOCl/пиридин, NOBF4] или взаимодействием алкилгалогенидов с солями HNO2 (наряду с нитросоединениями).
Органические нитриты – высокотоксичные соединения. Этил- и пентилнитриты учащают пульс, понижают кровяное давление, окисляют гемоглобин в метгемоглобин. Органических нитриты обладают сосудорасширяющим и спазмолитическим действием. Изопентилнитрит - противоядие при отравлении синильной кислотой и ее солями.
Органические нитриты – полупродукты в органическом синтезе.
Нитросоединения
Нитросоединениями называют производные углеводородов, в которых один или несколько атомов водорода замещены на нитрогруппу -NO2. В зависимости от углеводородного радикала, к которому присоединена нитрогруппа, нитросоединения делятся на ароматические и алифатические. Алифатические соединения различают как первичные 1°, вторичные 2 ° и третичные 3°, в зависимости от того к 1 °, 2 ° или 3° атому углерода присоединена нитрогруппа.
Нитрогруппу не следует путать с нитритной группой -ONO. Нитрогруппа имеет следующее строение:
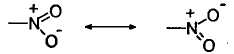
Наличие полного положительного заряда на атоме азота обусловливает наличие у нее сильного -1-эффекта. Наряду с сильным -1-эффектом нитрогруппа обладает сильным -М-эффектом.
Нитрование углеводородов.

Ароматические нитросоединения получают, как правило, прямым нитрованием аренов и ароматических гетероциклических соединений. Нитрометан также может быть получен нитрованием метана.
Реакции нитросоединений
Амины
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил или ариламины.
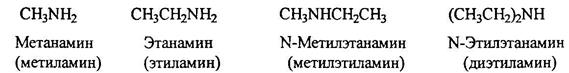
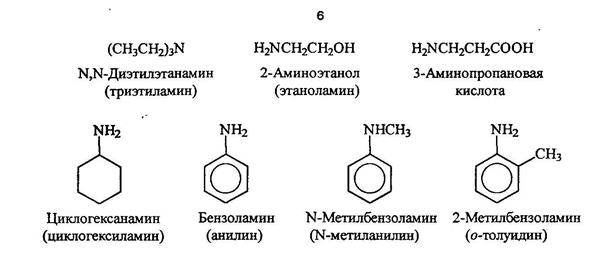
Гетероциклические амиы называют по соответствующему углеводороду вставляя приставку аза-, диаза- или триаза для обозачения количества атомов азота.
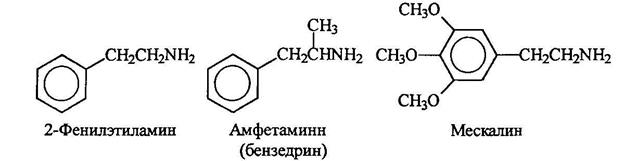
Аминами являются многие биологически активные соединения, обладающие, например, физиологическим и психологическим действием. Некоторые из них являются производными 2-фенилэтиламинна. Амфетамин является мощным стимулятором. Мескалин является галюциногеном.
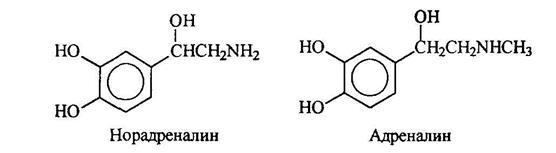
Адреналин и норадреналин являются гормонами, поступающими в кровь, когда животные ощущают опасность. Адреналин вызывает повышение кровяного давления, учащение пульса и расширение подходов к легким. Норадреналин также повышает кровяное давление. Он участвует в передаче импульса от ондого конца нервного волокна к другому.
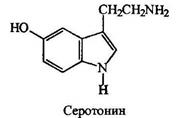
Серотонин поддерживает нормальный уровень умственной деятельности. Предполагается, что шизофрения связана с нарушением метаболизма серотонина.
Основность аминов
Аммиак и амины благодаря наличию на их атомах азота неподеленной пары электронов обладают нуклеофильными свойствами, т.е. предоставляют эту пару обедненному электронами атому углерода. Они способны предоставлять ее и протону, т.е. обладать основностью.
Все простейшие алифатические амины взаимодействуя с водой генерируют гидроксид-анион и, следовательно, окрашивают лакмус в синий цвет:
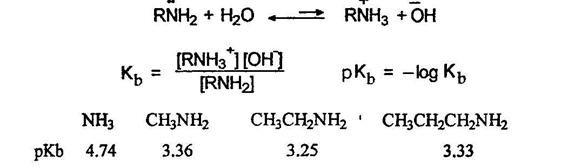
Подобно аммиаку амины при действии минеральных кислот превращаются в соли:
Основные свойства аминов обусловлены способностью свободных (неподеленных) электронов атомов азота присоединять протон.

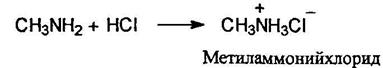
Основность аминов тем выше, чем больше электронная плотность на атоме азота (чем выше электронодонорный характер атома азота).
Алифатические амины - более сильные основания, чем аммиак, поскольку алкильные группы обладают +1-эффектом. Их основность последовательно возрастает при переходе от первичных аминов ко вторичным, но несколько падает при переходе к третичным.
Нуклеофильность и основность аминов изменяются, как правило, симбатно: они уменьшаются с уменьшением электроннной плотности на атоме азота или при его пространственном экранировании и увеличиваются с увеличением электронной плотности на атоме азота или с увеличением его доступности. В качестве примера можно привестиосновность метиламинов. По силе основности они располагаются в следующий ряд:
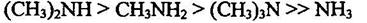
Влияние пространственного фактора на основность и на нуклеофильность аминов наглядно демонстрируется сравнением свойств некоторых вторичных аминов.
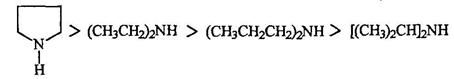
Анилин и другие ароматические амины являются слабыми основаниями. В отличие от алифатических аминов они не окрашивают водные растворы лакмуса в синий цвет, т.е. не генерируют гидроксид-анион при взаимодействии с водой. Анилин не образует солей с такими слабыми кислотами, как угольная, синильная, сероводород и др. Гидрохлорид анилина гидролизуется в воде, а сульфат анилина в воде не растворим.
Методы получения
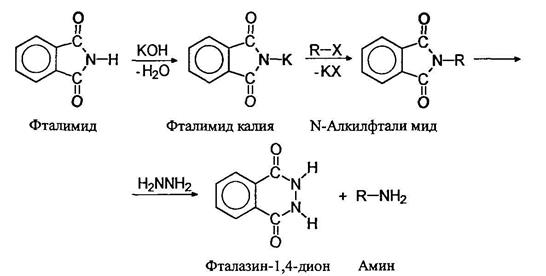
Фталимидный метод Габриэля.
Аммонолиз алкилгалогенидов и алкилирование аммика спиртами приводят к образованию смесей аминов, разделение которых представляет большую трудность. Индивидуальные первичные амины можно получать фталимидным методом Габриэля:
Восстановление алкилазидов
Восстановление алкилазидов, получаемых взаимодействием алкилгалогенидов с азидом натрия также приводит к образованию индивидуальных первичных аминов:
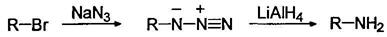
Реакции аминов
Алкилирование алкилгалогенидами (реакция Меншуткина)
Амины бурно реагируют с алкилгалогенидами, образуя смеси аминов и солей четвертичных аммониевых оснований:

Соли четвертичных аммониевых оснований переводят в щелочной среде в сами основания. Последние можно выделить, обрабатывая соль четвертичного аммониевого основания влажным оксидом серебра:

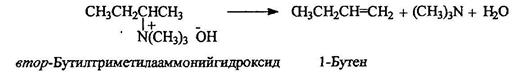
Термическое разложение четвертичных аммониевых оснований (по Гофману) приводит к образованию алкенов с крайним расположением двойной связи:
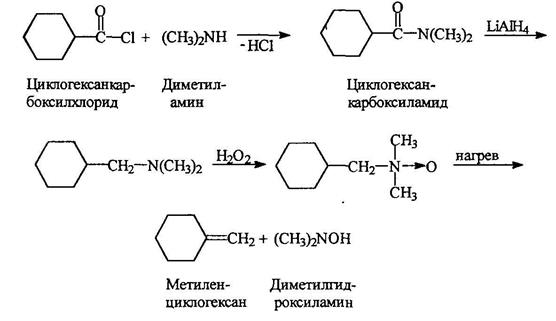
Окисление
Третичные амины могут быть окислены пероксидом вродорода или надкислотами в N-оксиды:

Реакция проводится в метаноле при обычной температуре. При нагревании N-оксиды расщепляются с образованием алкена и дизамещенного гидроксиламина:
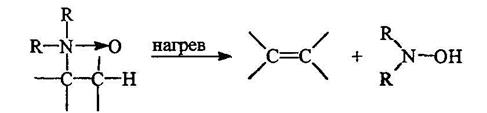
При этом метильные группы при атоме азота не затрагиваются. Этим пользуются при получении алкенов определенного строения (реакция Коупа):
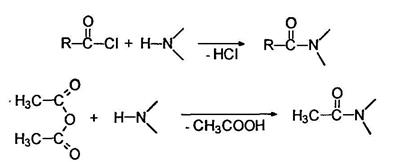
Ацилирование
Подобно аммиаку первичные и вторичные амины реагируют с ацильными соединениями:
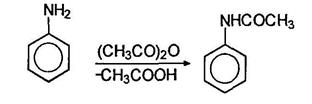
Так, при действии на анилин уксусного ангидрида образуется ацетанилид:
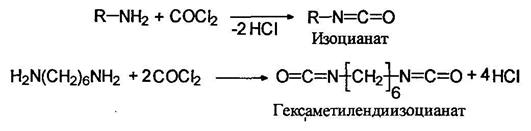
Изоцианаты
При действием на первичные амины фосгена (фосгенирование) образуются изоцианаты:
В последнее время изоцианаты стали получать действием на нитро со единения окиси углерода в присутствии катализатора:
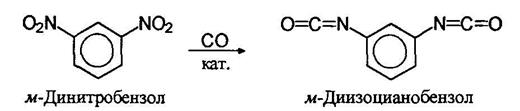
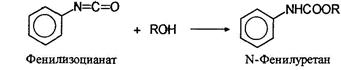
При взаимодействии изоцианатов со спиртами образуются карбаматы или уретаны:
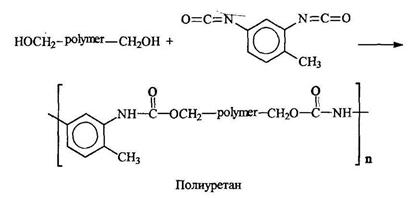


 Эластомерное волокно лайкра (спандекс) получают при переработке полиуретана, синтезируемого из гексаметилендиизоцианата и 1,4-бутандиола:
Эластомерное волокно лайкра (спандекс) получают при переработке полиуретана, синтезируемого из гексаметилендиизоцианата и 1,4-бутандиола:
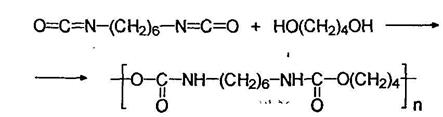
Образование шиффовых оснований
При слабом нагревании ароматических первичных аминов с ароматическими альдегидами легко получаются так называемые основания Шиффа. В такую же реакцию первичные амины вступают не только с альдегидами, но и с некоторыми кетонами. Общее название образующихся продуктов - азометины. При действии разбавленных кислот азометины подвергаются гидролизу.
Диазо- и азосоединения
Органические соединения, содержащие в молекуле два атома азота, связанные кратной связью и не входящие в циклическую систему, могут относиться как к азо-, так и диазо соединениям. В случае диазосоединений два атома азота соединены лишь с одним углеводородным радикалом Ar-N2+Cr, а в случае азосоединений - с двумя Ar-N=N-Ar Азосоединения интенсивно окрашены. В зависимости от структуры молекулы они могут быть окрашены в интенсивно желтый, оранжевый, красный, синий или даже зеленый цвет. Примерно половина используемых в настоящее время красителей являются азокрасителями. Диазосо единения называют как соли арилдиазониев. Азосоединения называют двумя путями - как производные азобензола;
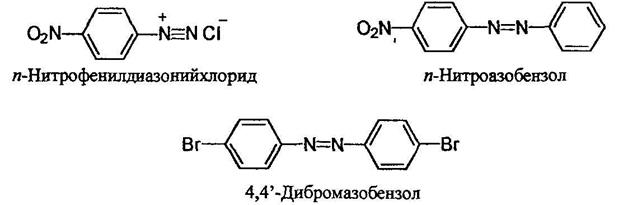
Более сложные соединения называют, рассматривая арилазогруппу Ar-N=N- как заместитель:
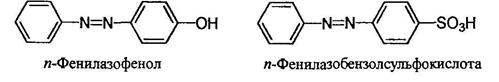
Реакции солей арилдиазония
Все реакции солей арилдиазониев можно разделить на две группы: реакции с выделением азота и реакции без выделения азота.
Реакции замещения
Диазогруппа может быть замещена на разнообразные группы, это является одним из самых лучших путей введения функциональных групп в ароматическое ядро:
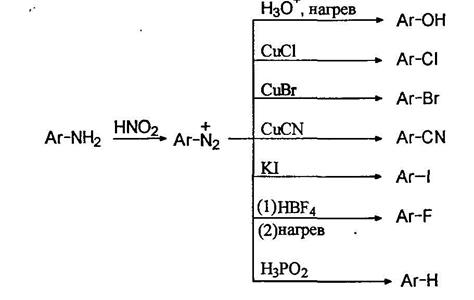
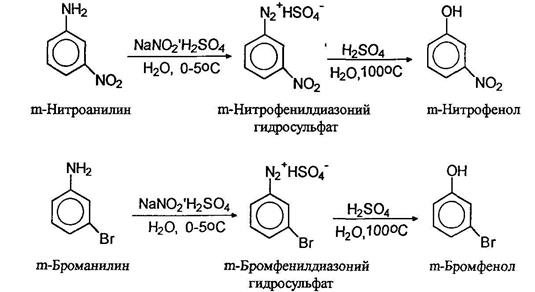
При нагревании водных растворов сульфатов диазониев происходит отщепление азота и образуются фенолы. Таким образом можно получать фенолы с различными заместителями в ароматическом кольце, например:
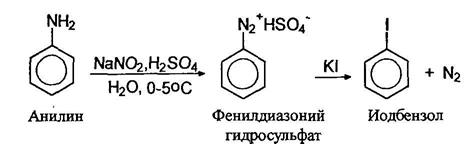
Соли арилдиазониев реагируют с иодидами натрия или калия образуя арилиодиды:
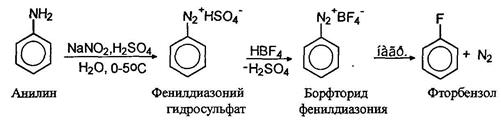
Для замещения диазогруппы на фтор к раствору соли диазония прибавляют тетрафторборную кислоту, при этом осаждается борфториды диазония, которые отфильтровывают, промывают и сушат. При осторожном нагревании борфториды диазония разлагаются с образованием арилфторидов:
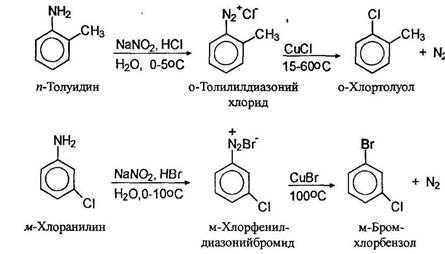
Замещение диазогруппы на хлор и бром осуществляется действием на свежеприготовленный раствор соли диазония хлоридом или бромидом одновалентной меди. Считают, что реакция проходит по радикальному механизму (реакция Зандмеера):
Замещение диазогруппы на нитрильную осуществляется также по реакции Зандмеера использованием цианида одновалентной меди.
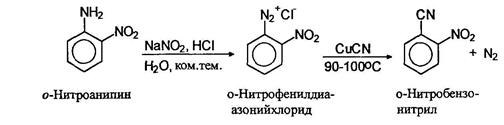
Вместо солей меди (I) в качестве катализатора можно использовать свежеосажденную порошкообразную металлическую медь.
Азосочетание
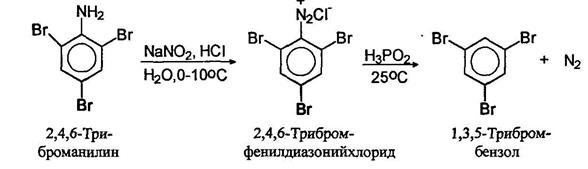
Замещение диазогруппы на водород можно осуществлять с помощью нескольких реагентов. Наиболее широкое применение получила фосфорноватистая (гипофосфористая) кислота. Соли диазония просто оставляют стоять в присутствии фосфорноватистой кислоты. С помощью этой оеакпии удаляют аминогруппу с ароматического кольца.
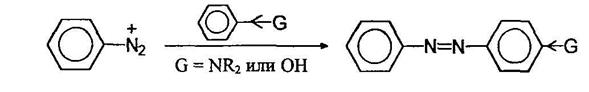
Азосочетанием получают красители. Окрашенные вещества поглощают из падающего на них видимого света некоторые лучи и отражают все остальные - цвет отраженных лучей и определяет окраску вещества. Чем длиннее цепь сопряжения, тем глубже окраска вещества.
Согласно одной из теорий цветности, окрашенное соединение должно содержать так называемую хромофорную группировку - это может быть, например, пара атомов соединенных двойной связью: ОС, C=N, N=N. Очень полезно присутствие в молекуле так называемой ауксохромной группировки, несущей одну или несколько подвижных электронных пар: при ее наличии цвет вещества углубляется. Пример такой групприровки диметиламиногруппа - N(CH3)2- Вот, к примеру, краситель метиловый оранжевый, очень широко применяемый как индикатор на кислоты. Его получают из сульфаниловой кислоты и К,К-диметиланилина:
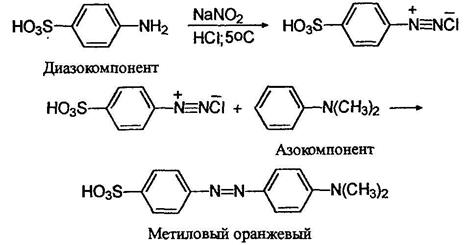
В молекуле этого красителя присутствует хромофорная двойная азот-азотная связь и ауксохромная диметиламиногруппа.
 Азокрасители, получаемые диазотированием сульфаниловой кислоты и последующим азосочетанием продукта с азакомпонентами в виде солей широко используются в качестве химических индикаторов.
Азокрасители, получаемые диазотированием сульфаниловой кислоты и последующим азосочетанием продукта с азакомпонентами в виде солей широко используются в качестве химических индикаторов.
Триазены существуют в двух таутомерных формах:
В средах, близких к нейтральной, катионы диазония электрофильно атакуют неподеленную пару электронов азота первичной аминогруппы. Образующиеся при этом аминоазосоединения называют триазенами.
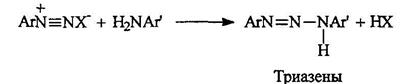

Равновесие смещено в сторону образования триазена, в молекуле которого протон находится у более основного атома азота, т. е. связанного с более электронодонорным радикалом:
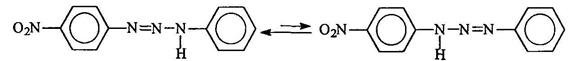
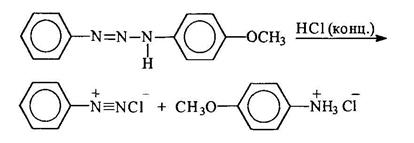
При действии минеральных кислот триазены расщепляются. При этом если триазен несимметричный, расщепление происходит таким образом, что отщепляется амин, являющийся более сильным основанием, а из "азофрагмента" образуется соответствующая соль диазония:
Список литературы
1. "Справочник химика" т.2, Л.-М.: Химия, 1964 стр. 418-419.
2. Бандман А.Л., Волкова Н.В. и др. Вредные химические вещества. Неорганические соединения элементов V–VIII групп. Справочное издание. Под ред. В.А.Филова и др. Л.: Химия, 1989, 592 с
3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
4. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
5. Мельниченко Г.Ф., Кирсанова В.Ф., Биткова Н.П. Выращивание экологически чистой овощной продукции: томаты, перец, баклажаны. Благовещенск, 1993, 62.
6. Богословский Б.Н., Щитова Э.П. Опыты по химии с экологической направленностью. Благовещенск, 1993, 27 с..
7. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
8. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
АМИЛОВЫЙ ЭФИР АЗОТИСТОЙ КИСЛОТЫ
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
Введение
Общие сведения
Практическое применение
Амилнитрит, как противоядие при отравлениях
Проблема нитратов и нитритов
Методика синтеза
Литературный обзор.
Неорганические нитриты
Органические нитриты
Нитросоединения
Способы получения нитросоединений
Реакции нитросоединений
Амины
Основность аминов
Методы получения
Реакции аминов
Диазо- и азосоединения
Реакции солей арилдиазония
Выводы
Список литературы
Введение
Общие сведения
Амилнитрит C5H11NO2 (изоамиловый эфир азотистой кислоты). Молекулярная масса (в а. е. м.): 117,15. Температура кипения (в °C): 104. Прозрачная желтоватая, легкоподвижная, весьма летучая жидкость фруктового запаха. Легко воспламеняется. Очень мало растворим в воде; смешивается во всех соотношениях со спиртом, эфиром, хлороформом. Плотность 0,8528 (20°C, г/см3).
Практическое применение
Дата: 2019-05-28, просмотров: 413.