Дослідження месенджерних систем, що опосередковують сигнали актг в адренокортикальних клітинах. Регуляція кортикотропіном адренокортикальної функції забезпечується здебільшого за рахунок прямого фосфорилювання cAMP-залежною ПКА специфічних білків, а також стероїдогенних факторів, що беруть участь в реакціях стероїдогенезу, змінюючи його швидкість. Не викликає сумнівів, що cAMP/ПКА-залежна месенджерна система не є єдиною системою опосередкування дії АКТГ в клітині. Гормон здатний активувати різні протеїнкінази, проте інші сигнальні каскади, залучені до перенесення сигналів АКТГ, досліджені значно менше, ніж cAMP/ПКА-залежний. Особливу увагу дослідників в цьому аспекті привернула протеїнкіназа С. Відомо, що деякі протеїни можуть одночасно бути субстратами для кількох кіназ, що є важливим загальним принципом інтеграції пострецепторних сигналів в клітині. Це істотно ускладнює розуміння механізмів опосередкування регуляторних сигналів АКТГ та можливої взаємодії між різними месенджерними системами. Потрібно також зазначити, що механізми дії АКТГ досліджувались раніше здебільшого на лініях пухлинних клітин надниркових залоз, спробу оцінки дії гормону на умовно нормальних тканинах надниркових залоз людини ми провели вперше.
Участь цAMФ-залежної ПКА та серин/треонінової протеїнкінази С в реалізації ефектів АКТГ. На початку досліджень необхідним було з’ясування специфіки механізмів перенесення регуляторного сигналу АКТГ в корі надниркових залоз людини із залученням цAMФ-залежної ПКА та серин/треонінової ПКС. В дослідах використовували післяопераційні умовно нормальні тканини надниркових залоз хворих, прооперованих у клініці Інституту. АКТГ in vitro у концентрації 0,2 од./100 мг тканини не призводить до активації ПКА та ПКС ні в мембранній, ні в цитозольній фракціях. При збільшенні концентрації кортикотропіну до 2 од./100 мг тканини протеїнкіназна активність у мікросомній фракції зростає у 4,5 рази порівняно з контрольними пробами у випадку ПКА та у 1,4 рази у випадку ПКС. Визначення розподілу ізоформи ПКС-a в субклітинних фракціях клітин після інкубації у середовищі з різним вмістом АКТГ за допомогою імуноблот-аналізу показало, що із збільшенням концентрації кортикотропіну кількість ферменту зростала в ядерній фракції (рис. 1), не змінюючись ні в мікросомній, ні в цитозольній фракціях адренокортикоцитів. Отже, суттєва роль у трансдукції сигналу кортикотропіну в адренокортикальних клітинах людини може належати не тільки мембранозв’язаній формі ПКС, але і ядерній ПКС.
 | |||||
 | |||||
 | |||||

|
| |
| |
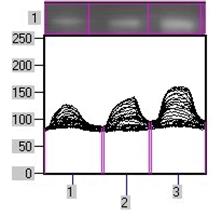
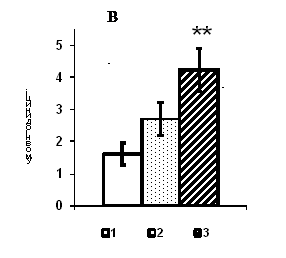
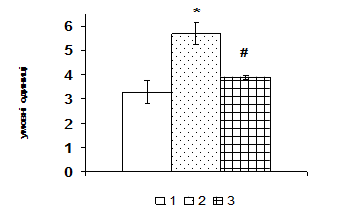
Рис. 1. Вміст a-ізоформи ПКС в ядерній фракції адренокортикоцитів умовно нормальної тканини кори надниркових залоз людини при різних концентраціях АКТГ.
А - Вестерн-блот аналіз. Б - сканограма плівки. В - узагальнені результати п’яти дослідів. 1 – контроль, 2 – АКТГ 0,2 од./100 мг тканини, 3 – АКТГ 2 од./100 мг тканини.** - вірогідний вплив АКТГ, p < 0,05; критерій Стьюдента.
Субклітинний розподіл ПКС та експресія рецепторних тирозинкіназ в пухлинах надниркових залоз людини. Відомо, що у проліферативних процесах важливу роль відіграє ПКС, яка є важливою ланкою внутрішньоклітинних сигнальних механізмів, порушення яких призводить до ініціації та прогресії онкогенезу. Зміни рівня експресії ізоферментів ПКС та їхньої активності мають значний вплив на процеси проліферації та можуть бути залучені до процесів пухлинної трансформації у корі надниркових залоз. Тому доцільним було визначити загальну активність протеїнкінази С і розподіл ізоформ ПКС у субклітинних фракціях клітин адренокортикальних тканин надниркових залоз людини за умов норми і різноманітних патологічних станів. Визначення активності ПКС здійснювалось у цитозольній, мікросомній та ядерній фракціях пухлин та умовно нормальних тканин. Статистично вірогідна різниця спостерігається між активністю ПКС у мікросомній фракції клітин умовно нормальної та пухлинної тканин і не спостерігається у цитозолі та ядрах. В препаратах ядерної, цитозольної та мікросомної фракцій клітин кори надниркових залоз людини було проаналізовано експресію десяти ізоферментних форм ПКС. Найвищий рівень експресії спостерігався у випадку ПКС-α. На отриманих знімках чітко виявляються смуги білка у діапазоні молекулярної маси 80 кДа, що відповідає молекулярній масі α-ізоформи ПКС (рис. 2).
|
|

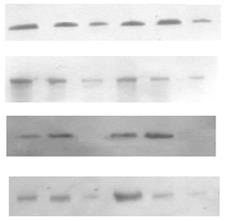
Експресії немає
ц м я ц м я
 | |||
 | |||
умовно аденома
нормальна
тканина
Рис. 2. Розподіл різних ізоформ протеїнкінази С в цитозольній (ц), мікросомній (м) та ядерній (я) субклітинних фракціях адренокортикоцитів в умовно нормальній і пухлинній тканинах надниркових залоз людини.
Ці дані узгоджуються з результатами інших авторів, які також визначали найвищий рівень експресії для α-ізоформи ПКС в адренокортикоцитах порівняно з досить незначним для інших ізоформ [Shigematsu et al., 1992].
Розподіл ПКС-a між цитозольною та мікросомальною фракціями визначається походженням тканини: в умовно нормальній тканині фермент рівномірно розподіляється між фракціями, а в аденомах (група, утворена об’єднанням всіх досліджених випадків доброякісних новоутворень) ПКС-a транслокується з цитозолю до мікросомної фракції. Найістотніша відмінність від контролю спостерігалась у випадках карцином. Для ядерної фракції не вдалося знайти певної закономірності між відносною кількістю ПКС-α та типом тканини (табл. 1). Виявлена транслокація ПКС-a розглядається нами як активація ферменту за умов дослідженої патології. Очевидно, саме ПКС-α бере активну участь у формуванні пухлин та підтримці пухлинного росту. Можливо, надекспресія цього ферменту, тривала активація ПКС внаслідок дії канцерогенних чинників або порушення метаболізму фосфоліпідних активаторів призводить до патологічної відповіді – порушення клітинного циклу та розвитку пухлин.
Отримані дані свідчать, що пухлини кори надниркових залоз характеризуються транслокацією основної ізоформи ПКС – Са2+/фосфоліпід-залежної a-ізоформи до мікросомної фракції адренокортикоцитів і збільшенням загальної активності ПКС в мікросомній фракції пухлин. На разі можна стверджувати, що α-ізоформа ПКС в надниркових залозах може брати участь у онкогенезі і слугувати маркером малігнізації.
Таблиця 1
Розподіл a-ізоформи ПКС у цитозольній, мікросомній та ядерній фракціях клітин кори та пухлин надниркових залоз людини, %
| Тип тканини | Цитозольна фракція | Мікросомна фракція | Ядерна фракція |
| Умовно нормальна (8) | 46,19 ± 2,18 | 41,26 ± 1,97 | 13,62 ± 1,21 |
| Аденома (4) | 29,35 ± 3,61 | 50,40 ± 2,0 * | 17,40 ± 1,58 |
| Карцинома (4) | 26,09 ± 8,16 | 73,91 ± 8,16* | - |
Примітка. * - вірогідна різниця між цитозольною та мікросомною фракціями, р<0,05; критерій Стьюдента, кількість спостережень вказано в дужках.
Крім α-ізоформи ПКС позитивні результати було отримано для -ε, -δ, -η, -θ, -μ, -ζ ³зоформ. Розподіл ізоформ ПКС-α, -ε, -δ, -ζ μіж субклітинними фракціями наведено на рис. 2. ПКС-ε, -δ, -η, -θ, -μ βідносяться до родини нових, а ПКС-ζ до нетипових протеїнкіназ. Всі вищезгадані форми є Са2+-незалежними, їх визначення в корі надниркових залоз було проведено вперше. Рівень експресії цих ізоферментів в корі надниркових залоз людини є досить високим, хоча меншим порівняно з Са2+/фосфоліпід-залежною ПКС-α. За винятком δ-ізоформи, вони виявляються в усіх досліджуваних субклітинних фракціях – цитозольній, мікросомній та ядерній (рис. 2).
Розподіл ізоформ ПКС-ε, -δ, -ζ μіж цитозольною, мікросомальною та ядерною фракціями наведено у таблиці 2. У випадку ПКС-ε усереднені дані за всіма дослідженими групами демонструють переважний вміст ε-ізоформи ПКС у цитозольній фракції (табл. 2). Отже, розподіл протеїнкінази С-e не залежить від типу тканини і характеризується зсувом до цитозольної фракції. Транслокація ПКС-δ до мембранної фракції спостерігалась у випадку аденом. Розподіл ПКС-ζ є подібним до ПКС-e в аденомах. В умовно нормальній тканині різниця між цитозольною та мікросомною фракціями ставить менше 10 %. У аденомах відносний розподіл протеїнкінази С-ζ характеризується зсувом до цитозольної фракції. Частка ядерної фракції становить в досліджених групах 14-18 % (табл. 2).
Таблиця 2
Субклітинний розподіл ε, δ, ζ ізоформ ПКС у фракціях клітин кори та пухлин надниркових залоз людини, %
| Ізоформа | Тип тканини | Цитозольна фракція | Мікросомна фракція | Ядерна фракція |
| ПКС-ε | Умовно нормальна (8) | 46,54 ± 2,77 | 36,31 ± 1,96 * | 17,14 ± 1,74 |
| Аденома (4) | 48,90 ± 4,64 | 33,13 ± 2,72 * | 17,98 ± 2,54 | |
| ПКС-δ | Умовно нормальна (8) | 50,49 ± 1,34 | 49,90 ± 1,34 | - |
| Аденома (4) | 36,65 ± 2,78 | 63,35 ± 2,78 * | - | |
| ПКС-ζ | Умовно нормальна (8) | 43,98 ± 2,69 | 42,00 ± 2,20 | 14,01 ± 1,26 |
| Аденома (4) | 51,98 ± 8,81 | 31,07 ± 6,62 * | 16,92 ± 2,97 |
Примітка. * - вірогідна різниця між цитозолем та мікросомною фракцією, р<0,05; критерій Стьюдента, кількість спостережень вказано в дужках.
Таким чином, отримані дані свідчать про участь ферментів родини ПКС у формуванні пухлинних патологій, оскільки процес транслокації до мембран є дуже суттєвим для активації ферменту та взагалі для існування пухлинних клітин.
Крім серин/треонінових протеїнкіназ, до яких відноситься ПКС, широко представлені в клітинах рецепторні і цитоплазматичні фосфотирозинові протеїнкінази. Зараз активно обговорюються факти щодо фенотипічного зв’язку експресії РТК в клітині зі злоякісною трансформацією і метастатичним потенціалом тканини. Ми провели оцінку експресії мРНК РТК за рахунок використання зворотної транскрипції – полімеразної ланцюгової реакції, яка свідчить про вірогідні відміни у експресії мРНК РТК між нормальною та пухлинною тканинами у карциномах кори надниркових залоз. Експресія в злоякісних пухлинах є найбільш вираженою і відрізняється від експресії мРНК РТК в доброякісних пухлинах надниркових залоз, які досліджувались (експресія спостерігалась тільки в одному випадку гормонально-активної аденоми – альдостероми). Визначення експресії РТК за допомогою зворотної транскрипції – полімеразної ланцюгової реакції може вважатись, з нашої точки зору, методом диференційної діагностики злоякісності пухлин надниркових залоз. Використання цього методу може бути перспективним для діагностики карцином адренокортикальної тканини.
Залучення МАР-кіназної системи до перенесення сигналу АКТГ. Пострецепторні етапи дії АКТГ, які полягають в перенесенні сигналу з активованого рецептора на внутрішньоклітинні процеси, що контролюються гормоном, пов’язують з системою cAMP-залежної ПКА, а також ПКС. Крім цих кіназ, кортикотропін викликає швидку активацію протеїнкіназ, що активуються мітогенами (МАР) – ERK1/2 і JNK в клітинах Y1, отриманих з адренокортикальної пухлини мишей. Трактування таких даних потребує уваги щодо пухлинного походження клітин лінії Y1, на яких здебільшого проводили дослідження дії АКТГ на систему МАР-кіназ, – регуляція функції і поділу цих клітин може суттєво відрізнятись від процесів у нормальних клітинах. Тому метою наступного етапу роботи було з’ясування участі МАР-кіназної сигнальної системи, а також факторів транскрипції c-jun та c-fos в трансдукції регуляторного сигналу АКТГ in vivo в корі надниркових залоз щурів. Досліди проведені на тлі істотного збільшення синтезу сумарних 11-гідроксикортикостероїдів (11-ОКС) корою надниркових залоз після введення щурам кортикотропіну в дозі 2 од./100 г маси тіла. Через 1 год після введення АКТГ рівень сумарних 11-ОКС у плазмі крові збільшувався з 1824±156 нмоль/л в контролі до 3220±168 нмоль/л (р<0,05). Через 6 год після введення АКТГ рівень 11-ОКС збільшився в порівнянні з контролем в 3,2 рази і становив 5845±489 нмоль/л в плазмі крові тварин (р<0,01).
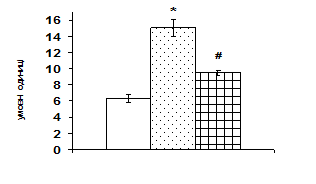
Згідно одержаних даних, через 1 год після введення щурам АКТГ вміст ERK1/2 в адренокортикальній тканині зростає в 1,6 рази, а через 6 год починає знижуватись. За даними літератури проліферативна дія кортикотропіну реалізується в клітинах кори надниркових залоз в першу чергу за рахунок активації ERK1/2 кіназ (р42/44), які відносяться до родини серин/треонінових протеїнкіназ, що активуються мітогенами. До родини МАР-кіназ відносять також JNK (c-Jun NH2-термінальна кіназа або SAPK – протеїнкіназа, що активується стресом) та р38 кіназу. Ці серин/треонінові кінази в свою чергу є активаторами транскрипційних факторів, які регулюють експресію генів ферментів стероїдогенезу. За отриманими нами даними, найвиразніший вплив АКТГ чинить на рівень JNK кінази. Через 1 год після введення АКТГ її вміст зростає більш ніж вдвічі, через 6 год вірогідно знижується, проте залишається істотно вищим, ніж у контролі (рис. 3). На клітинах Y1 показали, що АКТГ здатний індукувати швидке зростання активності ERK1/2 та стимулювати входження клітин у S-фазу клітинного циклу [Forti, 2006; Lotfi, Armelin, 1998]. Важливим елементом трансдукції та ампліфікації різних регуляторних сигналів в ядрі є транскрипційний фактор АР-1, який складається з двох субодиниць, транскрипційних факторів с-jun і с-fos. Вміст білка с-jun в адренокортикальній тканині зростає майже в 1,7 рази через 1 год після введення АКТГ (рис. 3). Звертає на себе увагу значне збільшення з часом вмісту білка с-fos, який вірогідно зростає в 1,7 рази тільки через 6 год після введення кортикотропіну.
Дослідження ролі АКТГ в апоптичних процесах в надниркових залозах. Кортикотропін, як головний регулятор адренокортикальної функції, забезпечує не тільки диференціювання, проліферацію адренокортикоцитів, а також їх генетично запрограмовану загибель шляхом апоптозу. Існує припущення, що шлях перенесення сигналу cAMP-залежною ПКА може водночас приводити до інгібування росту адренокортикальної пухлини [Keegan, Hammer, 2002; Kirschner, 2002], а інактивація рецепторів АКТГ може спровокувати формування пухлини [Kirschner, 2006]. Здебільшого дослідження механізмів апоптозу проводять як на клітинному, так і молекулярному рівнях, використовуючи як експериментальні моделі клітинні лінії.
Не існує жодної роботи, яка була б проведена на постопераційних тканинах надниркових залоз людини, що позбавляє можливості екстраполяції експериментальних даних на людський організм. Зважаючи на повну відсутність даних участі апоптичних процесів в патогенезі навіть найпоширеніших захворювань надниркових залоз, ми провели дослідження на гіперплазованій адренокортикальній тканині людини. Дослідження ролі АКТГ у регуляції апоптозу адренокортикальних клітин проводили за допомогою двох методичних підходів: визначення вмісту каспази-3 методом імуноблот-аналізу та за фрагментацією ДНК, яка є свідченням завершальних етапів апоптозу. Утворення характерної для апоптозу чіткої "драбинки" здійснюється ендонуклеазами, які розщеплюють ДНК хроматину на відрізки фіксованого розміру.

| ||||||||
 | ||||||||
| ||||||||
| ||||||||
| ||||||||
 | ||||||||
| ||||||||
|

|
Рис. 3. Вплив АКТГ in vivo на вміст JNK-кінази і транскрипційного фактора c-jun у корі надниркових залоз щурів.
А – типові результати імуноблот-аналізу одного досліду з 3-х, Б – усереднені дані. 1 – контроль, 2 – АКТГ 1 год, 3 – АКТГ 6 год. * – різниця з контролем є вірогідною, # – різниця з групою АКТГ 1 год є вірогідною, р < 0,05; непараметричний U-критерій Вілкоксона-Манна-Уїтні.
Внесення до середовища інкубації АКТГ викликає вірогідні зміни вмісту каспази-3 в адренокортикоцитах (рис. 4).
Рівень каспази-3 за присутності кортикотропіну знижується як в абсолютних величинах (в 1,7 рази), так і у відсотках по відношенню до контролю (на 40 %). Хелеритрину хлорид (ХХ), який здатний інгібувати активність ПКС, виявляє протилежну дію: вміст каспази-3 збільшується на 22 %. При сумісному додаванні АКТГ і ХХ в більшій мірі спостерігається ефект, характерний для ХХ. Подібна закономірність спостерігається при дослідженні фрагментації ДНК. Під впливом АКТГ спостерігається зниження рівня фрагментації ДНК на 13 %, ці зміни є вірогідними. Тенденція до збільшення фрагментації ДНК спостерігається як при додаванні до середовища інкубації інгібітору ПКС ХХ, так і його комбінації з кортикотропіном. Отримані нами результати свідчать про те, що кортикотропін здійснює антиапоптичний вплив на кору надниркових залоз людини. Виявлені під дією АКТГ антиапоптичні зміни в клітинах надниркових залоз, оцінювані за вмістом каспази-3 і ступенем фрагментації ДНК.
Наш час відзначається інтенсивними спробами залучити до кола протипухлинних засобів препарати, що діють саме на ланки сигнальних шляхів, залучених до трансформації клітин. Інгібування ПКС, зокрема хелеритрином, може стати допоміжним заходом для посилення апоптичної загибелі клітин під впливом канцеростатичних препаратів або іонізуючої радіації. Крім ПКС-залежного впливу хелеритрину, що може викликати апоптоз, ймовірною є його пряма дія на ДНК. Виходячи з цього, посилення фрагментації ДНК під впливом хелеритрину хлориду може пояснюватись його цитотоксичною дією, високим ступенем спорідненості до ДНК та здатності цього алкалоїда до інтеркаляції [Осип та ін., 2004; Kaminskyy et al., 2005]. Конформація молекул хелеритрину зумовлює його енергетично вигідне розміщення між парами азотистих основ у спіралі ДНК, що призводить до стабілізації спіралі (підвищення температури плавлення) ДНК і, як наслідок, до гальмування процесів реплікації.
Таким чином, можна стверджувати, що вплив кортикотропіну на функцію кори надниркових залоз є значно складнішим, ніж вважалось до цього часу. Ефекти АКТГ здебільшого пов’язані з регуляцією стероїдогенезу в адренокортикальній тканині. Однак отримані нами дані щодо впливу кортикотропіну на зміни рівня каспази-3 та фрагментації ДНК дозволяють віднести його до чинників, що регулюють одночасно апоптичні процеси в адренокортикоцитах.
Зв’язування 125І-АКТГ та 125І-ПРЛ в корі надниркових залоз за умов адренокортикальної патології. Відомо, що апоптоз не тільки відіграє важливу роль у елімінації пухлинних клітин, але й посилюється в останніх за дії деяких протипухлинних препаратів. Застосування хлодитану (о,п’-ДДД, 2-о-хлорфеніл-2-п-хлорфеніл-1,1-дихлоретан) при хворобі та синдромі Іценка-Кушинга та при лікуванні певних випадків злоякісних перетворень у надниркових залозах значно підвищило ефективність терапії цих патологій [Комиссаренко, Резников, 1972; Schteingart, 2007].


|
|
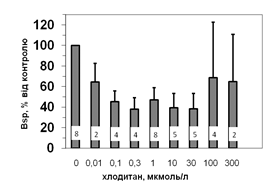
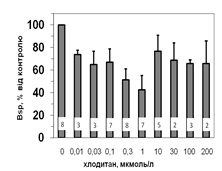
Рис. 5. Вплив хлодитану на специфічне зв’язування 125І-АКТГ (А) та 125І-ПРЛ (Б) мікросомами адренокортикоцитів людини.
Вплив хлодитану є вірогідним, p<0,001; критерій Фішера.
Кількість спостережень вказано всередині стовпчиків.
Вивчення відхилень гормональної рецепції в корі надниркових залоз під впливом хлодитану в певній мірі заповнює прогалину в розумінні механізму його дії, розвитку резистентності до нього та може стати підґрунтям для використання більш ефективної схеми лікування хвороби Іценка-Кушинга. Зважаючи на практично повну відсутність аналізу як рецепторної ланки в патогенезі захворювань надниркових залоз, так і зміни рецепції тропних гормонів гіпофіза при адренокортикальних патологіях та за умов їх терапії, ми провели дослідження впливу хлодитану на зміни рецепції 125І-АКТГ та 125І-ПРЛ. Для вивчення дії хлодитану на зв’язування 125І-АКТГ та 125І-ПРЛ використані мікросомні фракції клітин кори надниркових залоз пацієнтів з різними діагнозами: хвороба Іценка-Кушинга на різних стадіях, кортикостерома, альдостерома. Розглянувши наявний матеріал ми не помітили істотних відмін між ними в характері впливу хлодитану в залежності від типу патології. Тому всі дані охарактеризовано як одна вибірка.
Для вивчення зв’язування використано АКТГ, мічений за Tyr23, а Tyr2, який бере участь у формуванні центру, відповідального за гормон-рецепторну взаємодію, залишається нейодованим. Такий ліганд повністю зберігає біологічну активність, зокрема, здатність взаємодіяти з рецепторами та активувати стероїдогенез.
Параметри зв’язування 125І-ПРЛ в мікросомній фракції кори надниркових залоз людини свідчать про наявність тільки одного типу сайту зв’язування ПРЛ, який за своїми характеристиками є типовим представником рецепторів високої афінності та низької ємності: Bmax=1,2±0,08 х 10-10 М; Ka=0,14±0,02 х 109 М-1. Оцінка параметрів зв’язування 125І-ПРЛ ізольованими адренокортикальними клітинами свідчить, що афінність рецепторів у цьому випадку є подібною до мембран мікросом. Цей факт може бути додатковим свідченням того, що диспергування і очищення адренокортикоцитів істотно не впливає на нативність клітин та їх здатність до відтворення нормальних фізіологічних процесів. Більш низьку абсолютну зв’язувальну ємність плазматичних мембран адренокортикоцитів порівняно до мембран мікросом можна пояснити тим, що на поверхні клітини є доступною лише незначна частка тих рецепторів, які містять мікросоми. Специфічне зв’язування (Bsp) як 125І-АКТГ, так і 125І-ПРЛ знижується у мікросомах кори надниркових залоз людини за присутності хлодитану (рис. 5).
Зв’язування починає зменшуватись, починаючи з концентрації 0,01 мкмоль/л, та сягає мінімуму за присутності 0,3 мкмоль/л хлодитану (рецепція 125І-ПРЛ) або 1,0 мкмоль/л хлодитану (рецепція 125І-АКТГ). Подальше збільшення концентрації хлодитану нівелювало його інгібувальний ефект на зв’язування досліджуваних лігандів (рис. 5). Факт встановлення залежності зниження специфічного зв’язування 125І-АКТГ та 125І-ПРЛ від концентрації хлодитану у мікросомній фракції адренокортикоцитів може стати підставою для пошуків способів подолання резистентності деяких типів пухлин до цього препарату та збільшення ефективності його використання.
Дата: 2019-05-28, просмотров: 290.