Способность Tr прилипать к повреждённой поверхности стенки сосуда (адгезия) и друг к другу (агрегация), связываться с фибрином, образуя тромбоцитарный тромб, и секретировать в месте повреждения сосуда гемостатические факторы определяет их роль в гемостазе.
Циркулирующие в крови Tr имеют дисковидную форму и не прилипают к неповреждённому эндотелию сосудов. Адгезию и агрегацию предотвращают взаимное отталкивание Tr и интактного эндотелия, а также простациклин (PG 12). Механизм действия некоторых индукторов и репрессора агрегации тромбоцитов рассмотрен на рис.10.
Простациклин образуется из арахидоновой кислоты в эндотелиии сосудов и поступает в кровь. Синтез и секрецию простациклина эндотелиальными клетками стимулируют тромбин, гистамин, ангиотензин II и калликреин. Он действует через аденилатциклазную систему передачи сигнала. Взаимодействие простациклина с рецептором вызывает активацию протеинкиназы А (ПКА). Активная ПКА фосфорилирует и таким образом активирует Са2+-АТФ-азу и Са2+-транслоказу. Это приводит к снижению уровня содержания Са2+ в цитоплазме Tr, сохранению ими дисковидной формы и снижению способности к агрегации.
Активация Tr сопровождается появлением на поверхности плазматической мембраны «-» заряженных участков, образованных фосфатидилсерином. Основные индукторы активации и агрегации тромбоцитов - фактор фон Виллебранда, коллаген, тромбин, АДФ.
Фактор фон Виллебранда - гликопротеин, присутствующий в плазме крови, эндотелии сосудов и а-гранулах тромбоцитов. При повреждении стенки сосудов коллаген, базальная мембрана и миоциты субэндотелия взаимодействуют с Tr посредством фактора фон Виллебранда. Плазматическая мембрана Tr содержит несколько типов рецепторов этого фактора. Фактор фон Виллебранда, взаимодействуя с рецепторами, действует на Tr через инозитолфосфатную систему (ИФ-система) передачи сигнала. В конечном итоге это приводит к повышению содержания Са2+ в цитоплазме Tr и образованию комплекса кальмодулин-4Са2+ - миозинкиназа. Фермент миозинкиназа в составе этого комплекса фосфорилирует сократительный белок миозин, который взаимодействует с актином с образованием актомиозина (тромбостенина). В результате этого Tr приобретают шиповидносферическую форму, облегчающую их взаимодействие друг с другом и с поверхностью повреждённого эндотелия.
Снижение концентрации фактора фон Виллебранда, уменьшение количества или изменение структуры его рецепторов ведут к нарушениям адгезии и агрегации Tr, что сопровождается кровоточивостью. Это наблюдают при синдроме Бернара - Сулье, обусловленном недостатком рецептора фактора фон Виллебранда гликопротеина Iа в Tr, и при болезни фон Виллебранда вследствие дефицита фактора фон Виллебранда.
Наиболее важные первичные индукторы активации Tr - тромбин и коллаген. Взаимодействие этих белков со специфическими рецепторами плазматической мембраны Tr приводит к мобилизации Са2+ из плотной тубулярной системы в цитоплазму, что в конечном итоге вызывает их адгезию и агрегацию.
Коллаген вызывает в Tr активацию фосфолипазы A2, которая освобождает арахидоновую кислоту из фосфолипидов их мембраны. Арахидоновая кислота служит субстратом для фермента циклооксигеназы (ЦОГ). В результате реакции, катализируемой циклооксигеназой, образуются циклические эндоперекиси простагландин G2 (PG G2) и простагландин Н2 (PG Н2). Эти простагландины под действием тромбоксансинтетазы превращаются в тромбоксан А2. Тромбоксан А2 снижает уровень цАМФ и, активируя фосфолипазу С, ускоряет освобождение Са2+ из плотной тубулярной системы (рис. 10).
Тромбин взаимодействует со специфическим рецептором - интегральным белком, имеющим 7 трансмембранных доменов. Тромбин активирует рецептор частичным протеолизом, отщепляя от него N-концевой пептид, находящийся на внешней плазматической поверхности тромбоцита. Следовательно, тромбин, в отличие от других активаторов, действует каталитически, и одна молекула тромбина может активировать несколько рецепторов. Передача сигнала осуществляется через ИФ_систему, в результате чего в тромбоците повышается концентрация Са2+ и активируется ПК С.
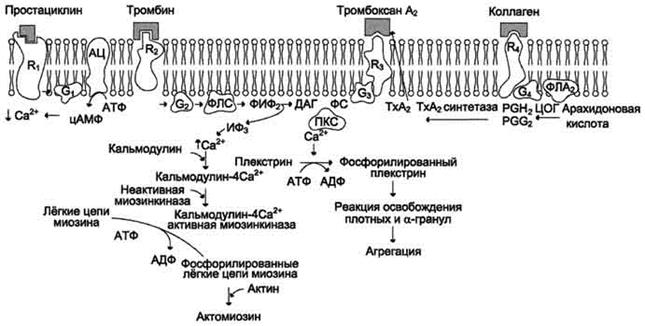
Рис. 10. Механизм действия простациклина, тромбоксана .
Образующийся комплекс кальмодулин-4Са2+-миозинкиназа фосфорилирует миозин, взаимодействие которого с актином приводит к изменению формы Tr, к их адгезии и агрегации. ПК С, кроме того, фосфорилирует белок Tr плекстрин. Фосфорилированный плекстрин вызывает "реакцию освобождения" содержащихся в гранулах Tr вторичных индукторов активации и агрегации Tr. К этим веществам относят содержащиеся в плотных гранулах Tr АДФ, Са2+, ГДФ, серотонин, гистамин и присутствующие в осгранулах белок β-тромбоглобулин, фактор фон Виллебранда, белок фибронектин, тромбосподин и ВМК. Тромбосподин участвует во взаимодействии тромбоцитов друг с другом. β-Тромбоглобулин снижает секрецию простациклина и связывает гепарин. Фибронектин имеет центры связывания для коллагена, гепарина и тромбоцитов.
AДФ содержится в Tr, а также попадает в кровь при разрушении эритроцитов. АДФ взаимодействует со специфическими рецепторами и подавляет активность аденилатциклазы. Это вызывает увеличение мобилизации внутриклеточного Са2+ и в конечном итоге приводит к агрегации Tr.
Активация Tr, таким образом, сопровождается изменением их метаболизма и освобождением биологически активных веществ. Эти вещества вызывают морфологические изменения, адгезию, агрегацию Tr и участвуют в образовании тромба.
Нарушение функциональной активности рецепторов и системы вторичных посредников Tr приводит к изменению их функции и может явиться причиной ряда заболеваний, сопровождающихся тромбозами или кровотечениями.
Лекарственные препараты, нарушающие агрегацию тромбоцитов, используют для предупреждения возникновения тромбозов. Аспирин (ингибитор циклооксигеназы), никотиновая кислота (ингибитор тромбоксансинтетазы) и Са2+-блокаторы угнетают агрегацию тромбоцитов, влияя на разные этапы реализации тромбогенного сигнала.
Тромб растворяется в течение нескольких дней после образования.
Фибринолиз - ферментативное расщепление волокон фибрина с образованием растворимых пептидов, которые удаляются из сосудистого русла. Разрушение фибрина в составе тромба происходит под действием сериновой протеазы плазмина.
Плазмин образуется из плазминогена под действием активаторов. Неактивный профермент плазмина плазминоген синтезируется в печени, почках и костном мозге.
Тканевый активатор плазминогена (ТАП) - протеолитический фермент, содержащийся в эндотелии сосудов всех тканей, кроме печени. Поступление этого активатора в кровь увеличивается при эмоциональном напряжении, боли, венозной тромбоэмболии, умеренной физической работе. ТАП частичным протеолизом превращает неактивный плазминоген в активный плазмин. Активаторами плазминогена также служат фактор ХIIа и калликреин.
Растворение фибринового сгустка происходит при взаимодействии фибрина, плазминогена и ТАП (рис. 11).
Формирование сети фибриновых волокон при образовании тромба сопровождается сорбцией на ней плазминогена и его активаторов. В молекуле плазмина и плазминогена есть участки, комплементарные доменам фибрина, причём одна молекула плазмина может связывать несколько молекул фибрина. Молекулы ТАП тоже имеют центры связывания с фибрином. Образующийся из плазминогена под действием ТАП плазмин гидролизует фибрин с образованием пептидов X и Y, активирующих фибринолиз, и пептидов D и E, его тормозящих. Растворимые пептиды X, Y, D, E поступают в кровоток и там фагоцитируются. Разрушение тромба приводит к освобождению из него плазмина и ТАП. В кровяном русле последние быстро инактивируются специфическими ингибиторами и улавливаются печенью.
ТАП ингибируется ингибиторами тканевого активатора плазмина первого (и-ТАП-1) и второго (и-ТАП-2) типов, а плазмин - α2-антиплазмином или другими ингибиторами сериновых протеаз.
В почках синтезируется протеолитический активатор плазминогена урокиназа, которая, превращая плазминоген в плазмин, способствует освобождению почечных клубочков от фибриновых волокон. Из β-гемолитического стрептококка выделили белок стрептокиназу, образующий комплекс с плазминогеном, в котором плазминоген аутокаталитически превращается в плазмин.
Урокиназу, стрептокиназу и ТАП используют при тромболитической терапии инфаркта миокарда, тромбозах вен и артерий, гемодиализе.
Такие ингибиторы ферментов свёртывания крови, как α2-макроглобулин, α1-антитрипсин и комплекс антитромбин III-гепарин также обладают небольшой фибринолитической активностью.
Снижение фибринолитической активности крови сопровождается тромбозами. Нарушение разрушения фибринового сгустка может быть вызвано наследственным дефицитом плазмино-гена или генетическим дефектом его структуры, снижением поступления в кровь активаторов плазминогена, повышением содержания в крови ингибиторов фибринолиза (и-ТАП-1, и-ТАП-2, α2-антиплазмина).
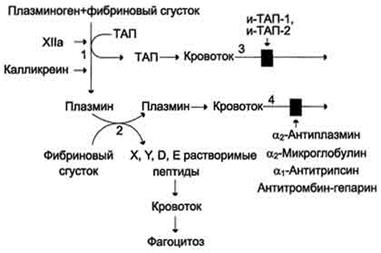
| Рис. 11. Схема фибринолиза. 1 - абсорбированный на фибриновом сгустке плазминоген под действием активаторов (фактор ХIIа, калликреин, ТАП) частичным протеолизом превращается в плазмин; 2 - плазмин гидролизует фибрин с образованием растворимых пептидов X, Y,D, E; 3 - в кровотоке ТАП инактивируется специфическими белками и-ТАП-1, и-ТАП-2; 4 - активность плазмина снижается под действием неспецифических ингибиторов сериновых протеаз (α2-антиплазмина, α2-макроглобулина, α1-антитрипсина, комплекса антитромбин-гепарин). |
|

Наследственные и приобретённые нарушения гемостаза могут привести как к геморрагическим заболеваниям, характеризующимся кровоточивостью, так и к тромботической болезни. Однако следует отметить, что повышенная склонность к тромбообразованию и внутрисосудистому свёртыванию (тромбофилии) встречается гораздо чаще, чем гемофилии. Например, частота разных форм гемофилии колеблется в разных странах от 6 до 18 на 100 000 мужчин, в то время как тромбофилии, вызванные дефицитом антитромбина III, встречаются у 1-2 больных на 5000, а при недостатке протеина С - у одного на 15 000 человек.
II Цель деятельности студентов на занятии
Студент должен знать:
1. Что такое коагуляция;
2. Какие этапы свертывания различают;
3. Перечислить факторы свертывания;
4. Как происходит образование фибринового (красного) тромба;
5. Фибриноген, строение и свойства;
6. описать первый этап гемокоагуляции: превращение фибриногена в мономер фибрина;
7. Как происходит образвание нерастворимого геля фибрина (2 этап);
8. Опишите 3 этап- стабилизация геля фибрина;
9. Как происходит ретракция фибринового сгустка (4 этап);
10. Прокоагулянтный путь свертывания крови ( тромбин, тканевый фактор);
11. Противосвертывающая система крови;
12. Антиокагулянтная фаза (тромбомодулин, протеин С);
13. Ингибиторы ферментов свертывания крови ( антитромбин III, α2 -макроглобулин, α1- антитрипсин, антиконвертин);
14. Фибринолиз
Студент должен уметь:
1. Написать схему свертывания крови
III Содержание обучения:
Основные вопросы:
1. Коагуляция;
2. Этапы свертывания различают;
3. Факторы свертывания;
4. Образование фибринового (красного) тромба;
5. Фибриноген, строение и свойства;
6. Первый этап гемокоагуляции: превращение фибриногена в мономер фибрина;
7. Образвание нерастворимого геля фибрина (2 этап);
8. 3 этап- стабилизация геля фибрина;
9. Ретракция фибринового сгустка (4 этап);
10. Прокоагулянтный путь свертывания крови ( тромбин, тканевый фактор);
11. Противосвертывающая система крови;
12. Антиокагулянтная фаза (тромбомодулин, протеин С);
13. Ингибиторы ферментов свертывания крови ( антитромбин III, α2 -макроглобулин, α1- антитрипсин, антиконвертин);
14. Фибринолиз.
Дата: 2019-03-05, просмотров: 345.