В активации ферментов каскада выделяют три основных механизма:
1. частичный протеолиз
2. взаимодействие с белками-активаторами
3. взаимодействие с модифицированными клеточными мембранами.
Прокоагулянтный путь занимает центральное место в свёртывании крови (рис. 4).
В циркулирующей крови содержатся проферменты протеолитических ферментов: факторы II, VII, IX, X. Находящиеся в крови факторы Va (акцелерин) и VIIIa (АГ фактор), а также мембранный белок - тканевый фактор (ТФ, ф.III) являются белками-активаторами этих ферментов.
При повреждении сосуда "включается" каскадный механизм активации ферментов с последовательным образованием трёх связанных с фосфолипидами клеточной мембраны ферментных комплексов. Каждый комплекс состоит из протеолитического фермента, белка-активатора и ионов Са2+: VIIa-TO-Ca2+, IXa-VIIIa-Са2+ (теназа), Xa-Va-Са2+ (протромбиназа). Комплекс Xa-Va-Са2+ (протромбиназный комплекс) активирует протромбин (ф. II). Каскад ферментативных реакций завершается образованием мономеров фибрина и последующим формированием тромба.
В активации ферментов каскада выделяют три основных механизма: частичный протеолиз, взаимодействие с белками-активаторами и взаимодействие с модифицированными клеточными мембранами.
Активация частичным протеолизом. Все ферменты прокоагулянтного пути являются сериновыми протеазами, синтезируются в печени в виде неактивных проферментов и в такой форме циркулируют в крови. В процессе реализации тромбогенного сигнала проферменты (факторы VII, IX, X и II) частичным протеолизом превращаются в активные ферменты.
Тромбин (фактор Па) - гликопротеин с молекулярной массой 39 кД. Он образуется в крови из неактивного предшественника протромбина. Протромбин синтезируется в печени, имеет молекулярную массу 70 кДа и содержит остатки
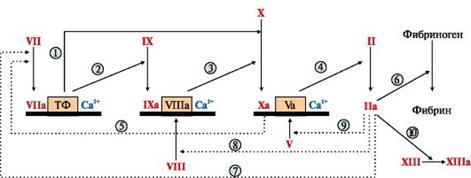
Рис. 4. Прокоагулянтный путь свёртывания крови. → активация факторов свертывания крови; ·····> активация факторов свертывания крови по принципу положительной обратной связи; ▅ мембранный фосфолипидный компонент ферментных комплексов. В рамку обведены белки-активаторы. 1,2 - фактор VIIa мембранного комплекса VIIa-TФ-СА2+ активирует факторы IX и X; 3 - фактор IXa мембранного комплекса IXa-VIIIa-Са2+ активирует фактор X; 4, 5 - фактор Ха мембранного комплекса Xa-Va-Са2+ превращает протромбин (фактор II) в тромбин (фактор IIа) и активирует фактор VII; 6-10 - тромбин (фактор IIа) превращает нерастворимый фибриноген в растворимый фибрин, активирует факторы VII, VIII, V и XIII.
γ-карбоксиглутаминовой кислоты (0,1 г/л). Он фиксируется на мембранном ферментном комплексе Xa-Va-Са2+, взаимодействуя, с одной стороны, остатками γ-карбоксиглутамата с Са2+, а с другой - непосредственно с белком-активатором Va. Фактор Ха гидролизует две пептидные связи в молекуле протромбина и образуется молекула тромбина, состоящая из двух цепей - лёгкой и тяжёлой, связанных между собой одной дисульфидной связью (рис. 5). Молекула тромбина не содержит остатков γ-карбоксиглутамата и освобождается из протромбиназного комплекса. Тромбин частичным протеолизом превращает фибриноген в фибрин и активирует факторы VII, VIII, V, XIII.
Тромбин выполняет ряд важных физиологических функций: является ферментом прокоагулянтного и контактного путей свёртывания крови, инициирует реакции антикоагулянтной фазы, вызывает агрегацию тромбоцитов и оказывает митогенное действие, участвуя в пролиферации и репарации клеток.
Частичным протеолизом активируются также факторы V и VIII, превращаясь, соответственно, в факторы Va и VIIIa. В результате активации этих факторов изменяется их конформация и повышается сродство к фосфолипидам мембран и ферментам, которые они активируют.
Функции тромбина:
Ø частичным протеолизом превращает фибриноген в фибрин
Ø активирует факторы VII, VIII, V, XIII
Ø активирует тромбоциты,вызывая их агрегацию
Ø оказывает митогенное действие, участвуя в пролиферации и репарации клеток.
Взаимодействие белков-активаторов с протеолитическими ферментами. Тканевый фактор, фактор Va и фактор VIIIa имеют центры связывания с фосфолипидами мембран и ферментами VIIa, IXa и Ха, соответственно. При связывании с белками-активаторами в результате конформационных изменений активность этих ферментов повышается.
Тканевый фактор (фактор III) представляет собой комплекс, состоящий из белка и фосфатидилсерина. Белковая часть тканевого фактора (апопротеин III) экспонирована на поверхности многих клеток (мозга, лёгких, печени, селезёнки и др.) и связана с фосфатидилсерином плазматических мембран. Однако появление апопротеина III на поверхности клеток, соприкасающихся с кровью (эвдотелиальных и моноцитов), происходит только при определённых условиях: при повреждении сосуда и/или нарушении нормальной асимметрии их плазматических мембран. Тканевый фактор в протеолитической активации не нуждается.
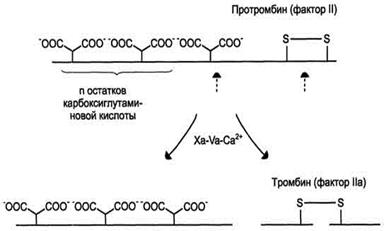
| Рис.5. Протеолитическая активация протромбина фактором Ха протромбиназного комплекса.  - остатки карбоксиглутаминовой кислоты; штрихстрелки указывают положение гидролизуемых в молекуле протромбина пептидных связей. Молекула протромбина состоит из одной полипептидной цепи, а образующийся в результате частичного протеолиза протромбина тромбин состоит из двух полипептидных цепей, связанных между собой одной дисульфидной связью. - остатки карбоксиглутаминовой кислоты; штрихстрелки указывают положение гидролизуемых в молекуле протромбина пептидных связей. Молекула протромбина состоит из одной полипептидной цепи, а образующийся в результате частичного протеолиза протромбина тромбин состоит из двух полипептидных цепей, связанных между собой одной дисульфидной связью.
|
Фактор V и фактор VIII - доменные белки, циркулирующие в крови. Фактор V синтезируется в печени, а фактор VIII - эндотелиальными клетками. Оба фактора активируются частичным протеолизом под действием тромбина. Фактор VIII в плазме крови находится в комплексе с белком - фактором тромбоцитов фон Виллебранда. Фактор фон Виллебранда в этом комплексе стабилизирует фактор VIII, препятствуя его разрушению прогеолитическим ферментом антикоагулянтной фазы фактором Са.
Взаимодействие ферментных комплексов с клеточными мембранами происходит с участием ионов Са2+. Все проферменты прокоагулянтного пути (II, VII, IX, X) содержат остатки у-кар-боксиглутаминовой кислоты, образующиеся в результате посттрансляционой модификации этих белков в ЭР гепатоцитов.
Остатки γ-карбоксиглутаминовой кислоты в факторах VIIa, IXa и Ха обеспечивают взаимодействие этих ферментов посредством Са2+ с отрицательно заряженными фосфолипидами клеточных мембран. В отсутствие ионов Са2+ кровь не свёртывается.
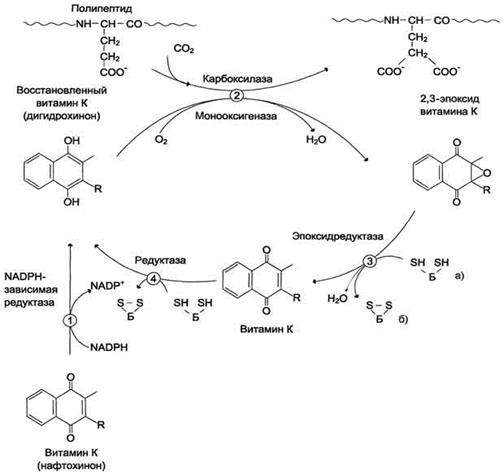
Роль витамина К в карбоксилировании остатков глутаминовой кислоты в проферментах прокоагулянтного пути свёртывания крови. Карбоксилирование остатков глутаминовой кислоты в проферментах прокоагулянтного пути катализирует карбоксилаза, коферментом которой служит восстановленная форма витамина К (нафтохинона) - дигидрохинон витамина К.
Поступивший в организм витамин К (нафто-хинон) восстанавливается в печени NADPH-зависимой витамин К редуктазой с образованием дигидрохинона витамина К. В ходе реакции кар-боксилирования остатков глутаминовой кислоты в проферментах прокоагулянтного пути дигидрохинон окисляется и эпоксидируется с образованием 2,3-эпоксида витамина К. Регенерация эпоксида в дигидрохинон витамина К происходит следующим образом: сначала 2,3-эпоксид витамина К восстанавливается в витамин К тиолзависимой эпоксидредуктазой, коферментом которой является белок, подобный тиоредоксину. Затем образующийся в этой реакции витамин К восстанавливается ферментом витамин К тиолзависимой редуктазой в дигидрохинон витамина К. Донором водорода в этой реакции, так же, как и в предыдущей, служит тиоредоксинподобный белок (рис. 6). Недостаточность витамина К приводит к нарушению карбоксилирования проферментов прокоагулянтного пути и сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями.
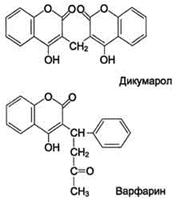
Структурные аналоги витамина К дикумарол и варфарин ингибируют тиолзависимые ферменты витамин К 2,3-эпоксидредуктазу и витамин К редуктазу, вызывая торможение свёртывания крови (рис. 7). Эти препараты применяют в клинической практике для предупреждения тромбозов.
Инициация каскада реакций прокоагулянтного пути. Ферментные мембранные комплексы прокоагулянтного пути образуются только при наличии на внешней поверхности плазматической мембраны клеток тканевого фактора и отрицательно заряженных фосфолипидов. Поперечная асимметрия плазматических мембран, в частности, определяется преобладанием в наружном слое нейтральных фосфолипидов (фосфатидил-холина и сфингомиелина), а во внутреннем - отрицательно заряженных (фосфатидилинозитол-бисфосфата и фосфатидилсерина). Специальная ферментная сисгема обеспечивает трансмембранный перенос и такое распределение фосфолипидов в клеточных мембранах, при котором в норме внешняя поверхность плазматических мембран клеток не заряжена.
При нарушении поперечной асимметрии мембран тромбоцитов и эндотелиальных клеток на их поверхности формируются отрицательно заряженные (тромбогенные) участки и экспонируется апопротеин III тканевого фактора. Такие нарушения могут возникнуть при физической травме. В этом случае тканевый фактор и внутренняя поверхность клеточной мембраны становятся доступными для плазменных факторов прокоагулянтного пути. Кроме того, взаимодействие сигнальных молекул, вызывающих тромбогенез, с рецепторами эндотелиальных клеток и тромбоцитов активирует Са2+-зависимые регуляторные системы. В конечном итоге это приводит к повышению содержания в цитоплазме Са2+, который ингибирует АТФ-зависимую аминофосфолипидтранслоказу. Этот фермент играет важную роль в сохранении поперечной асимметрии мембран, так как переносит фосфатидилсерин из внешнего липидного слоя во внутренний. Снижение активности аминофосфолипидтранслоказы приводит к увеличению содержания во внешнем слое клеточной мембраны фосфатидилсерина и образованию отрицательно заряженных участков, необходимых для формирования мембранных ферментных комплексов. Кроме того, в результате такого нарушения структуры плазматической мембраны на её внешней поверхности экспонируется тканевый фактор и формируется первый ферментный комплекс прокоагулянтного пути свёртывания крови VII-ТФ-Са2+.
|
| Рис. 6. Роль витамина К в посттрансляционном карбоксилировании глутаминовой кислоты. 1 - восстановление экзогенного витамина К NADPH-зависимой редуктазои; 2 - γ-карбоксилирование остатков глутаминовой кислоты в факторах II, VII, IX, X, протеине С витамин К зависимой карбоксилазой сопровождается окислением дигидрохинона с образованием 2,3-эпоксида витамина К; 3 - восстановление 2,3-эпоксида тиолзависимои витамин К редуктазои; 4 - восстановление витамина К тиолзависимои витамин К редуктазои; а) и б) - восстановленная и окисленная формы тиоредоксинподобного белка.
| ||
| |||
Рис. 7. Структурные аналоги витамина К дикумарол и варфарин.
Активация ферментов каждого комплекса - результат взаимодействия всех его компонентов. Если факторы IX, X и II требуют активации, то фактор VII обладает невысокой протеолитической активностью. Фактор VII мембранного комплекса VII-ТФ-Са2+ частичным протеолизом активирует факторы IX и X. Активные факторы IХа и Ха включаются в образование мембранных комплексов IXa-VIIIa-Са2+ и Ха-Va-Са2+. При этом фактор Ха протеолитически активирует фактор V, а протромбиназный комплекс не только превращает протромбин в тромбин, но и активирует фактор VII, протеолитическая активность которого в комплексе VIIa-Тф-Са2+ в 10 000 раз выше, чем в комплексе VII-Тф-Са2+.
Образовавшийся в результате каскада реакций тромбин катализирует реакции частичного протеолиза фибриногена, фактора XIII и по принципу положительной обратной связи протеолитически активирует факторы V, VII и VIII.
В процессе свёртывания действуют 2 механизма усиления сигнала: каскад реакций, в котором каждое ферментативное звено обеспечивает усиление сигнала, и положительные обратные связи.
Контактный путь свертывания крови
Контактный путь свёртывания крови начинается с взаимодействия профермента фактора XII с повреждённой эндотелиальной поверхностью сосудистой стенки.
Такое взаимодействие приводит к активации фактора XII и инициирует образование мембранных ферментных комплексов контактной фазы свёртывания. Они содержат ферменты калликреин, факторы XIa (плазменный предшественник тромбопластина) и ХIIа (фактор Хагемана), а также белок-активатор - высокомолекулярный кининоген (ВМК) (рис. 8).
Фактор XII - профермент, циркулирующий в крови. Он последовательно активируется двумя способами: сначала в результате изменения конформации при взаимодействии с отрицательно заряженной поверхностью повреждённого эндотелия, затем частичным протеолизом мембранным комплексом калликреин-ВМК.
Высокомолекулярный кининоген - белок-активатор в ферментных мембранных комплексах ХIIа-ВМК, Xla-BMK и калликреин-ВМК. ВМК - гликопротеин плазмы крови, который синтезируется в печени и имеет молекулярную массу 120 кД. Он опосредует взаимодействие протеолитических ферментов контактной фазы свёртывания крови с коллагеном субэндотелия и, кроме того, является компонентом каллик-реин-кининовой системы.
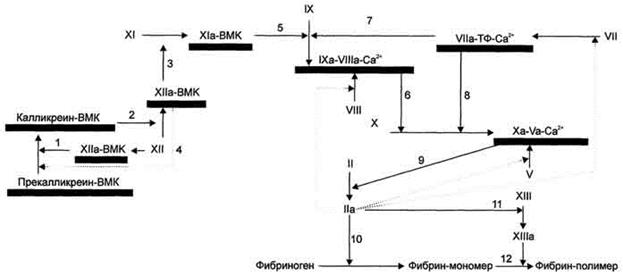
Рис. 8. Схема прокоагулянтного (внешнего) и контактного (внутреннего) путей свёртывания крови. Обозначения: ВМК - высокомолекулярный кининоген; ТФ - тканевый фактор; → - активация факторов свёртывания крови; ····> активация факторов свёртывания по принципу положительной обратной связи; - мембранный фосфолипидный компонент ферментных комплексов. Все ферменты мембранных комплексов свертывающей системы крови являются протеазами и активируются частичным протеолизом. 1 - активированный в результате контакта с субэндотелием фактор XII превращает прекалликреин в калликреин; 2 - калликреин мембранного комплекса калликреин-ВМК активирует фактор XII; 3 - фактор ХIIа активирует фактор XI; 4 - активированный частичным протеолизом фактор ХIIа превращает прекалликреин в калликреин по принципу положительной обратной связи; 5 - фактор XIa мембранного комплекса XIa-BMK активирует фактор IX; 6 - фактор (Ха мембранного комплекса IXa-VIIIa-Са2+ активирует фактор X; 7, 8 - фактор VIIa мембранного комплекса VIIa-Тф-Са2+ активирует факторы IX и X; 9 - фактор Ха протромбиназного комплекса активирует фактор II; 10, 11 - тромбин (фактор II) превращает фибриноген в фибрин и активирует фактор XIII; 12 - фактор XIIIa катализирует образование амидных связей в геле фибрина.
Калликреин - сериновая протеаза, субстратами которой являются, кроме фактора XII, белки плазмы крови плазминоген (профермент, участвующий в растворении фибрина) и кининогены с низкой (69 кД) и высокой (120 кД) молекулярной массой. При частичном протеолизе кининогенов образуются регуляторные пептиды кинины. В частности, мощный вазодилятатор брадикинин повышает проницаемость сосудов и вызывает разрушение клеточных мембран эндотелия.
В результате контакта фактора XII с субэндотелием сосудов он активируется. Активный фактор ХIIа в комплексе с ВМК протеолитически превращает прекалликреин, связанный с мембраной посредством ВМК, в калликреин. Мембранный комплекс калликреин-ВМК по принципу положительной обратной связи частичным протеолизом активирует фактор XII. При этом фактор XII приобретает максимальную ферментативную активность и по принципу положительной обратной связи активирует связанный с ВМК прекалликреин. Кроме того, образовавшийся в результате частичного протеолиза фактор ХIIа протеолитически активирует фактор XI, а фактор ХIа в составе ферментного комплекса XIa-ВМК активирует фактор IX. Фактор IХа мембранного комплекса 1Ха-VIIIa-Са2+ активирует фактор X, который в составе протромбиназного комплекса активирует протромбин.
Каскад реакций, ведущий к образованию тромбина, может реализоваться двумя путями - прокоагулянтным (внешним) и контактным (внутренним) (рис. 8). Для инициации реакций внешнего пути необходимо появление тканевого фактора на внешней поверхности плазматической мембраны клеток, соприкасающихся с кровью. Внутренний путь начинается с активации фактора XII при его контакте с повреждённой поверхностью эндотелия сосудов и взаимной активации ферментов прекалликреина и фактора XII.
Таким образом, в прокоагулянтном и контактном путях свёртывания крови последовательное образование мембранных ферментных комплексов приводит к активации фактора X и образованию протромбиназы. Этапы, одинаковые для обоих путей свёртывания крови, называют общим путём свёртывания крови. В настоящее время понятие о внутреннем и внешнем путях свёртывания считают достаточно условным, так как стало ясно, что комплекс УПа-ТФ-Са2+ более эффективно активирует фактор IX, чем фактор X, а фактор VII активируется фактором 1Ха, хотя и значительно медленнее по сравнению с активацией фактором Ха. Следовательно, можно полагать, что каскад реакций свёртывания крови идёт преимущественно в линейной последовательности, а не по двум относительно независимым путям. Контактный путь, очевидно, не является абсолютно необходимым для инициации свёртывания; по-видимому, он служит для сопряжения системы свёртывания крови с различными регуляторными сисгемами организма, например калликреин-кининовой и системой ферментов фиб-ринолиза, растворяющей тромб.
Кровь здорового человека in vitro свёртывается за 5-10 мин. При этом образование протромбиназного комплекса занимает 5 - 8 мин, активация протромбина - 2-5 с и превращение фибриногена в фибрин - 2-5 с.
Снижение свёртываемости крови. При снижении свёртываемости крови наблюдают заболевания, сопровождающиеся повторяющимися кровотечениями. Гемофилии - наследственные болезни, характеризующиеся повышенной кровоточивостью. Причиной этих кровотечений (спонтанных или вызванных травмой) является наследственная недостаточность белков свёртывающей системы крови.
Гемофилия А (классическая гемофилия) обусловлена мутацией гена фактора VIII, локализованного в X хромосоме. Классическая гемофилия составляет 80% всех случаев заболевания гемофилией. Гемофилия В встречается реже и обусловлена генетическим дефектом фактора IX.
Дефект гена фактора VIII проявляется как рецессивный признак, поэтому этой формой гемофилии болеют только мужчины. Это заболевание сопровождается подкожными, внутримышечными и внутрисуставными кровоизлияниями, иногда опасными для жизни. Дефект фактора VIII встречается примерно у одного из 10 000 новорождённых. Больных лечат препаратами, содержащими фактор VIII, получаемыми из донорской крови или методами генной инженерии.
Дата: 2019-03-05, просмотров: 614.