Биохимия обмена веществ
Тема: СВЁРТЫВАЮЩАЯ СИСTЕМА КРОВИ
Рис. 7. Структурные аналоги витамина К дикумарол и варфарин.
Активация ферментов каждого комплекса - результат взаимодействия всех его компонентов. Если факторы IX, X и II требуют активации, то фактор VII обладает невысокой протеолитической активностью. Фактор VII мембранного комплекса VII-ТФ-Са2+ частичным протеолизом активирует факторы IX и X. Активные факторы IХа и Ха включаются в образование мембранных комплексов IXa-VIIIa-Са2+ и Ха-Va-Са2+. При этом фактор Ха протеолитически активирует фактор V, а протромбиназный комплекс не только превращает протромбин в тромбин, но и активирует фактор VII, протеолитическая активность которого в комплексе VIIa-Тф-Са2+ в 10 000 раз выше, чем в комплексе VII-Тф-Са2+.
Образовавшийся в результате каскада реакций тромбин катализирует реакции частичного протеолиза фибриногена, фактора XIII и по принципу положительной обратной связи протеолитически активирует факторы V, VII и VIII.
В процессе свёртывания действуют 2 механизма усиления сигнала: каскад реакций, в котором каждое ферментативное звено обеспечивает усиление сигнала, и положительные обратные связи.
Контактный путь свертывания крови
Контактный путь свёртывания крови начинается с взаимодействия профермента фактора XII с повреждённой эндотелиальной поверхностью сосудистой стенки.
Такое взаимодействие приводит к активации фактора XII и инициирует образование мембранных ферментных комплексов контактной фазы свёртывания. Они содержат ферменты калликреин, факторы XIa (плазменный предшественник тромбопластина) и ХIIа (фактор Хагемана), а также белок-активатор - высокомолекулярный кининоген (ВМК) (рис. 8).
Фактор XII - профермент, циркулирующий в крови. Он последовательно активируется двумя способами: сначала в результате изменения конформации при взаимодействии с отрицательно заряженной поверхностью повреждённого эндотелия, затем частичным протеолизом мембранным комплексом калликреин-ВМК.
Высокомолекулярный кининоген - белок-активатор в ферментных мембранных комплексах ХIIа-ВМК, Xla-BMK и калликреин-ВМК. ВМК - гликопротеин плазмы крови, который синтезируется в печени и имеет молекулярную массу 120 кД. Он опосредует взаимодействие протеолитических ферментов контактной фазы свёртывания крови с коллагеном субэндотелия и, кроме того, является компонентом каллик-реин-кининовой системы.
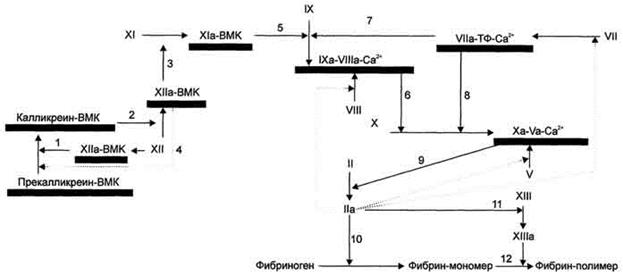
Рис. 8. Схема прокоагулянтного (внешнего) и контактного (внутреннего) путей свёртывания крови. Обозначения: ВМК - высокомолекулярный кининоген; ТФ - тканевый фактор; → - активация факторов свёртывания крови; ····> активация факторов свёртывания по принципу положительной обратной связи; - мембранный фосфолипидный компонент ферментных комплексов. Все ферменты мембранных комплексов свертывающей системы крови являются протеазами и активируются частичным протеолизом. 1 - активированный в результате контакта с субэндотелием фактор XII превращает прекалликреин в калликреин; 2 - калликреин мембранного комплекса калликреин-ВМК активирует фактор XII; 3 - фактор ХIIа активирует фактор XI; 4 - активированный частичным протеолизом фактор ХIIа превращает прекалликреин в калликреин по принципу положительной обратной связи; 5 - фактор XIa мембранного комплекса XIa-BMK активирует фактор IX; 6 - фактор (Ха мембранного комплекса IXa-VIIIa-Са2+ активирует фактор X; 7, 8 - фактор VIIa мембранного комплекса VIIa-Тф-Са2+ активирует факторы IX и X; 9 - фактор Ха протромбиназного комплекса активирует фактор II; 10, 11 - тромбин (фактор II) превращает фибриноген в фибрин и активирует фактор XIII; 12 - фактор XIIIa катализирует образование амидных связей в геле фибрина.
Калликреин - сериновая протеаза, субстратами которой являются, кроме фактора XII, белки плазмы крови плазминоген (профермент, участвующий в растворении фибрина) и кининогены с низкой (69 кД) и высокой (120 кД) молекулярной массой. При частичном протеолизе кининогенов образуются регуляторные пептиды кинины. В частности, мощный вазодилятатор брадикинин повышает проницаемость сосудов и вызывает разрушение клеточных мембран эндотелия.
В результате контакта фактора XII с субэндотелием сосудов он активируется. Активный фактор ХIIа в комплексе с ВМК протеолитически превращает прекалликреин, связанный с мембраной посредством ВМК, в калликреин. Мембранный комплекс калликреин-ВМК по принципу положительной обратной связи частичным протеолизом активирует фактор XII. При этом фактор XII приобретает максимальную ферментативную активность и по принципу положительной обратной связи активирует связанный с ВМК прекалликреин. Кроме того, образовавшийся в результате частичного протеолиза фактор ХIIа протеолитически активирует фактор XI, а фактор ХIа в составе ферментного комплекса XIa-ВМК активирует фактор IX. Фактор IХа мембранного комплекса 1Ха-VIIIa-Са2+ активирует фактор X, который в составе протромбиназного комплекса активирует протромбин.
Каскад реакций, ведущий к образованию тромбина, может реализоваться двумя путями - прокоагулянтным (внешним) и контактным (внутренним) (рис. 8). Для инициации реакций внешнего пути необходимо появление тканевого фактора на внешней поверхности плазматической мембраны клеток, соприкасающихся с кровью. Внутренний путь начинается с активации фактора XII при его контакте с повреждённой поверхностью эндотелия сосудов и взаимной активации ферментов прекалликреина и фактора XII.
Таким образом, в прокоагулянтном и контактном путях свёртывания крови последовательное образование мембранных ферментных комплексов приводит к активации фактора X и образованию протромбиназы. Этапы, одинаковые для обоих путей свёртывания крови, называют общим путём свёртывания крови. В настоящее время понятие о внутреннем и внешнем путях свёртывания считают достаточно условным, так как стало ясно, что комплекс УПа-ТФ-Са2+ более эффективно активирует фактор IX, чем фактор X, а фактор VII активируется фактором 1Ха, хотя и значительно медленнее по сравнению с активацией фактором Ха. Следовательно, можно полагать, что каскад реакций свёртывания крови идёт преимущественно в линейной последовательности, а не по двум относительно независимым путям. Контактный путь, очевидно, не является абсолютно необходимым для инициации свёртывания; по-видимому, он служит для сопряжения системы свёртывания крови с различными регуляторными сисгемами организма, например калликреин-кининовой и системой ферментов фиб-ринолиза, растворяющей тромб.
Кровь здорового человека in vitro свёртывается за 5-10 мин. При этом образование протромбиназного комплекса занимает 5 - 8 мин, активация протромбина - 2-5 с и превращение фибриногена в фибрин - 2-5 с.
Снижение свёртываемости крови. При снижении свёртываемости крови наблюдают заболевания, сопровождающиеся повторяющимися кровотечениями. Гемофилии - наследственные болезни, характеризующиеся повышенной кровоточивостью. Причиной этих кровотечений (спонтанных или вызванных травмой) является наследственная недостаточность белков свёртывающей системы крови.
Гемофилия А (классическая гемофилия) обусловлена мутацией гена фактора VIII, локализованного в X хромосоме. Классическая гемофилия составляет 80% всех случаев заболевания гемофилией. Гемофилия В встречается реже и обусловлена генетическим дефектом фактора IX.
Дефект гена фактора VIII проявляется как рецессивный признак, поэтому этой формой гемофилии болеют только мужчины. Это заболевание сопровождается подкожными, внутримышечными и внутрисуставными кровоизлияниями, иногда опасными для жизни. Дефект фактора VIII встречается примерно у одного из 10 000 новорождённых. Больных лечат препаратами, содержащими фактор VIII, получаемыми из донорской крови или методами генной инженерии.
Рис. 10. Механизм действия простациклина, тромбоксана .
Образующийся комплекс кальмодулин-4Са2+-миозинкиназа фосфорилирует миозин, взаимодействие которого с актином приводит к изменению формы Tr, к их адгезии и агрегации. ПК С, кроме того, фосфорилирует белок Tr плекстрин. Фосфорилированный плекстрин вызывает "реакцию освобождения" содержащихся в гранулах Tr вторичных индукторов активации и агрегации Tr. К этим веществам относят содержащиеся в плотных гранулах Tr АДФ, Са2+, ГДФ, серотонин, гистамин и присутствующие в осгранулах белок β-тромбоглобулин, фактор фон Виллебранда, белок фибронектин, тромбосподин и ВМК. Тромбосподин участвует во взаимодействии тромбоцитов друг с другом. β-Тромбоглобулин снижает секрецию простациклина и связывает гепарин. Фибронектин имеет центры связывания для коллагена, гепарина и тромбоцитов.
AДФ содержится в Tr, а также попадает в кровь при разрушении эритроцитов. АДФ взаимодействует со специфическими рецепторами и подавляет активность аденилатциклазы. Это вызывает увеличение мобилизации внутриклеточного Са2+ и в конечном итоге приводит к агрегации Tr.
Активация Tr, таким образом, сопровождается изменением их метаболизма и освобождением биологически активных веществ. Эти вещества вызывают морфологические изменения, адгезию, агрегацию Tr и участвуют в образовании тромба.
Нарушение функциональной активности рецепторов и системы вторичных посредников Tr приводит к изменению их функции и может явиться причиной ряда заболеваний, сопровождающихся тромбозами или кровотечениями.
Лекарственные препараты, нарушающие агрегацию тромбоцитов, используют для предупреждения возникновения тромбозов. Аспирин (ингибитор циклооксигеназы), никотиновая кислота (ингибитор тромбоксансинтетазы) и Са2+-блокаторы угнетают агрегацию тромбоцитов, влияя на разные этапы реализации тромбогенного сигнала.
Тромб растворяется в течение нескольких дней после образования.
Фибринолиз - ферментативное расщепление волокон фибрина с образованием растворимых пептидов, которые удаляются из сосудистого русла. Разрушение фибрина в составе тромба происходит под действием сериновой протеазы плазмина.
Плазмин образуется из плазминогена под действием активаторов. Неактивный профермент плазмина плазминоген синтезируется в печени, почках и костном мозге.
Тканевый активатор плазминогена (ТАП) - протеолитический фермент, содержащийся в эндотелии сосудов всех тканей, кроме печени. Поступление этого активатора в кровь увеличивается при эмоциональном напряжении, боли, венозной тромбоэмболии, умеренной физической работе. ТАП частичным протеолизом превращает неактивный плазминоген в активный плазмин. Активаторами плазминогена также служат фактор ХIIа и калликреин.
Растворение фибринового сгустка происходит при взаимодействии фибрина, плазминогена и ТАП (рис. 11).
Формирование сети фибриновых волокон при образовании тромба сопровождается сорбцией на ней плазминогена и его активаторов. В молекуле плазмина и плазминогена есть участки, комплементарные доменам фибрина, причём одна молекула плазмина может связывать несколько молекул фибрина. Молекулы ТАП тоже имеют центры связывания с фибрином. Образующийся из плазминогена под действием ТАП плазмин гидролизует фибрин с образованием пептидов X и Y, активирующих фибринолиз, и пептидов D и E, его тормозящих. Растворимые пептиды X, Y, D, E поступают в кровоток и там фагоцитируются. Разрушение тромба приводит к освобождению из него плазмина и ТАП. В кровяном русле последние быстро инактивируются специфическими ингибиторами и улавливаются печенью.
ТАП ингибируется ингибиторами тканевого активатора плазмина первого (и-ТАП-1) и второго (и-ТАП-2) типов, а плазмин - α2-антиплазмином или другими ингибиторами сериновых протеаз.
В почках синтезируется протеолитический активатор плазминогена урокиназа, которая, превращая плазминоген в плазмин, способствует освобождению почечных клубочков от фибриновых волокон. Из β-гемолитического стрептококка выделили белок стрептокиназу, образующий комплекс с плазминогеном, в котором плазминоген аутокаталитически превращается в плазмин.
Урокиназу, стрептокиназу и ТАП используют при тромболитической терапии инфаркта миокарда, тромбозах вен и артерий, гемодиализе.
Такие ингибиторы ферментов свёртывания крови, как α2-макроглобулин, α1-антитрипсин и комплекс антитромбин III-гепарин также обладают небольшой фибринолитической активностью.
Снижение фибринолитической активности крови сопровождается тромбозами. Нарушение разрушения фибринового сгустка может быть вызвано наследственным дефицитом плазмино-гена или генетическим дефектом его структуры, снижением поступления в кровь активаторов плазминогена, повышением содержания в крови ингибиторов фибринолиза (и-ТАП-1, и-ТАП-2, α2-антиплазмина).
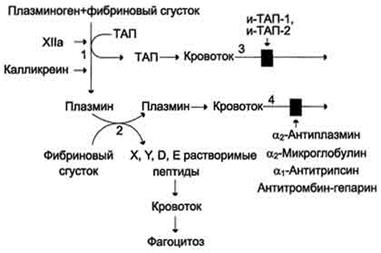
| Рис. 11. Схема фибринолиза. 1 - абсорбированный на фибриновом сгустке плазминоген под действием активаторов (фактор ХIIа, калликреин, ТАП) частичным протеолизом превращается в плазмин; 2 - плазмин гидролизует фибрин с образованием растворимых пептидов X, Y,D, E; 3 - в кровотоке ТАП инактивируется специфическими белками и-ТАП-1, и-ТАП-2; 4 - активность плазмина снижается под действием неспецифических ингибиторов сериновых протеаз (α2-антиплазмина, α2-макроглобулина, α1-антитрипсина, комплекса антитромбин-гепарин). |
|

Наследственные и приобретённые нарушения гемостаза могут привести как к геморрагическим заболеваниям, характеризующимся кровоточивостью, так и к тромботической болезни. Однако следует отметить, что повышенная склонность к тромбообразованию и внутрисосудистому свёртыванию (тромбофилии) встречается гораздо чаще, чем гемофилии. Например, частота разных форм гемофилии колеблется в разных странах от 6 до 18 на 100 000 мужчин, в то время как тромбофилии, вызванные дефицитом антитромбина III, встречаются у 1-2 больных на 5000, а при недостатке протеина С - у одного на 15 000 человек.
II Цель деятельности студентов на занятии
Студент должен знать:
1. Что такое коагуляция;
2. Какие этапы свертывания различают;
3. Перечислить факторы свертывания;
4. Как происходит образование фибринового (красного) тромба;
5. Фибриноген, строение и свойства;
6. описать первый этап гемокоагуляции: превращение фибриногена в мономер фибрина;
7. Как происходит образвание нерастворимого геля фибрина (2 этап);
8. Опишите 3 этап- стабилизация геля фибрина;
9. Как происходит ретракция фибринового сгустка (4 этап);
10. Прокоагулянтный путь свертывания крови ( тромбин, тканевый фактор);
11. Противосвертывающая система крови;
12. Антиокагулянтная фаза (тромбомодулин, протеин С);
13. Ингибиторы ферментов свертывания крови ( антитромбин III, α2 -макроглобулин, α1- антитрипсин, антиконвертин);
14. Фибринолиз
Студент должен уметь:
1. Написать схему свертывания крови
III Содержание обучения:
Основные вопросы:
1. Коагуляция;
2. Этапы свертывания различают;
3. Факторы свертывания;
4. Образование фибринового (красного) тромба;
5. Фибриноген, строение и свойства;
6. Первый этап гемокоагуляции: превращение фибриногена в мономер фибрина;
7. Образвание нерастворимого геля фибрина (2 этап);
8. 3 этап- стабилизация геля фибрина;
9. Ретракция фибринового сгустка (4 этап);
10. Прокоагулянтный путь свертывания крови ( тромбин, тканевый фактор);
11. Противосвертывающая система крови;
12. Антиокагулянтная фаза (тромбомодулин, протеин С);
13. Ингибиторы ферментов свертывания крови ( антитромбин III, α2 -макроглобулин, α1- антитрипсин, антиконвертин);
14. Фибринолиз.
ЛАБОРАТОНАЯ РАБОТА №1
Проба Вельтмана
Принцип метода: Проба Вельтмана позволяет определить соотношение между белковыми фракциями, т. е. эта проба на коллоидоустойчивость. Она основана на том, что при добавлении хлористого кальция глобулины сыворотки крови образуют осадок. Альбумины в этих условиях препятствуют выпадению глобулинов, поэтому относительное уменьшение содержания альбуминов или увеличение количества глобулинов облегчает появление осадка при данной пробе.
Методика выполнения. Для проведения пробы Вельтмана берут ряд из 10 пробирок пронумерованных с растворами хлористого кальция убывающей концентрации (от 0,1% в первой пробирке до 0,01% в последней пробирке).
| №№ п/п | Добавляемые | Концентрация СаСI2, % | |
| СаСI2, 0,1% р-р | Н2О | ||
| 1 | 5,0 | 0,5 | 0,10 |
| 2 | 4,5 | 1,0 | 0,09 |
| 3 | 4,0 | 1,5 | 0,08 |
| 4 | 3,5 | 2,0 | 0,07 |
| 5 | 3,0 | 2,5 | 0,06 |
| 6 | 2,5 | 3,0 | 0,05 |
| 7 | 2,0 | 3,5 | 0,04 |
| 8 | 1,5 | 4,0 | 0,03 |
| 9 | 1,0 | 4,5 | 0,02 |
| 10 | 0,5 | 5,0 | 0,01 |
Затем во все пробирки, начиная с 10, вносят по 0,1 мл сыворотки. Перемешивают содержимое пробирок стеклянными палочками, начиная с пробирки 10, и помещают все пробирки в кипящую баню на 15 минут. По истечении этого срока отмечают в каких пробирках имеется флокуляция (при этом учитываются только хлопья, но не помутнение).
Предполагаемые результаты: Белки здорового человека дают в этих условиях флокуляцию (выпадение хлопьев) в пробирках с концентрацией хлористого кальция от 0,1% до 0,04-0,05%, т. е. до 6-7 пробирки. Появление хлопьев в 7-10 пробирках указывает на наличие в организме патологического процесса, сопровождающегося изменением соотношений между белковыми фракциями. Это бывает при болезни Боткина, атрофии печени и т. д. Появление флокуляции в пробирках 8-10 носит название — расширение полосы коагуляции. При ряде состояний полоса коагуляций суживается, т. с. флокуляция в 6-7 пробирках отсутствует. Это бывает при воспалительных процессах, опухолях и ряде других заболеваний.
Выводы:
VII Перечень вопросов для проверки конечного уровня знаний:
1. Кровь, ее функции. Белковый спектр плазмы крови. Белки «острой фазы» и их клиническое значение;
2. Характеристика основных белковых фракций плазмы крови: альбуминов, глобулинов, фибриногена;
3. Гиперпротеинемия и гипопротеинемия;
4. Плазменные липопротеиды и гликопротеиды;
5. Иммуноглобулины, их классы, структура, синтез и роль в иммунитете;
6. Ферменты крови и их клиническое значение для диагностики заболеваний;
7. Важнейшие азотсодержащие соединения. Остаточный азот: азотемия. Азотемия ретенционная и продукционная.
8. Безазотистые органические компоненты крови.
9. Что такое коагуляция;
10. Какие этапы свертывания различают;
11. Перечислить факторы свертывания;
12. Как происходит образование фибринового (красного) тромба;
13. Фибриноген, строение и свойства;
14. описать первый этап гемокоагуляции: превращение фибриногена в мономер фибрина;
15. Как происходит образвание нерастворимого геля фибрина (2 этап);
16. Опишите 3 этап- стабилизация геля фибрина;
17. Как происходит ретракция фибринового сгустка (4 этап);
18. Прокоагулянтный путь свертывания крови ( тромбин, тканевый фактор);
19. Противосвертывающая система крови;
20. Антиокагулянтная фаза (тромбомодулин, протеин С);
21. Ингибиторы ферментов свертывания крови ( антитромбин III, α2 -макроглобулин, α1- антитрипсин, антиконвертин);
22. Фибринолиз.
VIII Хронокарта учебного занятия:
1. Общий бюджет времени: 3 (125);
2. Перекличка 5 минут;
3. Разбор основных вопросов темы 60 минут;
4. Тестовый опрос 20 минут;
5. Проведение лабораторной работы;
6. Оформление протоколов 10 минут
IX Самостоятельная работа студентов:
Составление тестов, задач и кроссвордов по данной теме.
Вопросы для самостоятельного обучения:
1. Описание гемофилии А;
Роль Tr в гемостазе;
Биохимия обмена веществ
Тема: СВЁРТЫВАЮЩАЯ СИСTЕМА КРОВИ
Дата: 2019-03-05, просмотров: 642.