2.1. Биофизика белка и нуклеиновых кислот
Основными объектами молекулярной биофизики являются белки и нуклеиновые кислоты. Основная задача молекулярной биофизики - выяснение связи физической структуры и свойств биологически важных молекул с выполняемой ими в организме функцией. Под структурой молекулы понимают расположение в пространстве всех ее атомов. В молекулярной биофизике характеристика молекулы включает в себя структурную химическую формулу, длины всех связей и углы между связями, распределение зарядов на поверхности, подвижность отдельных участков и изменчивость структуры в зависимости от параметров среды: температуры, ионной силы, рН, наличия определенных ионов и др. Белки и нуклеиновые кислоты представляют собой информационные макромолекулы, кодирование информации в которых осуществляется соответственно аминокислотным или нуклеотидным алфавитом. Макромолекулы полисахаридов состоят из одинаковых звеньев и поэтому не несут информации. Молекулы белков и нуклеиновых кислот характеризуются строго определенной последовательностью мономеров, связанных ковалентными связями. Белки и нуклеиновые кислоты — неразветвленные линейные сополимеры. Структура их ковалентной цепочки может быть записана в виде А1-А2-А3-А4-...-Аn , где А означает звено (мономер) в цепи. Мономерами белка являются α-аминокислоты (вещества, содержащие аминогруппу и карбоксильную группу), мономерами нуклеиновых кислот – нуклеотиды (вещество, состоящее из остатков азотистого основания, углевода пентозы и фосфорной кислоты). Особенностью белков и нуклеиновых кислот, отличающей их от многих синтетических полимеров, является то, что их мономерные единицы всегда соединены по принципу «голова к хвосту», т.е. цепи имеют определенное направление. Для описания химической структуры необходимо указать последовательность всех остатков. Полная ковалентная химическая структура может содержать несколько полимерных цепей, а последние могут быть соединены между собой поперечными ковалентными мостиками; подобные же мостики иногда соединяют части одной и той же цепи. Полная ковалентная структура (порядок объединения мономеров в полимерную цепь) называется первичной структурой. Аминокислоты в белке соединяются с помощью пептидных связей, нуклеотиды в нуклеиновых кислотах – за счет сахаро-фосфатных (фосфодиэфирных) связей. Эти связи по своей природе являются ковалентными полярными. Важная особенность структуры белков и нуклеиновых кислот заключается в стабилизации положения химических групп в пространстве с минимальной внутренней энергией. Это достигается, в частности, за счет образования водородных связей.
Регулярное расположение в пространстве химических групп (пептидных в белках, пуриновых и пиримидиновых оснований в нуклеиновых кислотах) создает вторичную структуру биополимеров. Вторичная структура ДНК представляет собой двойную спираль, стабилизированную водородными связями между комплементарными азотистыми основаниями образующих спираль цепей. Как известно из химии, вращение в молекулах вокруг одинарных связей приводит к появлению поворотных изомеров, то есть молекул с различной конформацией. В белках вращение вокруг пептидной связи С— N затруднено (энергия активации вращения 40-80 кДж/моль), так как связь частично имеет характер двойной связи. Поэтому белок можно рассматривать как цепь из связанных друг с другом плоских пептидных звеньев. Вращение этих звеньев возможно вокруг одинарных связей α- углерода аминокислот.
Л. Полинг и Р. Кори установили два основных варианта вторичной структуры белковой цепи: α-спираль и β-форму. α- спирали могут быть лево- и правозакрученными. β-Формы бывают параллельными и антипараллельными. Кроме того, в белках встречаются участки, не образующие регулярной структуры, так называемые неупорядоченные структуры. Например, в гемоглобине 75 % аминокислот образуют правозакрученные α-спирали, а остальные участки полипептидных цепей являются неупорядоченными; они располагаются преимущественно в местах пространственных изгибов спирализованной цепи. Возможность изгибов в цепи и наличие в молекулах белков различных типов взаимодействий (ионных, гидрофобных, образование дисульфидных и водородных связей) между группами, далеко отстоящими друг от друга в полипептидной цепи, приводят к компактной укладке этой цепи. Расположение в пространстве элементов вторичной структуры и неупорядоченных звеньев полипептидной цепи называется третичной структурой белка. Различие между вторичной и третичной структурами в определенной степени условно, так как в действительности мы имеем дело с единственной пространственной структурой.
Высшим уровнем структурной организации биоплимеров является четвертичная структура. Она образуется путем ассоциации (за счет нековалентных взаимодействий) независимых субъединиц третичной структуры. Субъединицы четвертичной структуры могут быть как одинаковыми, так и различными, а их расположение в четвертичной структуре - как симметричным, так и несимметричным. Пример простой четвертичной структуры мы видим в случае гемоглобинов позвоночных. Молекула этих белков состоит из четырех субъединиц; она содержит по две субъединицы двух типов — α и β. Каждая субъединица представляет собой одну полипептидную цепь, сложенную в компактную третичную глобулярную структуру. С каждой цепью глобина связана одна группа гема.
Знание физической природы сил, определяющих стабильную конформацию, позволяет понять действие тех или иных факторов среды (температуры, ионов, лекарственных веществ) на структуру макромолекул, понять как и почему может нарушиться структура и функционирование биомолекул при развитии патологии, и, следовательно, какие лекарственные препараты нужно использовать для нормализации физиологических процессов.
Вопросы и задания для самоподготовки
1. Что является мономером белка?
2. Охарактеризуйте пептидную связь.
3. Первичная, вторичная и третичная структура белка.
4. Какие связи поддерживают структуру белков и нуклеиновых кислот?
Рекомендуемая литература
1. Биофизика : учеб. для вузов / Ю.А. Владимиров [и др.]. – М., 1983. – С. 63 - 69.
2. Волькенштейн М.В. Биофизика : учеб. пособие / М.В. Волькенштейн. – М., 1988. – С. 32-40; 87-94; 108-118; 222-231.
3. Мушкамбаров Н.Н. Молекулярная биология : учеб. пособие / Н.Н. Мушкамбаров, С.Л. Кузнецов. – М., 2003. – С. 6-8; 117-125; 169-185.
Тема 3. Биофизика мембран
3.1. Структура и функции биологических мембран. Динамика биомембран. Модельные липидные мембраны
Многие жизненные процессы протекают на биологических мембранах. Нарушение мембранных процессов - причина многих патологий. Лечение также во многих случаях связано с воздействием лекарственных веществ на функционирование биологических мембран. Важнейшее условие существования клетки, и, следовательно, жизни – нормальное функционирование биологических мембран. Основные функции биологических мембран:
– барьерная — обеспечивает селективный, регулируемый, пассивный и активный обмен веществом с окружающей средой (селективный – значит, избирательный: одни вещества переносятся через биологическую мембрану, другие – нет; регулируемый – проницаемость мембраны для определенных веществ меняется в зависимости от функционального состояния клетки);
– матричная – обеспечивает определенное взаимное расположение и ориентацию мембранных белков, обеспечивает их оптимальное взаимодействие для функционирования;
– механическая – обеспечивает прочность и автономность клетки, внутриклеточных структур;
– энергетическая – синтез АТФ на внутренних мембранах митохондрий и фотосинтез в мембранах хлоропластов;
– генерация и проведение биопотенциалов;
– рецепторная (механическая, акустическая, обонятельная, зрительная, химическая, терморецепция – мембранные процессы) и многие другие функции.
Общая площадь всех биологических мембран в организме человека достигает десятков тысяч квадратных метров. Структура биологических мембран Совокупность результатов, полученных физическими и химическими методами исследования, дала возможность предложить жидкостно - мозаичную динамическую модель строения биологических мембран (Сингер и Николсон, 1972 г.). Согласно этой модели структурную основу биологической мембраны образует двойной слой липидов (в основном 17 фосфолипидов), белки в этом слое расположены мозаично (рис. 3.1.1).

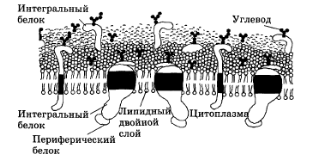
Рис. 3.1.1. Жидкостно - мозаичная модель строения биологических мембран.
Различают поверхностные (или периферические), полупогруженные и интегральные белки. Липиды находятся при физиологических условиях в жидком агрегатном состоянии. Это позволяет сравнить мембрану с фосфолипидным морем, по которому плавают белковые "айсберги". Полярные головы молекул фосфолипидов - гидрофильны, а их неполярные хвосты - гидрофобны. В смеси фосфолипидов с водой термодинамически выгодно, чтобы полярные головы были погружены в состоящую из полярных молекул воду, а их неполярные хвосты были бы расположены подальше от воды. Такое расположение амфифильных (имеющих и гидрофильную, и гидрофобную части) молекул соответствует наименьшему значению энергии по сравнению с другими возможными расположениями молекул. Кроме фосфолипидов и белков, в биологических мембранах содержатся и другие химические соединения. В мембранах животных клеток много холестерина. Есть в мембранах и другие вещества, например гликолипиды, гликопротеиды.
Мембрана – динамическое образование, так как и белки, и липиды способны перемещаться в составе мембраны. Различают латеральную диффузию (перемещение в одном слое) и трансбислойный (флип-флоп) переход (перескок молекулы из одного слоя мембраны в другой).
Функционирование мембраны сильно зависит от микровязкости липидного бислоя и подвижности фосфолипидных молекул в мембране, фазового состояния мембранных липидов. Отклонения биофизических характеристик липидного бислоя от нормы связано с разного рода патологиями. Так, например, при воспалении в результате пероксидного окисления ненасыщенных жирных кислот в составе фосфолипидов вязкость мембраны увеличивается, а это приводит к нарушению функционирования клетки в целом. В основе многих патологических состояний организма человека лежат изменения структурно-функциональных свойств молекулярных компонентов биомембран, которые происходят при воздействии внешних факторов среды (фармакологические агенты, яды, токсины, аллергены, ионизирующее и УФ-излучение и др.) или при внутренних функциональных расстройствах. К заболеваниям подобного рода следует отнести гипертонию, атеросклероз, ишемию, бронхолегочные заболевания, различные воспаления, злокачественный рост клеток. В связи с этим всесторонние исследования механизмов функционирования биомембран в норме и при патологии необходимы как для разработки методов лечения и профилактики вышеназванных заболеваний, так и для создания высокоэффективных лекарственных препаратов.
Модельные липидные мембраны
Липосомы, или фосфолипидные везикулы (пузырьки), получают обычно при набухании сухих фосфолипидов в воде или при впрыскивании раствора липидов в воду. При этом происходит самосборка бимолекулярной липидной мембраны. Минимуму энергии Гиббса отвечает замкнутая сферическая одноламеллярная форма мембраны. При этом все неполярные гидрофобные хвосты находятся внутри мембраны и ни один из них не соприкасается с полярными молекулами воды (рис. 3.1.2.).
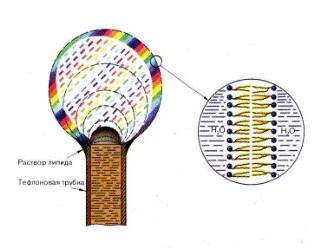
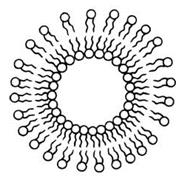
Рис. 3.1.2. Схема строения однослойной липосомы.
Однако чаще получаются несферические многоламеллярные липосомы, состоящие из нескольких бимолекулярных слоев, - многослойные липосомы. Отдельные бимолекулярные слои многослойной липосомы отделены водной средой. Диаметр многослойных липосом колеблется в пределах от 60 до 400 нм и более. Однослойные липосомы можно получить различными методами, например из суспензии многослойных липосом, если обработать их ультразвуком. Диаметр однослойных липосом, полученных этим методом, составляет 25 - 30 нм. Липосомы служат моделью для исследований различных свойств клеточных мембран. Липосомы нашли непосредственное применение в изготовлении лекарств. Например, можно заключить внутрь липосом лекарственный препарат и использовать как фосфолипидную микрокапсулу для доставки лекарства в определенные органы и ткани. Липосомы не токсичны (при правильном подборе липидов), полностью усваиваются организмом, способны преодолевать некоторые биологические барьеры. Так, инсулин, заключенный в липосому, защищен от действия пищеварительных ферментов. В настоящее время выясняется возможность вводить этот препарат в липосомах перорально, что может избавить больных диабетом от необходимости систематических уколов. Проводятся работы по разработке методов липосомальной терапии опухолей, ферментативной недостаточности, атеросклероза. Изучается возможность прицельной доставки лекарственного препарата, заключенного в липосомах, к больному органу или даже к больному участку (в частности, к пораженному участку сердца). Для этого к липосоме присоединяется белковая молекула - антитело к соответствующему мембранному антигену органа-мишени. Несмотря на заманчивые перспективы липосомальной терапии, еще имеется достаточно много нерешенных вопросов.
Вопросы и задания для самоподготовки
1. Что собой представляет мозаичная жидкокристаллическая модель биомембраны?
2. Мембранные белки, их структура, свойства и функции.
3. Какие вы знаете типы жидкокристаллических структур? Какой тип жидкокристаллической структуры имеет биомембрана?
4. Охарактеризуйте динамику структурных элементов биомембраны: латеральную диффузию и трансмембранные переходы («флип-флоп» переходы).
5. Какие вы знаете примеры модельных липидных мембран?
6. Что собой представляют мицеллы и липосомы (везикулы)?
Рекомендуемая литература
1. Ремизов А.Н. Медицинская и биологическая физика : учеб. для вузов / А.Н. Ремизов, А.Г. Максина, А.Я. Потапенко. – М., 2003. – С. 184- 190.
2. Биофизика : учеб. для вузов / В.Ф. Антонов [и др.]. – М., 1999. – С. 8-31.
3. Артюхов В.Г. Биологические мембраны: структурная организация, функции, модификации физико-химическими агентами : учеб. пособие / В.Г. Артюхов, М.А. Наквасина. - Воронеж, 1994. – С. 11-62.
Дата: 2019-03-05, просмотров: 381.