| соединение | r, г/см3 | tпл, оС | tкип, оС | -DН298, ккал/моль | -DНпл, ккал/моль | -DНисп, ккал/моль | S298, кал/ (моль.град) |
| NaCl | 2,163 | 800,4 | 1465 | 98,23 | 7,2 | 50,7 | 17,33 |
| KCl | 1,988 | 776 | 1500 | 104,20 | 6,7 | 38,84 | 19,7 |
| CaCl2 | 2,512 | 772 | 1900 | 190,6 | 6,1 | - | 27,2 |
| MgCl2 | 2,325 | 718 | 1412 | 153,4 | 8,1 | 46,6 | 21,4 |
| AlCl3 | 2,44 | 192,4 | 182,7 | 166,4 | 8,48 | 9,5 | 36,9 |
| FeCl3 | 2,804 | 303 | 319 | 93,5 | 20,59 | 12,04 | - |
| FeCl2 | 2,98 | 674 | 1023 | 81,9 | 7,8 | 30,21 | 23,7 |
| LaCl3 | 3,94 | 872 | 1497 | 263,7 | 10,3 | - | 43,0 |
| CeCl3 | 3,92 | 800 | 1427 | 259,8 | - | - | - |
| NdCl3 | 4,13 | 750 | 1387 | 254,3 | - | - | - |
| YCl3 | — | 721 | - | 234,8 | - | - | 41,5 |
| SiCl4 | 1,50 | -69 | 57 | 150,1 | 1,85 | 7,19 | 57,4 |
| TiCl4 | 1,726 | -23 | 136 | 181,4 | 2,23 | 8,35 | 60,4 |
| ZrCl4 | 2,80 | 437 | 331,возг. | 230 | 5,7 | 25,0 | 44,5 |
| HfCl4 | — | 432 | 314 | 253,6 | - | 24,6 | 53,0 |
| SnCl4 | 2,28 | -33 | 114,1 | 127,4 | 2,19 | 8,9 | 62,1 |
| ThCl4 | 4,60 | 770 | 857 | 335 | 9,6 | 36,5 | 54,0 |
| UCl4 | 4,87 | 590 | 792 | 251 | 14,7 | 47,7 | 47,1 |
| VCl4 | - | -36 | 145 | 165 | - | 8,2 | 47,5 |
| VOCl3 | — | -80 | 127 | 180 | - | - | - |
| NbCl5 | 2,75 | 203,0 | 247,5 | 190,6 | 7,5 | 13,0 | 60,0 |
| NbOCl3 | - | 335,возг. | - | 210,2 | - | 26,1 | 38,0 |
| TaCl5 | 3,68 | 216 | 242 | 205,2 | 8,2 | 21,6 | - |
Зависимость давления насыщенного пара хлоридов от температуры определяется уравнением Клапейрона — Клаузиуса:
d ln p = (DНисп/RT2)dT (21)
где DНисп - разница в энтальпии парообразного и конденсированного веществ.
В определенном температурном интервале эта зависимость достаточно точно выражается уравнением
lg p = -A/T + B
а в более широком интервале температуры
lg p = -A/T + Blg T + C
Только в случае индивидуального вещества конденсация происходит при температуре кипения. Для смеси веществ температура конденсации определяется точкой росы - так называется температура, при которой перегретый пар данного давления становится насыщенным. Перегретый пар небольшого давления удовлетворительно подчиняется законам идеальных газов. Это позволяет рассчитывать точку росы из данных по парциальному давлению конденсирующегося компонента:
ln pi = {[1-(Ti/Tкип)] / (Ti/Tкип)} . (DН/RTкип) (22)
где Ti - точка росы, °К. Согласно правилу Трутона, для неассоциированных веществ DН/Tкип » 21-23 кал/моль. Отсюда
ln pi = 11[1-(Ti/Tкип)] / (Ti/Tкип) (22)
Из-за значительной запыленности парогазовой смеси при конденсации пересыщение пара не происходит, так как частицы твердой фазы служат центрами конденсации. На практике конденсацию осуществляют при атмосферном давлении. Для ряда хлоридов металлов давление и температура в конденсаторе существенно меньше, чем в тройной точке. Поэтому FeCl3, AlCl3, NbOCl3, TaCl5, NbCl5, ZrCl4, HfCl4 и др. конденсируются в виде твердых хлоридов. В то же время TiCl4, SiCl4, VCl4, VOCl3, РОС13 и др. конденсируются в жидком состоянии. Так как конденсация происходит из смеси паров и газов, она протекает не при постоянной температуре. В процессе конденсации уменьшается парциальное давление конденсируемого компонента и понижается точка росы.
Конденсация происходит в объеме парогазовой фазы и на охлаждаемых поверхностях конденсаторов. Наиболее существенный вклад в процесс вносят конденсация хлоридов на стенках пылевых камер, контактная конденсация хлоридов при орошении их жидкостью и пленочная конденсация в трубчатых холодильниках.
Кинетика конденсации изучена недостаточно и в значительной степени определяется конструкцией аппарата. Скорость конденсации пропорциональна поверхности конденсатора и перепаду температуры. Лимитирующей стадией процесса конденсации, как правило, является отвод тепла. Полнота конденсации и, следовательно, содержание хлоридов в отходящих газах зависят от температуры конденсатора и от степени разбавления хлоридов газами: они тем меньше, чем больше температура конденсатора и разбавление. В то же время конденсирование твердой фазы ведут, как правило, при температуре, оптимальной для образования крупных кристаллов, чтобы получить продукты с высоким насыпным весом. Серьезным осложнением процесса конденсации является налипание твердых продуктов на стенки конденсатора и нарушение условий нормальной теплопередачи. Чтобы избежать этого, конденсаторы оборудуют различными механическими приспособлениями: мешалками, вибраторами, скребками и т. д.
Основные аппараты конденсационной системы показаны на рис. 16.
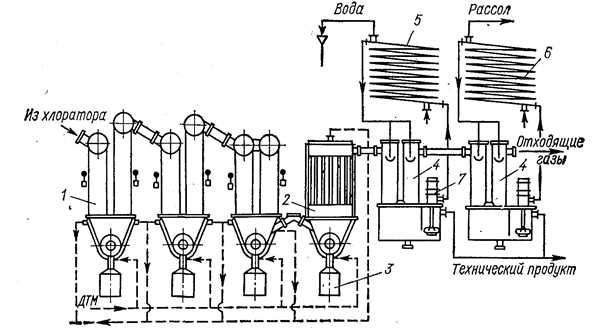
Рис. 16. Основные аппараты конденсационной системы процесса получения TiCl4 хлорированием шлаков в расплаве солей (Коршунов Б. Г., Стефанюк С. Л„ М„ 1970, с. 205, рис. 43):
1 - кулер; 2 - рукавный фильтр; 3 - контейнер; 4 - оросительный конденсатор; 5 - холодильник водяной; 6 - холодильник рассольный; 7 - погружной насос.
Улавливание пыли и твердых хлоридов является первой ступенью конденсационной системы. Эффективное удаление твердой части из парогазовой смеси улучшает работу последующих аппаратов. Наряду с оросительными конденсаторами используют трубчатые аппараты. Раздельная конденсация твердых и жидких хлоридов позволяет уже в начале процесса добиться существенного разделения продуктов хлорирования. Иногда проводят совместную конденсацию твердых и жидких хлоридов в скрубберах или аппаратах барботажного типа. Получающуюся пульпу разделяют на твердую и жидкую фазы. В зависимости от количества твердого для этого используют сгустители, центрифуги или различные фильтры. Тот или иной способ или их комбинацию выбирают главным образом в зависимости от состава парогазовой смеси. Обязательным условием нормального проведения процесса конденсации является герметичность системы, так как большинство хлоридов и оксихлоридов весьма гигроскопичны. Выходящие из конденсационной системы газы проходят санитарную очистку в скрубберах, орошаемых известковым молоком или водой.
Более тонкое разделение хлоридов редких металлов и их очистка осуществляются химическими методами, ректификацией и пропусканием их через расплав солей щелочных и щелочноземельных металлов. Химические методы специфичны и будут рассмотрены при описании конкретных технологических схем.
Ректификацию применяют для разделения хлоридов с близкими значениями температуры кипения и с достаточным интервалом жидкого состояния. Разделение при ректификации основано на различном составе равновесных жидкой и паровой фаз (рис. 17). Жидкость состава х1 при нагревании до температуры кипения t1 (точка а) переходит в пар состава x2 (точка b). При конденсации состав его не меняется (точка с). Вновь переводя полученный конденсат в пар при температуре t2, достигают еще большего обогащения по легкокипящему компоненту x3 (точка d}. После конденсации - точка е. При дальнейшем нагревании до температуры t3 получается пар состава х4 (точка f) и т. д. В результате многократного повторения процессов испарения жидкости и конденсации пара можно разделить исходную смесь на индивидуальные вещества. Процесс проводят в ректификационных колоннах, в которых осуществляется многократный контакт между неравновесными жидкой и паровой фазами, движущимися противотоком (рис. 18). Ректификация может быть непрерывной или периодической. Расчет необходимого числа теоретических контактов разделения (теоретических тарелок, ступеней) осуществляют графически из данных по равновесию жидкость—пар системы и материального баланса колонны.
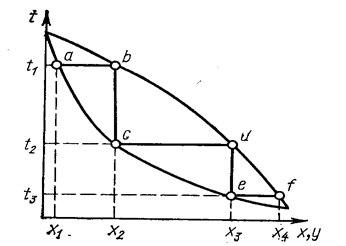
Рис. 17. Изображение процесса разделения бинарной смеси путем ректификации на диаграмме t-x-у (Касаткин А. Г., 1971, с. 509, рис. XII.13).
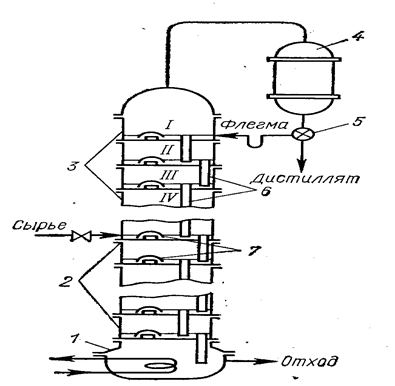
Рис. 18. Схема устройства ректификационной колонны (Погорелый А. Д., М., 1971, с. 71, рис. 34):
1- куб (кипятильник); 2 - исчерпывающая часть колонны; 3 - укрепляющая часть колонны; 4 - конденсатор; 5- регулятор соотношения флегма – дистиллят; 6 – трубка для стока флегмы; 7 – колпачки, диспергирующие пар.
Солевая очистка хлоридов редких металлов основана на том, что они образуют с хлоридами щелочных металлов в расплаве соединения с различной термической устойчивостью. Свойства этих соединений показаны в табл. 16.
Таблица 16
Свойства соединений хлоридами некоторых металлов с хлоридами натрия и калия
| соединение | tпл, оС | Летучий продукт | Коэффициенты уравнения давления пара летучего продукта lg p = -A/T + B (р, мм.рт.ст.) | t кипения или разложения, оС | DН испарения или разложения, ккал/моль | DS испарения или разложения, ккал/(моль.град) | Температура, оС | |
| А | В | |||||||
| KAlCl4 | 256 | KAlCl4 | -690 | 7,60 | 1017 | 27,85 | 21,6 | 600-800 |
| NaAlCl4 | 152 | NaAlCl4 | -7600 | 9,53 | 870 | 34,80 | 30,4 | 550-750 |
| NaFeCl4 | 163 | Fe2Cl6 +NaFeCl4 | -3900 | 5,80 | 1060 | 17,80 | 13,4 | 500-800 |
| KFeCl4 | 249 | KFeCl4 | -4517 | 5,66 | 1110 | 23,50 | 16,9 | 377-827 |
| K2TiCl6 | - | TiCl4 | -7150 | 11,23 | 580 | 32,70 | 38,2 | 380-490 |
| K2ZrCl6 | 798 | ZrCl4 | -11300 | 13,40 | - | 47,75 | 40,1 | 650-790 |
| Na2ZrCl6 | 648 | ZrCl4 | -5640 | 8,54 | - | 25,80 | 25,9 | 432-630 |
| K2HfCl6 | 802 | HfCl4 | -10610 | 11,76 | - | 54,50 | 42,7 | 700-790 |
| Na2HfCl6 | 660 | HfCl4 | -5690 | 8,47 | - | 26,00 | 25,6 | 450-650 |
| KNbCl6 | 365 | NbCl5 | -4400 | 8,15 | 562 | 20,10 | 24,0 | 350-550 |
| NaNbCl6 | 430 | NbCl5 | -5000 | 11,80 | 287 | 22,90 | 40,8 | 150-270 |
| KTaCl6 | 410 | TaCl5 | -5000 | 8,65 | 594 | 22,90 | 26,4 | 300-700 |
| NaTaCl6 | 470 | TaCl5 | -4030 | 9,15 | 370 | 18,40 | 28,7 | 175-350 |
| K2NbOCl5 | 500 | NbOCl3 | -4350 | 6,99 | 787 | 19,91 | 18,8 | 460-700 |
| KNbOCl4 | 428 | NbOC3 | -6530 | 12,1 | 436 | 29,87 | 42,3 | 300-420 |
| KTaOCl4 | 635 | TaCl5 | -4912 | 6,99 | 917 | 22,50 | 18,9 | 525-625 |
Так как хлориды алюминия и железа с хлоридами натрия и калия в расплаве образуют легкоплавкие и малолетучие соединения, солевым методом достигают хорошей очистки от этих элементов. В зависимости от физико-химических свойств парогазовой смеси и расплава очистку ведут фильтрацией через слой горячей насадки, причем образующийся расплав стекает в нижнюю часть аппарата, или барботированием парогазовой смеси через расплав хлоридов и т. п.
Хлорирование лопарита
Состав лопаритового концентрата следующий, %:
| ThO2 | 0,5 - 0,8 | MgO | 1,5 - 2,5 |
| Nb2O5 | 7,0 – 8,5 | Na2O | 7,0 – 8,5 |
| Та2O5 | 0,4 – 0,5 | Fe2O3 | 0,6 – 0,8 |
| å(РЗЭ)2О3 | 30,0 - 33,5 | Al2O3 | 0,4 – 0,7 |
| TiO2 | 35,0 – 38,0 | SiO2 | 0,6 – 1,5 |
| CaO | 4,0 – 5,5 | P2O5 | 0,03- 0,05 |
Хлорирование лопарита является одним из перспективных методов переработки этого вида сырья, так как в результате большой разницы в свойствах хлоридов в процессе хлорирования получают раздельно три полупродукта: плав хлоридов редких земель и тория, твердые хлориды ниобия и тантала и жидкий тетрахлорид титана. Принципиальная схема переработки .лопарита хлорированием представлена на рис. 19.
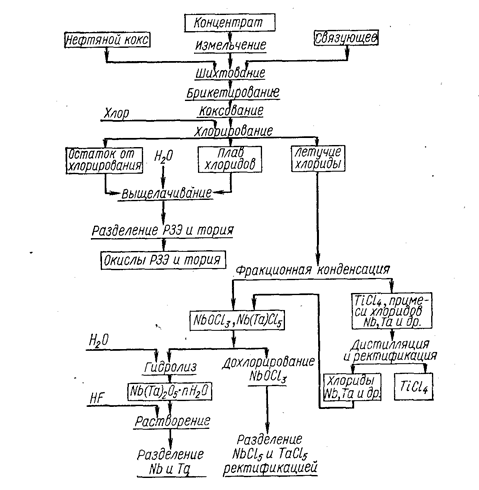
Рис. 19. Принципиальная технологическая схема процесса переработки комплексного титан-тантал-ниобиевого сырья (Стефанюк С. Л., Коршунов Б. Г. Введение в хлорную металлургию редких элементов. М., «Металлургия», 1970, сокращенный рис. 34).
Хлорирование ведут в ШЭП или хлораторах в расплаве при температуре 850-1000°С. Количество нефтяного кокса в брикетах составляет 20-30%. Извлечение полезных компонентов доходит до 99%. Таким образом, в процессе хлорирования просто и эффективно решается сложнейшая технологическая задача отделения тантала и ниобия от титана. Нелетучие хлориды РЗЭ, Са, Na, К и др. при 450°С образуют расплав, периодически выпускаемый из ШЭП в изложницы. При этом необходимо учитывать наличие тория в плаве хлоридов и находящихся с ним в равновесии мезотория I и торона и предусмотреть соответствующие меры по вентиляции и борьбе с запыленностью. Плав хлоридов поступает на гидрометаллургическую переработку. Технический четыреххлористый титан и хлориды ниобия и тантала перерабатываются на индивидуальные хлориды.
Очистка тетрахлорида титана
Тетрахлорид титана, получаемый хлорированием, имеет различный состав в зависимости от сырья и способа конденсации. Помимо тонкодисперсной взвеси твердых пентахлоридов тантала и ниобия, оксихлоридов ниобия и тантала, хлоридов железа, алюминия, кальция, РЗЭ и т. д. в нем растворены хлориды других сопутствующих элементов, включая VOCl3, SiCl4; хлор, фосген, органические соединения и т. д.
Интересно отметить, что растворимость хлоридов железа и алюминия в TiCl4 существенно выше в присутствии друг друга.
В зависимости от примесей меняется окраска TiClU от светло-желтой до темно-бурой. Приведем типичный состав TiCl4, полученного хлорированием шлаков, %:
| Si | 0,01 – 0,3 | TiOCl2 | 0,04 – 0,5 |
| Al | 0,01 – 0,1 | COCl2 | 0,005 – 0,15 |
| Fe | До 0,02 | Cl2 | 0,03 – 0,08 |
| V | 0,01 – 0,1 | S | До 0,3 |
Тетрахлорид титана, используемый для получения металла или двуокиси титана, не должен содержать Fe, V, Si более 0,01% каждого. При получении металла особенно важна хорошая очистка TiCl4 от кислородсодержащих соединений VOCl3 и TiOCl2. Так как оксихлориды алюминия имеют весьма незначительную растворимость в TiCl4, первой операцией по очистке является введение некоторого количества влаги в технический продукт. Этот прием можно использовать из-за большей склонности А1С13 к гидролизу по сравнению с TiCl4. Заданное количество воды вводится в систему на носителе: поваренной соли, активированном угле и т. д. Осадок хлоридов железа и оксихлоридов алюминия отфильтровывают. В качестве фильтрующего материала используют стеклоткань, сукно, перхлорвиниловое полотно, слой активированного угля или керамическую поверхность. Часто применяют отстой в сгустителях.
Очистка от оксихлорида ванадия VOCl3 достигается восстановлением его цементационной медью до хлористого ванадила:
VOCl3 (р.) + Сu(тв.) = VOCl2 (тв.) + CuCl (тв.).
Расход меди составляет ~0,5% массы TiCl4. Очистку проводят в реакторе с мешалкой.
Для очистки от VOCl3 применяют также сероводородный метод. VOCl3, FeCl2 взаимодействуют в TiCl4 с сероводородом с образованием нерастворимых соединений:
2VOCl3 + H2S = 2VOCl2 (тв.) + 2HCl + S;
>300oC
2VOCl2 « VOCl + VOCl3
Расход сероводорода 5-7 кг на 1 т TiCl4.
Окончательную очистку осуществляют методом ректификации, причем товарной является средняя фракция конденсата. При этом TiCl4 очищается как от более летучих хлоридов кремния, фосфора и др., а также фосгена и хлора, так и от оставшегося количества кислородных соединений. Примерный состав примесей в получаемом TiCl4 следующий, %: 0,003 А1, 0,004 Fe, 0,003 V, 0,003-0,005 O2, 0,003 Si.
Дата: 2019-03-05, просмотров: 4107.