Состав газовой фазы при хлорировании двуокисей титана и циркония в зависимости от температуры (общее давление 1 атм)
| Двуокись | to, C | СО | СО2 | MeCl4 | COCl2 | Cl2 |
| TiO2 | 400 | 0,005 | 0,434 | 0,500 | 2,3.10-8 | 1,38.10-7 |
| 600 | 0,175 | 0,370 | 0,455 | 5,7.10-7 | 1,47.10-5 | |
| 800 | 0,600 | 0,047 | 0,353 | 4,9.10-7 | 7,4.10-5 | |
| 1000 | 0,662 | 0,002 | 0,335 | 9,9.10-6 | 1,12.10-4 | |
| ZrO2 | 500 | 0,023 | 0,483 | 0,494 | 2,54.10-12 | 4,75.10-10 |
| 600 | 0,192 | 0,357 | 0,451 | 12,2.10-10 | 2,87.10-8 | |
| 800 | 0,598 | 0,551 | 0,351 | 9,4.10-10 | 8,10.10-8 | |
| 1000 | 0,665 | 0,002 | 0,333 | 0,84.10-10 | 9,86.10-8 |
Реакция дохлорирования летучих оксихлоридов возможна только при более высокой температуре (в данном случае более 800° С), и для ее осуществления необходим избыток хлора. В реальных условиях при расчете парциального давления компонентов газовой смеси необходимо учитывать и кинетические факторы.
Кинетика хлорирования окислов в отсутствие восстановителя описывается уравнением Аррениуса:
kr = A exp(-x/RT) (16)
где А- предэкспоненциальный множитель; x - эффективная энергия активации; R - газовая постоянная; Т - абсолютная температура. Константа скорости выражена в данном случае через скорость уменьшения радиуса шарообразной частицы окисла в результате хлорирования. В табл. 12 приведены значения А и x для некоторых окислов редких металлов.
Последовательность изменения скорости хлорирования совпадает с последовательностью изменения энергии Гиббса реакции хлорирования. Скорость реакции хлорирования приемлема для практических целей, если константа скорости kr ³10-7 см/сек. Скорость хлорирования возрастает с уменьшением валентности металла в окисле. Это хорошо иллюстрируется на примере окислов титана: заметная скорость хлорирования моноокиси титана TiO наблюдается при 215° С, Ti2O3 - при 225°С и TiO2 - только при 850° С.
Таблица 12
Параметры уравнения кинетики хлорирования некоторых окислов
| Параметр | ZrO2 | TiO2 | Nb2O5 | Y2O3 |
| А, см/сек | 2,3.10-4 | 1,8.10-6 | 0,72 | 3,3 |
| x, ккал/моль | 33,6 | 18,7 | 46,4 | 33,6 |
В присутствии углерода кинетика хлорирования также подчиняется закону Аррениуса. В кинетической области скорость хлорирования минералов определяется параметрами, приведенными в табл.13.
Таблица 13
Аппараты кипящего слоя
В технологии цветных металлов хорошо освоена операция обжига сернистых руд в кипящем слое. Высокая скорость процесса, интенсифицированная тепло- и массопередача, хорошие гидродинамические характеристики псевдоожиженного слоя создают предпосылки для использования кипящего слоя для хлорирования концентратов редких металлов. При этом принципиально возможны три варианта.
1. В качестве твердой фазы используется смесь хлорируемого концентрата и кокса, причем размер частиц подбирается таким образом, чтобы предотвратить преимущественный вынос любого из этих компонентов. .
2. В качестве исходного хлорируемого вещества используются карбиды, карбонитриды или оксикарбонитриды редких металлов.
3. Исходным веществом являются окислы редких металлов или рудные концентраты, но хлорирование осуществляется смесью окиси углерода и хлора или фосгеном.
Схема хлоратора представлена на рис. 14.
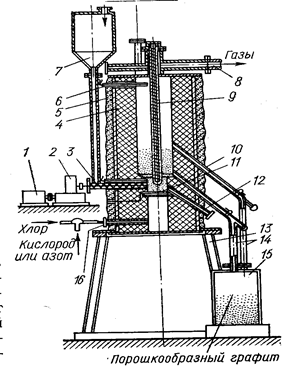
Рис. 14. Печь для хлорирования сложного карбида в кипящем слое (Коршунов Б. Г., Стефанюк С. Л., 1970, с. 150, рис. 27).
1- электродвигатель постоянного тока; 2 - редуктор; 3 - шнек; 4 - графитовая футеровка; 5 -корпус печи; 6 - термопара; 7 - бункер для карбида; 9 - патрубок для отходящих газов; 9 - пальцевый нагреватель; 10 - теплоизоляция; 11 - графитовая решетка; 12 - патрубок для разгрузки печи; 13 - станина; 14 - патрубок для разгрузки графита; 15 - сборник порошкообразного графита; 16 - фурма для хлора.
Кипящий слой создается газом, поступающим через отверстие в подине печи. Летучие хлориды непрерывно выводятся в конденсационную систему.
Непрохлорированные продукты и нелетучие хлориды выводятся в специальный сборник.
Хлорирование в аппаратах кипящего слоя, как и в ШЭП, осложняется образованием легкоплавких соединений, приводящих к слипанию частиц. Поэтому хлорирование ведут либо при температуре ниже температуры плавления самой легкоплавкой эвтектики, либо при температуре, при которой все продукты нацело переходят в паровую фазу. Это, однако, сильно усложняет конденсационную систему.
Существенными недостатками хлорирования в кипящем слое являются значительный пылеунос, проскок хлора в парогазовую смесь и повышенное разрушение стенок реактора.
Хлорирование в расплаве
Хлорирование рудных концентратов, окислов, карбидов, карбонитридов и оксикарбонитридов редких металлов расплаве - интенсивный, высокопроизводительный процесс. Хлорирование проводят в расплаве эквимолекулярной смеси КСl-NaCl или в расплаве отработанного электролита магниевых ванн. Измельченное хлорируемое вещество и кокс вносят в расплав без предварительного брикетирования. Равномерность перемешивания достигается в результате захвата расплавом частиц шихты конвек-тивными потоками и удерживания в нем силами поверхностного натяжения. Расплав хлоридов является нейтральным раствором для некоторых участников реакции. Растворимость Cl2, CO, CO2 в нем составляет (7¸4).10-4 моль/л. С частью продуктов реакции хлоридный расплав вступает в химическое взаимодействие, образуя при этом соединения Na3AlCl4, NaFeCl4, K2ZrCl6, K2TiCl4 и др. Некоторые хлориды, например MgCl2, и комплексные хлориды, например Na3AlCl4, выступают в качестве хлорирующих агентов:
ТiO2 + Cl2 + MgCl2 + ½ C = TiCl4 + MgO + ½ CO2;
DG0 = - 18,5 ккал.
Ионы комплексных хлоридов металлов с переменной валентностью существенно интенсифицируют процесс, выступая в роли переносчиков хлора:
2Тi2O3 + 4FeCl4 = TiCl4 + 3TiO2 + 4FeCl3;
FeCl3 + Cl- = FeCl4-
Кинетика хлорирования в расплаве исключительно сложна и изучена недостаточно. В рассматриваемой системе имеется четыре фазы: расплав, барботируемый газ, хлорируемый концентрат и кокс. Один из вероятных механизмов хлорирования состоит из следующих стадий: растворения хлора из пузырька газа в прилегающих к нему слоях расплава, диффузии растворенного хлора к частице кокса, химической реакции хлора с восстановителем и образования активного промежуточного комплекса, его растворения в расплаве и диффузии к поверхности хлорируемого концентрата, гетерогенной реакции хлорирования. Наиболее вероятной лимитирующей стадией хлорирования в расплаве является диффузия активного промежуточного комплекса. Хлорирование в расплаве проводится при достаточно высокой температуре. Ниже приведена оптимальная температура хлорирования различных минералов и соединений редких металлов в присутствии нефтяного кокса в расплаве эвтектической смеси КCl - NaCl:
| Берилл ….. ...850-950 | Сподумен…………850-900 |
| Колумбит.. .. 800 | Танталит………… 800 |
| Лопарит……800 | Шлаки титановые..700 |
| Пирохлор…...700-750 | Циркон……………850-900 |
| Рутил……750 | Ферросплавы….750-850 |
Хлорирование проводят в аппарате, в котором находится расплав, подогреваемый угольными электродами. Схема хлоратора представлена на рис. 15. Хлор подают в нижнюю часть хлоратора. Для более равномерного распределения по объему расплава хлор проходит через две газораспределительные решетки. Хлоратор оборудован специальным переточным каналом для создания интенсивной циркуляции. Она препятствует оседанию частиц концентрата на дно аппарата и всплыванию частиц кокса на поверхность. В случае необходимости тепло может отводиться с помощью водоохлаждаемых штанг.
Хлорируемый концентрат и кокс загружают на поверхность расплава шнековым питателем. Газообразные продукты хлорирования из верхней части хлоратора поступают в конденсационную систему. Малолетучие хлориды и непрохлорированный остаток периодически удаляются вместе с частью расплава через летку.
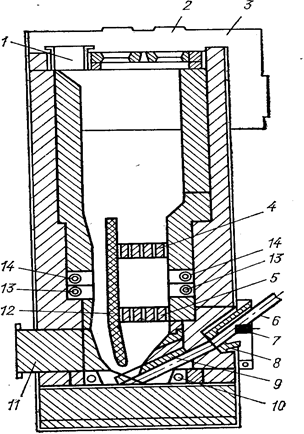
Рис. 15. Схема хлоратора для хлорирования в расплаве (Металлургия титана, 1968, рис. 32):
1- газоход; 2 - отверстие и пробка свода; 3- свод; 4,5 - верхняя и нижняя хлоро-распределительные решетки; 6 - хлоропровод; 7 - пробка для чистки; 8 - фурма хлоропровода; 9 - распределитель хлора; 10 - нижний электрод: 11 - лаз; 12 - стенка переточного канала; 13 - верхний электрод; 14 - водоохлаждаемая штанга.
Скорость процесса хлорирования в аппарате зависит от температуры, скорости подачи хлора, степени измельчения концентрата и кокса и состава солевой ванны.
Хлоратор в расплаве представляет собой высокопроизводительный аппарат. При хлорировании титановых шлаков он позволяет получать более 10 т TiCl4 с 1 м2 в сутки. Хлорирование в расплаве не требует предварительного брикетирования шихты. Серьезным преимуществом этого способа является взрывобезопасность его, так как в отходящих газах содержание окиси углерода не превышает 5%.
Хлорирование лопарита
Состав лопаритового концентрата следующий, %:
| ThO2 | 0,5 - 0,8 | MgO | 1,5 - 2,5 |
| Nb2O5 | 7,0 – 8,5 | Na2O | 7,0 – 8,5 |
| Та2O5 | 0,4 – 0,5 | Fe2O3 | 0,6 – 0,8 |
| å(РЗЭ)2О3 | 30,0 - 33,5 | Al2O3 | 0,4 – 0,7 |
| TiO2 | 35,0 – 38,0 | SiO2 | 0,6 – 1,5 |
| CaO | 4,0 – 5,5 | P2O5 | 0,03- 0,05 |
Хлорирование лопарита является одним из перспективных методов переработки этого вида сырья, так как в результате большой разницы в свойствах хлоридов в процессе хлорирования получают раздельно три полупродукта: плав хлоридов редких земель и тория, твердые хлориды ниобия и тантала и жидкий тетрахлорид титана. Принципиальная схема переработки .лопарита хлорированием представлена на рис. 19.
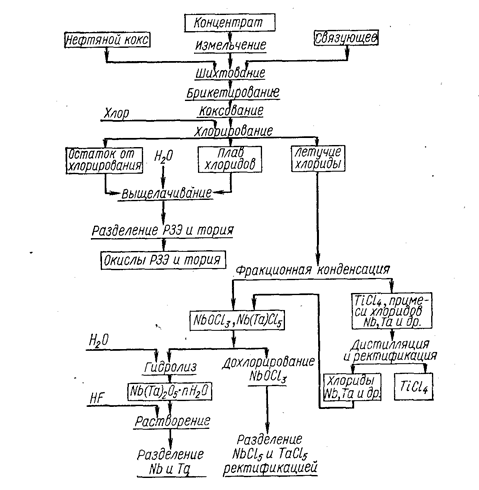
Рис. 19. Принципиальная технологическая схема процесса переработки комплексного титан-тантал-ниобиевого сырья (Стефанюк С. Л., Коршунов Б. Г. Введение в хлорную металлургию редких элементов. М., «Металлургия», 1970, сокращенный рис. 34).
Хлорирование ведут в ШЭП или хлораторах в расплаве при температуре 850-1000°С. Количество нефтяного кокса в брикетах составляет 20-30%. Извлечение полезных компонентов доходит до 99%. Таким образом, в процессе хлорирования просто и эффективно решается сложнейшая технологическая задача отделения тантала и ниобия от титана. Нелетучие хлориды РЗЭ, Са, Na, К и др. при 450°С образуют расплав, периодически выпускаемый из ШЭП в изложницы. При этом необходимо учитывать наличие тория в плаве хлоридов и находящихся с ним в равновесии мезотория I и торона и предусмотреть соответствующие меры по вентиляции и борьбе с запыленностью. Плав хлоридов поступает на гидрометаллургическую переработку. Технический четыреххлористый титан и хлориды ниобия и тантала перерабатываются на индивидуальные хлориды.
Очистка тетрахлорида титана
Тетрахлорид титана, получаемый хлорированием, имеет различный состав в зависимости от сырья и способа конденсации. Помимо тонкодисперсной взвеси твердых пентахлоридов тантала и ниобия, оксихлоридов ниобия и тантала, хлоридов железа, алюминия, кальция, РЗЭ и т. д. в нем растворены хлориды других сопутствующих элементов, включая VOCl3, SiCl4; хлор, фосген, органические соединения и т. д.
Интересно отметить, что растворимость хлоридов железа и алюминия в TiCl4 существенно выше в присутствии друг друга.
В зависимости от примесей меняется окраска TiClU от светло-желтой до темно-бурой. Приведем типичный состав TiCl4, полученного хлорированием шлаков, %:
| Si | 0,01 – 0,3 | TiOCl2 | 0,04 – 0,5 |
| Al | 0,01 – 0,1 | COCl2 | 0,005 – 0,15 |
| Fe | До 0,02 | Cl2 | 0,03 – 0,08 |
| V | 0,01 – 0,1 | S | До 0,3 |
Тетрахлорид титана, используемый для получения металла или двуокиси титана, не должен содержать Fe, V, Si более 0,01% каждого. При получении металла особенно важна хорошая очистка TiCl4 от кислородсодержащих соединений VOCl3 и TiOCl2. Так как оксихлориды алюминия имеют весьма незначительную растворимость в TiCl4, первой операцией по очистке является введение некоторого количества влаги в технический продукт. Этот прием можно использовать из-за большей склонности А1С13 к гидролизу по сравнению с TiCl4. Заданное количество воды вводится в систему на носителе: поваренной соли, активированном угле и т. д. Осадок хлоридов железа и оксихлоридов алюминия отфильтровывают. В качестве фильтрующего материала используют стеклоткань, сукно, перхлорвиниловое полотно, слой активированного угля или керамическую поверхность. Часто применяют отстой в сгустителях.
Очистка от оксихлорида ванадия VOCl3 достигается восстановлением его цементационной медью до хлористого ванадила:
VOCl3 (р.) + Сu(тв.) = VOCl2 (тв.) + CuCl (тв.).
Расход меди составляет ~0,5% массы TiCl4. Очистку проводят в реакторе с мешалкой.
Для очистки от VOCl3 применяют также сероводородный метод. VOCl3, FeCl2 взаимодействуют в TiCl4 с сероводородом с образованием нерастворимых соединений:
2VOCl3 + H2S = 2VOCl2 (тв.) + 2HCl + S;
>300oC
2VOCl2 « VOCl + VOCl3
Расход сероводорода 5-7 кг на 1 т TiCl4.
Окончательную очистку осуществляют методом ректификации, причем товарной является средняя фракция конденсата. При этом TiCl4 очищается как от более летучих хлоридов кремния, фосфора и др., а также фосгена и хлора, так и от оставшегося количества кислородных соединений. Примерный состав примесей в получаемом TiCl4 следующий, %: 0,003 А1, 0,004 Fe, 0,003 V, 0,003-0,005 O2, 0,003 Si.
ФТОРИРОВАНИЕ
Фторирование элементарным фтором и безводным фтористым водородом некоторых видов рудных концентратов представляется достаточно перспективным. Это обусловлено более широкой областью существования жидкого состояния фторидов некоторых элементов по сравнению с хлоридами, большей разницей в температуре кипения у фторидов некоторых элементов с близкими свойствами и переводом кремния и фосфора в труд-ноконденсируемые фториды. Физико-химические свойства некоторых фторидов представлены в табл. 17.
Таблица 17
Глава 4 ХЛОРИРОВАНИЕ И ФТОРИРОВАНИЕ
Хлорирование в настоящее время широко используют в технологии редких металлов для перевода рудных концентратов и некоторых промежуточных продуктов технологии в хлориды, удобные для последующего разделения, очистки и получения металлов. Хлорирование является основным методом, используемым в технологии титана. Хлорируется значительная доля рудных концентратов циркония и гафния, тантала и ниобия, редкоземельных элементов и др. Фторирование применяют в значительно меньшем масштабе, главным образом для получения фторидов редких металлов из окислов или вторичных металлов с целью их металлотермического или электрохимического восстановления. Хлорирование и фторирование широко используют при переработке комплексных руд и различного рода сложных композиций окислов или металлов, так как различие в температуре плавления и температуре кипения хлоридов и фторидов редких металлов позволяет успешно разделять их и осуществлять их тонкую очистку. На основе процессов хлорирования и фторирования созданы короткие, изящные технологические схемы. Благодаря высокой реакционной способности хлора и фтора процессы хлорирования и фторирования практически осуществляются нацело, и степень перевода исходных материалов в хлориды и фториды колеблется между 98 и 100%. Их огромным преимуществом перед другими методами вскрытия и переработки рудных концентратов и других соединений редких металлов является отсутствие сточных вод и сброса в атмосферу. Создание технологических схем без водных и атмосферных сбросов является эффективной мерой по охране природы.
В получаемых хлоридах и фторидах содержание кислорода и других вредных примесей мало, что обеспечивает высокое качество металлов.
Большим стимулом для развития хлорной и фторной технологии редких металлов является растущее производство хлора, фтора и фтористого водорода. Производство хлора тесно связано с получением едкого натра, магния, натрия и др. и в настоящее время превышает в мире 11 млн. т. Производство фтора и фтористого водорода несравнимо с производством хлора по количеству, однако оно также имеет ярко выраженную тенденцию к росту.
10. ХЛОРИРОВАНИЕ
Физико-химические основы
Несмотря на высокую реакционную способность хлора, окислы, силикаты и более сложные минералы редких металлов реагируют с ним с практически приемлемым выходом только в присутствии восстановителя.
Зависимость константы равновесия от температуры можно определить по изменению энергии Гиббса в стандартных условиях при данной температуре [см. формулу (13)]. В табл. 9 приведено изменение стандартной энергии Гиббса DGo при 500 и 1000°С в некоторых реакциях хлорирования в расчете на 1 молекулу хлора. Восстановителем обычно служит углерод. С термодинамической точки зрения роль углерода вполне ясна, так как реакция углерода с кислородом характеризуется большим отрицательным изменением энергии Гиббса (табл. 10).
Таблица 9
Изменение стандартной энергии Гиббса в реакции хлорирования некоторых окислов
| реакция | DGo, кал | |
| 500°С | 1000°С | |
| NiO + Cl2 = NiCl2 + ½ O2 | -9200 | -6400 |
| FeO + Cl2 = FeCl2 + ½ O2 | -7600 | -5200 |
| MgO + Cl2 = MgCl2 + ½ O2 | -4000 | -6200 |
| ½ TiO2 + Cl2 = ½ TiCl4 + ½ O2 | +19000 | +15900 |
| ½ ZrO2 + Cl2 = ½ ZrCl4 + ½ O2 | - | +16360 |
| ½ SiO2 + Cl2 = ½ SiCl4 + ½ O2 | +24300 | +21400 |
Таблица 10
Изменение стандартной энергии Гиббса в реакции углерода с кислородом
| реакция | DGo, кал | |
| 500°С | 1000°С | |
| C + ½ O2 = CO | -43100 | -53670 |
| ½ C + ½ O2 = ½ CO2 | -47270 | -47340 |
| CO + ½ O2 = CO2 | -51430 | -41000 |
В присутствии углерода термодинамически возможны реакции хлорирования любых окислов редких металлов.
Выход тетрахлорида циркония, рассчитанный из химического равновесия реакции хлорирования двуокиси циркония хлором в отсутствие углерода, составляет при 1000, 1100 и 1200° С соответственно 0,155; 0,276; 0,450 об.%. В то же время в присутствии углерода реакция
ZrO2 + С+ 2Cl2 = ½ ZrCl4 + СO2
нацело сдвинута вправо уже при 550° С.
Реакция хлорирования пятиокиси ниобия
2Nb2О5 + 6 Cl2 = 4NbOCl3 + ЗО2
при 800, 900, 1000 и 1100°С характеризуется выходом оксихлорида в газовую фазу 0,48; 1,02; 2,07; 4,20% соответственно. В присутствии углерода хлорирование идет практически до конца уже при 450° С.
В зависимости от температуры хлорирования в газовую фазу наряду с углекислым газом переходят окись углерода и фосген. В табл. 11 приведен состав газовой фазы в зависимости от температуры при хлорировании двуокиси титана и двуокиси циркония, полученный термодинамическим расчетом. Таким образом, до 600°С преобладает реакция с выделением углекислого газа, а выше этой температуры - с выделением окиси углерода. Это обстоятельство имеет важное практическое значение, так как смесь СО и СО2 с воздухом при отношении СО/СО2=1 взрывоопасна. Кроме того, в процессе, идущем с выделением СО2, расход углеродистого восстановителя практически в два раза ниже.
При хлорировании сложных смесей парциальное давление хлоридов следует рассчитывать с учетом их взаимодействия. В некоторых случаях хлорирование протекает ступенчато, через стадию образования оксихлоридов, например:
2Nb2О5 + 3С + 6Cl2 = 4NbOCl3 + ЗСО2
NbOCl3 + С + Cl2 = NbCl5 + СО
Таблица 11
Дата: 2019-03-05, просмотров: 1377.