1.Размер колонии_______________________________________
2.Форма колонии_______________________________________
3. Поверхность колонии_________________________________
4. Края колонии________________________________________
5.Прозрачность колоний_________________________________
6.Пигмент_____________________________________________
7.Консистенция________________________________________
8.Форма бактерий______________________________________
9. Взаиморасположение бактерий_________________________
10.Латинское морфологическое название бактерий__________
3. Исследование кала на дисбактериоз (разбор схемы).
Для бактериологического исследования используются свежие фекалии, собираемые в стерильную посуду (пробирки или пенициллиновые флаконы) без консерванта. Материал должен быть исследован в течение 2 часов с момента дефекации.
Существует несколько методов исследования микрофлоры кишечника, большинство из которых сводится к количественному исследованию предварительно взвешенной навески фекалий.
Взвешивание проводится на стерильной пергаментной бумаге (навеска должна быть в пределах 0,5-1,0 г.), которая затем помещается в фарфоровую ступку и заливается таким количеством фосфатно-тиогликолевого буфера, чтобы получилось соотношение 1:10. Содержимое ступки тщательно растирается и отстаивается в течение 10 мин для оседания плотных частиц. Затем 0,5 мл содержимого из ступки переносится в пробирку с 4,5 мл фосфатно-тиогликолевого буфера и тщательно перемешивется. В дальнейшем материал последовательно раститровывается по 0,5 мл в 6-ти пробирках (получаются десятикратные разведения). Из 6-й пробирки материал в количестве 0,1 мл переносится в пробирку с 9,9 мл буфера, а из неё 0,1 - в следующую пробирку с аналогичным количеством буфера. Таким образом, в ступке содержится разведение материала 10-1, а в последней пробирке – 10-11. Посев целесообразно начинать с разведения 10-11, используя концевую пипетку на 1,0 мл.
Для выделения бифидобактерий по 0,1 и 1,0 мл из разведений 10-11, 10-9 и 10-7 засевают в пробирки с регенерированной средой Блаурокка; при этом получается 6 пробирок с разведениями от 10-7 до 10-12.
Для выделения бактероидов по 0,1 мл из этих же разведений материала засевают на КАБ (кровяной агар бактероидов) с неомицином и культивируют по модифицированному методу Фортнера: площадь посева закрывают преципитационными (малого диаметра) чашками, создавая строго анаэробные условия, необходимые для культивирования бактероидов.
По 0,1 мл разведений 10-7, 10-6 и 10-5 засевают на молочно-растительную среду /МРС/ - для выделения лактобацилл. Из разведений 10-6 и 10-5 делают посев по 0,1 мл на среду Эндо - для изоляции энтеробактерий; 0,1 мл из разведения 10-6 засевают на кровяной агар - для выявления гемолитической активности аэробной микрофлоры.
Для выявления энтерококков используют среду Калины, засевая по 0,1 мл из разведений 10-6 и 10-5.
По 0,1 мл из разведения 10-4 засевают на чашечную среду Симмонса, позволяющую изолировать наиболее часто встречаемые УПЭ (представителя рода Цитробактер и трибы Клебсиелла) и на желточно-солевой агар - для выделения стафиллококков.
0,1 мл из разведения 10-3 засевают на среду Сабуро с полимиксином - для выделения дрожжей и дрожжеподобных грибов. Для выделения клостридий по 0,1 мл из разведений 10-3 и 10-4 засевают на среду Вильсон-Блера.
Все посевы инкубируют в термостате при 37 °С.
На второй день исследования:
1. Производят учёт роста на среде Эндо. Подсчитывают общее число, выросших колоний кишечных палочек, обращая внимание на их характер (цвет, наличие металлического блеска, диссоциацию, формы с пониженной ферментативной активностью). При обнаружении лактозоотрицательных колоний анализ ведут как при выявлении патогенных представителей семейства энтеробактерий.
2. Кровяной, желточно-солевой агар и среду Сабуро извлекают из термостата и оставляют для дальнейшей инкубации при комнатной температуре, а желточно-солевой агар - при действии рассеянного света - для лучшего выявления пигментообразования.
На третий день исследования:
1. Производят учёт роста УПЭ на среде Симмонса. Помимо УПЭ (представителей родов Citrobacter Enterobacter Hafnia, наиболее часто выделяемых из фекалий, а также Providencia, изолируемых из этого материала реже), дающих белые или окрашенные в цвет среды мелкие и средней величины слизистые или сухие колонии, часто в R-форме, изменяющие (в случае утилизации цитрата натрия) цвет среды до синего или не изменяющие его, вырастают кишечные палочки, в том числе и с пониженной ферментативной активностью, в виде очень мелких, прозрачных, зеленовато-белых колоний. Подсчитывают общее число колоний УПЭ, выросших на среде Симмонса, - делая перерасчёт на 1 г. В случае роста на чашке колоний УПЭ нескольких типов ведут подсчёт каждого из них и соответствующий пересчёт на 1 г фекалий.
Для идентификации УПЭ производят посев части изучаемой колонии на скошенный МПА, а другой части - на среду Кларка.
2. Учитывают количество колоний стафилококка, подтверждённого изучением морфологии в окрашенном по Граму мазке, на желточно-солевом агаре, делают пересчёт на 1 г, определяют пигментообразование и образование лецитиназы (лецитовителлазы), производят отсев колонии для выделения чистой культуры и дальнейшего определения вида стафилококка.
3. Производят подсчёт числа колоний энтерококка на среде Калины (с пересчётом на 1 г), определяют наличие или отсутствие протеолитической активности.
4. На кровяном агаре отмечают наличие или отсутствие гемолиза, в положительном случае определяют морфологию микроорганизма; подсчитывают % гемолитических форм к общему количеству выросших на этой среде колоний.
5. Отмечают наличие чёрных колоний на среде Вильсон-Блера, подсчитывают их общее количество (с переводом на 1 г), подтверждают принадлежность выросших микроорганизмов к клостридиям изучением морфологии в окрашенном по Граму мазке. Нередко на этой среде вырастают, представители рода Протеус и Цитробактер, давая колонии, схожие с колониями клостридий.
6. Регистрируют рост на среде Сабуро с полимиксином, где вырастают дрожжи и дрожжеподобные грибы, давая белые средней величины и крупные колонии. Морфологию микроорганизмов подтверждают микроскопией окрашенных по Граму препаратов. Определяют общее количество выросших колоний, делают пересчёт на 1 г, а для дифференциации дрожжей от дрожжеподобных грибов рода Кандида, делают посев на картофельный или крахмальный агар (для определения филаментации, характерной для грибов рода Кандида и отсутствующей у дрожжей).
На четвёртый день исследования:
I. Учитывают рост бифидобактерий на среде Блаурокка. Для этого из каждой пробирки с ростом готовят мазки, окрашивают по Граму и микроскопируют. При микроскопии препаратов отмечается характерная для бифидобактерий морфология и расположение. Учитывают предельное разведение материала, в котором ещё регистрируется рост бифидобактерий, подтверждённый нахождением этих микроорганизмов в окрашенных по Граму препаратах. При этом, не допуская большую ошибку, можно перевести предельное разведение материала на количество бифидобактерий в 1 г фекалий. Допустим, предельным разведением материала, в котором зарегистрирован рост бифидобактерий, подтверждённый изучением морфологии в мазке, было 1010. С большой долей вероятности можно считать, что количество бифидобактерий в 1 г фекалий соответствует 1010 (этот пересчёт необходим для дальнейшего определения соотношения бифидобактерий и других микроорганизмов).
2. Регистрируют рост лактобацилл на МРС, подсчитывают общее число колоний этих микроорганизмов, приводят к 1 г. Лактобациллы на МРС растут в виде мелких беловато-серых с ровными краями или более крупных желтовато-серых с изведенными краями колоний, дифференцировать которые от колоний других микроорганизмов не предоставляет особого труда. Лактобациллы довольно хорошо растут на среде Сабуро с полимиксином.
3. Производят учёт бактероидов на КАБах. На этой среде указанные микроорганизмы растут в виде мелких беловато-серых колоний; в мазке - это грамоотрицательные мелкие палочки, расположенные без особого порядка. Делают пересчёт для определения количества бактероидов в 1 г фекалий. Для дифференциации бактероидов от лактобацилл, спорообразующих бактерий и др. микроорганизмов производят посев части колонии на КАБ с последующим культивированием в аэробных условиях, а также окраску, на выявление спор.
4. Повторно учитывают рост грибов рода Кандида на среде Сабуро с полимиксином (при отсутствии роста на этой среде через 24-48 часов); при наличии роста, производят изучение как в п.6 третьего дня исследования.
5. Для идентификации УПЭ производят посев чистой культуры со скошенного МПА на среды с аминокислотами (лизином, аргинином, орнитином).
На пятый день исследования:
1. Производят учёт филаментации (если предварительно были подозрительные колонии на среде Сабуро).
2. Учитывают тесты, дифференцирующие бактероиды от лактобацилл и аэробов (по отсутствию роста на МРС и на КАБах в аэробных условиях).
3. Для идентификации УПЭ производят учёт изменений со сред с аминокислотами, а также результатов реакции Фогес-Проскауэра и с метиловым красным, что в ряде случаев даст возможность установить род и вид; в том случае, когда идентификацию по указанным тестам провести не удаётся, проводят посев на дополнительные углеводы.
4. Выдача ответа.
В ответе следует указать количество анаэробов (бифидобактерий, бактероидов, лактобацилл), а также количество аэробных микроорганизмов различных родов, изолированных из 1г фекалий.
В заключении следует указать на отсутствие или наличие дисбактериоза кишечника и степень его выраженности.
Основой для заключения должно быть соотношение количества бифидобактерий (как основных представителей анаэробной группы бактерий, выполняющих наиболее важную для организма физиологическую функцию) и аэробов.
При установлении пограничных состояний между нормой и патологией очень важным показателем является соотношение между бифидобактериями и E . coli.
Для его установления количество бифидобактерий, определённых в конкретном образце, подтверждённых изучением морфологии в окрашенных по Граму препаратах, принимают за 100 %, а количество E. co l i за Х. Составляют пропорцию и высчитывают значение X.
Например, количество бифидобактерий в I г = 1010, а количество E. co l i = 700 млн.
Составляем пропорцию:
1010 ------ 100 %
700 млн ----- X
X = 7 %
Данный показатель превышает норму (5 %) и свидетельствует о начальных сдвигах в микрофлоре (нарушение соотношения между бифидобактериями и E . coli), что может быть определено как дисбактериоз I степени. Однако такие расчёты следует проводить не во всех случаях, а только тогда, когда имеются затруднения в диференциации дисбактериоза I степени и эубиоза.
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ 14
Табл. 3. Количественный и качественный состав микрофлоры кишечника в норме
| Названия микроорганизмов | Дети до 1 года | Дети старшего возраста | Взрослые |
| Бифидобактерии | 1010 – 1011 | 109 – 1010 | 108 – 1010 |
| Лактобактерии | 106 – 107 | 107 – 108 | 106 – 108 |
| Эшерихии | 106 – 107 | 107 – 108 | 106 – 108 |
| Бактероиды | 107 – 108 | 107 – 108 | 107 – 108 |
| Пептострептококки | 103 – 105 | 105 – 106 | 105 – 106 |
| Энтерококки | 105 – 107 | 105 – 108 | 105 – 108 |
| Сапрофитные стафилококки | ≤104 | ≤104 | ≤104 |
| Патогенные стафилококки | - | - | - |
| Клостридии | ≤103 | ≤105 | ≤105 |
| Кандида | ≤103 | ≤104 | ≤104 |
| Патогенные энтеробактерии | - | - | - |
З А Н Я Т И Е 15
Дата ______________
Тема: Санитарно-микробиологическое исследование пищевых продуктов (разбор схемы). Бактериологический контроль качества стерилизации и дезинфекции.
План занятия:
1. Проведение санитарно-микробиологического исследования пищевых продуктов на наличие санитарно-показательных микроорганизмов.
а) определение количества бактерий группы кишечных палочек;
б) методы обнаружения сальмонелл;
в) методы выявления и определения количества Staphylococcus aureus в колбасных изделиях.
2. Исследование пищевых продуктов на наличие возбудителей пищевых токсикоинфекций: посев на среды обогащения и дифференциально-диагностические среды.
3. Изучение морфологических и тинкториальных свойств сальмонелл и кишечной палочки.
4. Методика посева смывов на общую бактериальную обсемененность.
5. Метод отпечатков на «Бактотест» со средой Эндо при санитарно-бактериологическом контроле на объектах питания.
Методические указания
1. Проведение санитарно-микробиологического исследования пищевых продуктов на наличие санитарно-показательных микроорганизмов
а) При определении количества бактерий группы кишечных палочек навеску анализируемого продукта (1,0-0,001 г по СанПиН 2.3.2.1078-01), в которой не должно быть БГКП, смешивают с 9 частями жидкой питательной среды (чаще всего используют среду Кесслер, содержащую в своём составе генцианвиолет, угнетающий рост грамположительных бактерий). Из пробирок с забродившей средой (помутнение, наличие газа в поплавках) делают посевы на чашки со средой Эндо. Посевы выдерживают в термостате при температуре 37 °С в течение 18-24 ч. Из колоний, типичных для БГКП (красных, с металлическим блеском, розовых, бледно-розовых), готовят мазки и окрашивают их по Граму.
б) Методы обнаружения сальмонелл. Пробу мяса или мясного продукта дважды пропускают через мясорубку, перемешивают, взвешивают 25 г, затем помещают в стерильную банку смесителя с 225 см3 буферной пептонной водой и гомогенизируют. Далее в асептических условиях переносят содержимое смесительной банки в стерильную колбу вместимостью 500 см3. Колбу выдерживают в термостате при температуре (37±1) °С не менее 16 и не более 20 ч, после чего приступают к анализу.
Выявление сальмонелл проводится в четыре последовательных этапа: первичный (прямой) посев, обогащение, посев со среды обогащения и подтверждение.
Первичный посев производится путем посева взвеси исследуемого материала на плотные элективные среды. Эти среды выдерживают в термостате при температуре 37°С и исследуют на присутствие колоний, которые являются типичными или подозрительными на сальмонеллы.
На элективных средах сальмонеллы растут, образуя характерные колонии:
- на фуксин-сульфитном агаре (агаре Эндо) сальмонеллы растут в виде круглых, бесцветных или слегка розоватых прозрачных, или полупрозрачных колоний;
- на эозин-метиленовом синем агаре (агаре Левина) сальмонеллы растут в виде прозрачных, бледных, нежно-розовых или розовато-фиолетовых колоний.
Обогащение проводят путем посева на жидкие селективные среды (среды Мюллера, Кауфмана и Киллиана, селенитовый Ф-бульона и хлористо-магниевая среды "М"). Эти среды выдерживают в термостате при температуре 37°С. На селенитовом бульоне лучшей температурой для накопления сальмонелл является43 °С.
В случае отсутствия роста бактерий сальмонелл при первичном (прямом) посеве на элективных средах, через 12-24 ч проводят высев на селективные среды со сред обогащения. Предварительно содержимое флаконов перед пересевом тщательно перемешивают и высевают штрихом петлей диаметром 2,5-3 мм на чашку с висмут-сульфитным агаром, бактоагаром Плоскирева или агаром Эндо. Посевы помещают в термостат на 18-24 ч при температуре 37°С, а посевы на висмут-сульфитном агаре - на 48 ч.
На селективных средах сальмонеллы растут, образуя характерные колонии:
- на бактоагаре Плоскирева сальмонеллы растут в виде бесцветных колоний, но колонии более плотные и несколько меньшего размера, чем на среде Эндо;
- на висмут-сульфитном агаре сальмонеллы растут в виде черных или коричневых колоний с характерным металлическим блеском.
Далее проводят подтверждение - пересев подозрительных на сальмонеллы колоний и определение их биохимических и серологических характеристик. В соответствии с нормативами санитарно-биологических показателей для мяса и мясных продуктов содержание сальмонелл в 25 г исследованного продукта не допустимо.
в) Методы выявления и определения количества Staphylococcus aureus в колбасных изделиях и продуктах из мяса.
Сущность метода заключается в определении морфологии, характера роста на питательных средах и в способности отдельных стафилококков продуцировать лецитиназу и коагулировать цитратную плазму крови кролика под воздействием фермента коагулазы.
Методика проведения анализа заключается в следующем. Из разведения анализируемой взвеси продукта (1:10) проводят посевы на молочно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления пигмента или желточно-солевой агар, содержащий 65 г/дм3 хлористого натрия, для выявления лецитиназной активности. Взвесь наносят на поверхность агара в количестве 0,2 см3 и равномерно растирают по всей поверхности агаровой среды. Посевы термостатируют в течение 24 ч при температуре 37°С и 24 ч выдерживают при комнатной температуре.
На поверхности питательной среды колонии стафилококка имеют вид плоских или слегка выпуклых блестящих колоний с ровным краем. При этом на молочно-солевом агаре лучше выявляется пигмент (эмалево-белый или золотистый), а на желточно-солевом агаре колонии стафилококков могут образовывать «радужный венчик», что является одним из признаков их патогенности.
Из подозрительных колоний готовят препараты, которые окрашивают по Граму. При наличии стафилококков в препарате обнаруживаются грамположительные мелкие кокки, располагающиеся неправильными гроздьями.
Для подтверждения признаков патогенности стафилококков ставят реакцию плазмокоагуляции. В прибор с 0,5 см3 цитратной плазмы крови кролика, разведенной физиологическим раствором в соотношении 1:4, вносят петлю чистой суточной культуры стафилококка и ставят в термостат при температуре 37 °С. Реакцию плазмокоагуляции учитывают через 3-4 ч (не встряхивая пробирку) и оставляют в термостате на сутки для окончательного учета через 24 ч.
Тест на коагулазу считают положительным, если культура показала, по крайней мере, 3+ - оценку коагулазной реакции, отмеченной на рисунке 1. Реакцию на 1+ или 2+ оценивают как промежуточную.
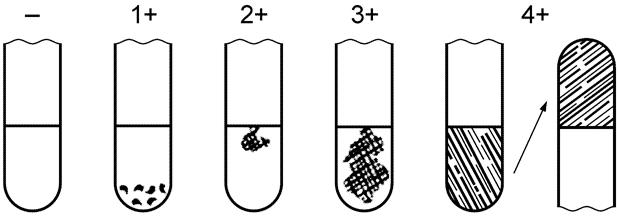
Рис. 1. Результаты коагулазного теста
- отрицательная оценка: не отмечено образования фибрина;
1+ положительная оценка: небольшие несформировавшиеся комочки;
2+ положительная оценка: небольшой сформировавшийся комок;
3+ положительная оценка: большой сформировавшийся комок;
4+ все содержимое пробирки скоагулировано и не меняет своего положения при переворачивании пробирки.
Для определения количества стафилококков учитывают колонии стафилококков, давшие положительную реакцию плазмокоагуляции.
Количество S. aureus в 1 см3 или 1 г продукта определяют исходя из количества коагулазоположительных стафилококков, принадлежность которых к S. aureus подтверждена по образованию ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. При расчете на 1 г продукта количество подсчитанных колоний умножают на степень разведения и делят на количество посевного материала.
2. Исследование пищевых продуктов на наличие возбудителей пищевых токсикоинфекций: посев на среды обогащения и дифференциально-диагностические среды
Приготовить взвесь в физиологическом растворе кусочка пищевого продукта, зараженного сальмонеллами, и произвести посев взвеси на среду обогащения и на дифференциально-диагностическую среду Плоскирева или Эндо.
3. Изучение морфологических и тинкториальных свойств сальмонелл и кишечной палочки
Приготовить препараты-мазки из культур сальмонелл и кишечной палочки, окрасить по Граму, промикроскопировать и сравнить морфологию бактерий во всех препаратах. Препараты зарисовать.
| Рис.2. Salmonella enteritidis | Рис.3. Escherichia coli |
4. Методика посева смывов на общую бактериальную обсемененность
Общую бактериальную обсемененность определяют для установления эффективности санитарной обработки посуды в посудомоечных машинах, а также при оценке новых моющих и дезинфицирующих средств. Для этого перед посевом в пробирку с тампоном (смыв) добавляют 5 мл 0,1% пептонной воды или изотонического раствора хлорида натрия. Тампон тщательно отмывают, после чего 1,0 мл смывной жидкости помещают в чашку Петри и заливают расплавленным МПА. Чашки помещают в термостат при 30 °C. Предварительный подсчет выросших колоний производят через 48 часов, окончательный - через 72 часа. Количество колоний, выросших на чашке, умножают на 10 для определения общего количества бактерий, содержащихся на поверхности исследуемого предмета.
5. Метод отпечатков на «Бактотест» со средой Эндо при санитарно-бактериологическом контроле на объектах питания
Данный метод рекомендуется использовать для контроля эффективности санитарной обработки рабочих поверхностей, кухонного инвентаря, посуды, спецодежды и рук обслуживающего персонала.
«Бактотесты» представляют собой круглые ванночки площадью 10 см2 с крышками, выпускаемые стерильными, упакованными по 24 штуки в герметизированные пеналы и предназначенные для разового использования. Перед началом исследования необходимо приготовить среду Эндо в соответствии с наставлением по ее применению, открыть пенал с «Бактотестами», вынуть их из пенала и снять крышки; расположить «Бактотесты» на горизонтальной поверхности; прокипяченную и слегка остуженную среду Эндо разлить по 2 мл в каждую ванночку; после застывания и охлаждения среды Эндо ванночки закрыть крышками и упаковать в пеналы. Подготовленные к работе «Бактотесты» можно хранить при комнатной температуре в течение 4-х суток в сухом и защищенном от света месте.
Взятие отпечатков проводят готовыми (заправленными) «Бактотестами» путем легкого прижатия средой Эндо к обследуемой поверхности. При этом на один «Бактотест» берут 10 отпечатков (обследуемая площадь 100 см2) с поверхности больших предметов: разделочные доски, столы, весы, кастрюли, котлы, разделочные ножи, разливные ложки, тарелки, спецодежда обслуживающего персонала; один «Бактотест» используют для обследования трех мелких предметов: стаканы, чашки, столовые и чайные ложки, вилки, столовые ножи; при обследовании рук обслуживающего персонала на один «Бактотест» делают отпечатки со всех пальцев. Использованные «Бактотесты» маркируют восковым карандашом и упаковывают в пенал, закрыв крышками. После взятия отпечатков проводят инкубацию «Бактотестов» со средой Эндо в термостате при 37 °С в течение 18-24 часов. Выросшие колонии, подозрительные на бактерии группы кишечной палочки по внешнему виду и по морфологии мазков, окрашенных по Граму, высевают на среду Гисса с глюкозой в пробирки с поплавками с последующей инкубацией в термостате при 37 °С в течение 18-24 часов. Заключение о наличии микробов группы кишечной палочки на обследованных объектах делается на основании образования кислоты и газа в пробирках со средой Гисса.
Контрольные вопросы
1. Как определяют количество БГКП?
2. Какие этапы выявления сальмонелл вы знаете?
3. Что такое элективные и селективные питательные среды?
4. Какие характерные колонии образуют сальмонеллы на элективных средах?
5. Какие среды обогащения вы знаете?
6. Какие характерные колонии образуют сальмонеллы на селективных средах?
7. Что является ведущим свойством при установлении патогенности стафилококков?
8. В чем сущность реакции плазмокоагуляции?
9. Как оцениваются результаты коагулазного теста?
10. Какие санитарно-показательные микроорганизмы продуктов питания вы знаете?
11. Как осуществляется санитарно-микробиологический контроль на объектах питания?
12. С помощью каких приспособлений производится взятие смывов?
13. Какие существуют рекомендации при взятии смывов?
14. В течение какого времени после взятия смывов следует проводить их анализ?
15. В чем заключается методика посева смывов на общую бактериальную обсемененность?
16. Как осуществляется санитарно-бактериологический контроль методом отпечатков?
17. Что представляет собой «Бактотест»?
18. В каких случаях проводятся санитарно-бактериологические исследования на объектах питания?
19. Что служит объектами санитарно-бактериологических обследований в местах общественного питания?
20. Какие микроорганизмы являются индикаторами санитарного неблагополучия на пищевых предприятиях?
21. Какие методы отбора проб с предметов обихода вы знаете?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ 15.
ХАРАКТЕРИСТИКА ОСНОВНЫХ САНИТАРНО-ПОКАЗАТЕЛЬНЫХ МИКРООРГАНИЗМОВ ОБСЕМЕНЕННОСТИ ПИЩЕВЫХ ПРОДУКТОВ
1. Под БГКП понимают грамотрицательные, не образующие спор палочки, сбраживающие лактозу при температуре 36±1 °С с образованием кислоты и газа. При этом учитывают как цитратположительные, так и цитратотрицательные разновидности микроорганизмов.
2. Энтерококки - грамположительные кокки, располагающиеся парами, короткими или длинными цепочками, каталазоотрицательные. Типовой вид - Enterococcus faecalis . Согласно СанПиН 2.3.2.1078-01, количество энтерококков регламентировано в ряде быстрозамороженных готовых блюд:
· в блюдах из мяса животных и птиц - не более 1000 КОЕ/г;
· в блюдах из рубленого мяса животных и птиц, а также в блинчиках с мясом - не более 2000 КОЕ/г.
3. Сальмонеллы вызывают первичные инфекции у животных и человека, заканчивающиеся нередко летальным исходом, а также осложняют течение заболеваний вирусной и бактериальной этиологии. У переболевших животных длительное время отмечается бессимптомное сальмо-неллоносительство. При употреблении инфицированных продуктов животного происхождения (мяса, молока, яиц) сальмонеллы вызывают у человека пищевые отравления (токсикоинфекции).
4. Сульфитредуцирующие клостридии - крупные неподвижные бациллы длиной 4-8 мкм и шириной 1-1,5 мкм, в живом организме образуют капсулы, а в окружающей среде - центральные или субтерминальные овальные споры. Типовой представитель - Clostridium perfringens .
5. Стафилококки - бактерии, имеющие сферическую форму и размер 0,5-1,5 мкм, в результате деления более чем в одной плоскости образуют гроздевидные скопления, неподвижные, грамположительные. Типовой вид - S . aureus . Образуют внеклеточные ферменты и токсины и при определённых условиях могут стать причиной пищевых интоксикаций.
6. Бактерии рода Proteus - полиморфные грамотрицательные палочки размерами 1-3 мкм в длину и 0,4 мкм в ширину. Располагаются попарно или цепочками, спор и капсул не образуют, подвижны. К роду относятся два вида микроорганизмов - P . mirabilis и P . vulgaris . Присутствие в пищевых продуктах микроорганизмов этой группы - признак начала гнилостных изменений. Указанные бактерии также могут быть причиной пищевых токсикоинфекций.
7. Listeria monocytogenes - подвижная, грамположительная, микроаэ-рофильная, не образующая спор палочка, патогенная для человека, животных и птиц. Заболевание характеризуется септическими явлениями, поражением центральной нервной системы. Наряду с тяжёлыми клиническими проявлениями встречаются лёгкие формы заболевания и носительство. Листерии длительно сохраняются (в высушенном состоянии - до 7 лет) и могут даже размножаться в пищевых продуктах при низких температурах хранения. Как факторы передачи листериоза наибольшую опасность представляют мясные (мясо заражённых свиней) и молочные продукты.
Правила и техника взятия смывов для санитарно-бактериологических исследований на объектах питания
Взятие смывов производится с помощью стерильных увлажненных ватных тампонов. Стерильные ватные тампоны на стеклянных, металлических или деревянных палочках, вмонтированных в пробирки с ватными пробками, заготавливают заранее в лаборатории. В день взятия смывов в каждую пробирку с тампоном наливается (в условиях бокса над горелкой) по 5 мл стерильного 0,1% водного раствора пептона или изотонического раствора хлорида натрия таким образом, чтобы ватный тампон не касался жидкости. Непосредственно перед взятием смыва тампон увлажняют наклонением пробирки или опусканием тампона в жидкость. В процессе отбора смывов рекомендуется неоднократное смачивание тампонов.
При взятии смывов необходимо пользоваться следующими рекомендациями:
1) Из оборудования следует обращать внимание на разделочные доски, мясорубки, производственные столы для готовой пищи, особенно в цехе приготовления холодных закусок.
2) Смывы с рук, с санитарной одежды, полотенец берутся в основном у работников, имеющих дело с продукцией, не подвергающейся в дальнейшем тепловой обработке (персонал кухни, холодного цеха, раздатчицы, буфетчицы, официанты, продавцы).
3) Смывы с крупного оборудования и инвентаря берут с поверхности в 100 см2, для ограничения поверхностей используют шаблон (трафарет), сделанный из проволоки, металлической пластинки. Трафарет имеет площадь 25 см2, чтобы взять смывы с площади в 100 см2, его накладывают 4 раза в разных местах поверхности контролируемого объекта.
4) При взятии смывов с мелких инструментов обтирается вся поверхность предмета, при заборе смывов с тарелок протирают всю внутреннюю поверхность. При взятии смывов с мелких предметов одним тампоном протирают три одноименных объекта - три тарелки, три ложки и т.п. У столовых приборов протирают их рабочую часть.
5) При исследовании стаканов протирают внутреннюю поверхность и верхний наружный край стакана на 2 см вниз.
6) При взятии смывов с рук протирают тампоном ладонные поверхности обеих рук, проводя не менее 5 раз по каждой ладони и пальцам, затем протирают межпальцевые пространства, ногти и подногтевые пространства.
7) При взятии смывов с санитарной одежды протирают 4 площадки по 25 см2 - нижнюю часть каждого рукава и 2 площадки с верхней и средней частей передних пол спецовки. С различных мест полотенца берут 4 площадки по 25 см2.
После проведения смыва тампон вкладывают в ту же пробирку, погружая в жидкость. На каждой пробирке отмечают порядковый номер. Под тем же номером записывают в протокол наименование объекта, с которого взят смыв. При взятии смывов с рук и санитарной одежды записывают фамилию, имя и отчество сотрудника, выполняемую работу (профессия, участок работы). Смывы доставляют в бактериологическую лабораторию в течение 2 ч. Допускается их хранение и транспортирование не более 6 ч при температуре +1-10 °С.
З А Н Я Т И Е 16
Дата ______________
Тема: Внутрибольничные инфекции. Оппортунистические инфекции. Специфическая и неспецифическая профилактика инфекционных заболеваний. Биопрепараты.
План занятия:
1. Понятие о внутрибольничных инфекциях.
2. Понятие о национальном календаре прививок, вакцинация. Календарь профилактических прививок по эпидемическим показаниям.
3. Понятие о медицинских иммунобиологических препаратах (МИБП)
Методические указания:
1. Понятие о внутрибольничных инфекциях
Внутрибольничные инфекции (ВБИ), синоним госпитальные, нозокомиальные – любое клинически распознаваемое инфекционное заболевание, которое поражает больного в результате его поступления в больницу или обращения в нее за лечебной помощью, или инфекционное заболевание сотрудника больницы вследствие его работы в данном учреждении, вне зависимости от появления симптомов заболевания во время или после пребывания в больнице (определение Евробюро ВОЗ, 1979 г.).
Любое клинически выраженное заболевание микробного происхождения, которое поражает больного в результате его поступления в больницу или обращения за медицинской помощью вне зависимости от появления симптомов заболевания у пациента во время пребывания в стационаре или после его выписки, а также инфекционное заболевание сотрудника лечебной организации вследствие его инфицирования при работе в данной организации подлежит учету и регистрации как внутрибольничная инфекция (Постановление Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58
"Об утверждении СанПиН 2.1.3.2630-10 "Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность»).
Такие инфекции отягощают течение основного заболевания, нередко создают угрозу для жизни больного, удлиняют сроки пребывания больных в госпиталях и наносят большой дополнительный экономический ущерб. В России от внутрибольничных инфекций ежегодно страдает около 2 млн. человек, а летальность от них составляет более 15%, что во много раз превосходит общую летальность в стационарах (около 0,4-0,5%). В различных странах Европы частота госпитальных инфекций варьирует от 6 до 27%, в США - около 7-8%; экономический ущерб, причиняемый ими ежегодно, составляет несколько миллиардов долларов.
Особенности ВБИ определяются следующими обстоятельствами.
· Как правило, они присоединяются к основному заболеванию или впервые поражают организм новорожденного.
· Не существует строгой этиологии чисто госпитальных инфекций. При соответствующих условиях госпитальную инфекцию может вызвать любой патогенный или условно-патогенный микроорганизм.
· Поскольку возбудителями госпитальных инфекций очень часто бывают условно-патогенные бактерии, возможность возникновения их во многом зависит от иммунного состояния макроорганизма, величины заражающей дозы, степени вирулентности возбудителя и путей проникновения его в организм. Различные формы иммунодефицита - одно из главных условий, способствующих развитию оппортунистических инфекций. Оппортунистическими инфекциями называют заболевания, вызываемые условно- или слабопатогенными микроорганизмами у людей с пониженной иммунореактивностью (страдающих иммунодефицитами).
· Патогенез и клиническая картина госпитальных инфекций крайне разнообразны и не всегда специфичны.
2. Понятие о национальном календаре прививок. Календарь профилактических прививок по эпидемическим показаниям
Национальный календарь прививок (НКП) регламентирован приказом Министерства здравоохранения РФ от 21 марта 2014 г. N 125н «Национальный календарь профилактических прививок РФ и календарь профилактических прививок по эпидемическим показаниям», зарегистрирован в Минюсте России 25 апреля 2014 г. N 32115.
Приказ Министерства здравоохранения РФ от 21 марта 2014 г. N 125н
"Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям"
С изменениями и дополнениями от:
16 июня 2016 г.
Обязательная часть НКП
| Категории и возраст граждан, подлежащих обязательной вакцинации | Наименование профилактической прививки |
| Новорожденные в первые 24 часа жизни | Первая вакцинация против вирусного гепатита B <1> |
| Новорожденные на 3 - 7 день жизни | Вакцинация против туберкулеза <2> |
| Дети 1 месяц | Вторая вакцинация против вирусного гепатита B <1> |
| Дети 2 месяца | Третья вакцинация против вирусного гепатита B (группы риска) <3> |
| Первая вакцинация против пневмококковой инфекции | |
| Дети 3 месяца | Первая вакцинация против дифтерии, коклюша, столбняка |
| Первая вакцинация против полиомиелита <4> | |
| Первая вакцинация против гемофильной инфекции (группы риска) <5> | |
| Дети 4,5 месяцев | Вторая вакцинация против дифтерии, коклюша, столбняка |
| Вторая вакцинация против гемофильной инфекции (группы риска) <5> | |
| Вторая вакцинация против полиомиелита <4> | |
| Вторая вакцинация против пневмококковой инфекции | |
| Дети 6 месяцев | Третья вакцинация против дифтерии, коклюша, столбняка |
| Третья вакцинация против вирусного гепатита B <1> | |
| Третья вакцинация против полиомиелита <6> | |
| Третья вакцинация против гемофильной инфекции (группа риска) <5> | |
| Дети 12 месяцев | Вакцинация против кори, краснухи, эпидемического паротита |
| Четвертая вакцинация против вирусного гепатита B (группы риска) <3> | |
| Дети 15 месяцев | Ревакцинация против пневмококковой инфекции |
| Дети 18 месяцев | Первая ревакцинация против полиомиелита <6> |
| Первая ревакцинация против дифтерии, коклюша, столбняка | |
| Ревакцинация против гемофильной инфекции (группы риска) | |
| Дети 20 месяцев | Вторая ревакцинация против полиомиелита <6> |
| Дети 6 лет | Ревакцинация против кори, краснухи, эпидемического паротита |
| Дети 6 - 7 лет | Вторая ревакцинация против дифтерии, столбняка <7> |
| Ревакцинация против туберкулеза <8> | |
| Дети 14 лет | Третья ревакцинация против дифтерии, столбняка <7> |
| Третья ревакцинация против полиомиелита <6> | |
| Взрослые от 18 лет | Ревакцинация против дифтерии, столбняка - каждые 10 лет от момента последней ревакцинации |
| Дети от 1 года до 18 лет, взрослые от 18 до 55 лет, не привитые ранее | Вакцинация против вирусного гепатита B <9> |
| Дети от 1 года до 18 лет, женщины от 18 до 25 лет (включительно), не болевшие, не привитые, привитые однократно против краснухи, не имеющие сведений о прививках против краснухи | Вакцинация против краснухи |
| Дети от 1 года до 18 лет включительно и взрослые в возрасте до 35 лет (включительно), не болевшие, не привитые, привитые однократно, не имеющие сведений о прививках против кори | Вакцинация против кори <10> |
| Дети с 6 месяцев, учащиеся 1 - 11 классов; обучающиеся в профессиональных образовательных организациях и образовательных организациях высшего образования; взрослые, работающие по отдельным профессиям и должностям (работники медицинских и образовательных организаций, транспорта, коммунальной сферы); беременные женщины; взрослые старше 60 лет; лица, подлежащие призыву на военную службу; лица с хроническими заболеваниями, в том числе с заболеваниями легких, сердечно-сосудистыми заболеваниями, метаболическими нарушениями и ожирением | Вакцинация против гриппа |
<1> Первая, вторая и третья вакцинации проводятся по схеме 0-1-6 (1 доза - в момент начала вакцинации, 2 доза - через месяц после 1 прививки, 3 доза - через 6 месяцев от начала вакцинации), за исключением детей, относящихся к группам риска, вакцинация против вирусного гепатита B которых проводится по схеме 0-1-2-12 (1 доза - в момент начала вакцинации, 2 доза - через месяц после 1 прививки, 2 доза - через 2 месяца от начала вакцинации, 3 доза - через 12 месяцев от начала вакцинации).
<2> Вакцинация проводится вакциной для профилактики туберкулеза для щадящей первичной вакцинации (БЦЖ-М); в субъектах Российской Федерации с показателями заболеваемости, превышающими 80 на 100 тыс. населения, а также при наличии в окружении новорожденного больных туберкулезом - вакциной для профилактики туберкулеза (БЦЖ).
<3> Вакцинация проводится детям, относящимся к группам риска (родившимся от матерей - носителей HBsAg, больных вирусным гепатитом B или перенесших вирусный гепатит B в третьем триместре беременности, не имеющих результатов обследования на маркеры гепатита B, потребляющих наркотические средства или психотропные вещества, из семей, в которых есть носитель HBsAg или больной острым вирусным гепатитом B и хроническими вирусными гепатитами).
<4> Первая и вторая вакцинации проводятся вакциной для профилактики полиомиелита (инактивированной).
<5> Вакцинация проводится детям, относящимся к группам риска (с иммунодефицитными состояниями или анатомическими дефектами, приводящими к резко повышенной опасности заболевания гемофильной инфекцией; с онкогематологическими заболеваниями и/или длительно получающим иммуносупрессивную терапию; детям, рожденным от матерей с ВИЧ-инфекцией; детям с ВИЧ-инфекцией; детям, находящимся в домах ребенка).
<6> Третья вакцинация и последующие ревакцинации против полиомиелита проводятся детям вакциной для профилактики полиомиелита (живой); детям, рожденным от матерей с ВИЧ-инфекцией, детям с ВИЧ-инфекцией, детям, находящимся в домах ребенка - вакциной для профилактики полиомиелита (инактивированной).
<7> Вторая ревакцинация проводится анатоксинами с уменьшенным содержанием антигенов.
<8> Ревакцинация проводится вакциной для профилактики туберкулеза (БЦЖ).
<9> Вакцинация проводится детям и взрослым, ранее не привитым против вирусного гепатита B, по схеме 0-1-6 (1 доза - в момент начала вакцинации, 2 доза - через месяц после 1 прививки, 3 доза - через 6 месяцев от начала вакцинации).
<10> Интервал между первой и второй прививками должен составлять не менее 3 месяцев.
Порядок проведения гражданам профилактических прививок в рамках национального календаря профилактических прививок
1. Профилактические прививки в рамках национального календаря профилактических прививок проводятся гражданам в медицинских организациях при наличии у таких организаций лицензии, предусматривающей выполнение работ (услуг) по вакцинации (проведению профилактических прививок).
2. Вакцинацию осуществляют медицинские работники, прошедшие обучение по вопросам применения иммунобиологических лекарственных препаратов для иммунопрофилактики инфекционных болезней, организации проведения вакцинации, техники проведения вакцинации, а также по вопросам оказания медицинской помощи в экстренной или неотложной форме.
3. Вакцинация и ревакцинация в рамках национального календаря профилактических прививок проводятся иммунобиологическими лекарственными препаратами для иммунопрофилактики инфекционных болезней, зарегистрированными в соответствии с законодательством Российской Федерации, согласно инструкциям по их применению.
4. Перед проведением профилактической прививки лицу, подлежащему вакцинации, или его законному представителю разъясняется необходимость иммунопрофилактики инфекционных болезней, возможные поствакцинальные реакции и осложнения, а также последствия отказа от проведения профилактической прививки и оформляется информированное добровольное согласие на медицинское вмешательство в соответствии с требованиями статьи 20 Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации"*.
5. Все лица, которым должны проводиться профилактические прививки, предварительно подвергаются осмотру врачом (фельдшером)**.
6. При изменении сроков вакцинации ее проводят по предусмотренным национальным календарем профилактических прививок схемам и в соответствии с инструкциями по применению иммунобиологических лекарственных препаратов для иммунопрофилактики инфекционных болезней. Допускается введение вакцин (кроме вакцин для профилактики туберкулеза), применяемых в рамках национального календаря профилактических прививок, в один день разными шприцами в разные участки тела.
7. Вакцинация детей, которым иммунопрофилактика против пневмококковой инфекции не была начата в первые 6 месяцев жизни, проводится двукратно с интервалом между прививками не менее 2 месяцев.
8. Вакцинация детей, рожденных от матерей с ВИЧ-инфекцией, осуществляется в рамках национального календаря профилактических прививок в соответствии с инструкциями по применению иммунобиологических лекарственных препаратов для иммунопрофилактики инфекционных болезней. При вакцинации таких детей учитываются: ВИЧ-статус ребенка, вид вакцины, показатели иммунного статуса, возраст ребенка, сопутствующие заболевания.
9. Ревакцинация детей против туберкулеза, рожденных от матерей с ВИЧ-инфекцией и получавших трехэтапную химиопрофилактику передачи ВИЧ от матери ребенку (во время беременности, родов и в периоде новорожденности), проводится в родильном доме вакцинами для профилактики туберкулеза (для щадящей первичной вакцинации). У детей с ВИЧ-инфекцией, а также при обнаружении у детей нуклеиновых кислот ВИЧ молекулярными методами ревакцинация против туберкулеза не проводится.
10. Вакцинация живыми вакцинами в рамках национального календаря профилактических прививок (за исключением вакцин для профилактики туберкулеза) проводится детям с ВИЧ-инфекцией с 1-й и 2-й иммунными категориями (отсутствие иммунодефицита или умеренный иммунодефицит).
11. При исключении диагноза ВИЧ-инфекции детям, рожденным от матерей с ВИЧ-инфекцией, проводят вакцинацию живыми вакцинами без предварительного иммунологического обследования.
12. Анатоксины, убитые и рекомбинантные вакцины в рамках национального календаря профилактических прививок вводят всем детям, рожденным от матерей с ВИЧ-инфекцией. Детям с ВИЧ-инфекцией указанные иммунобиологические лекарственные препараты для иммунопрофилактики инфекционных болезней вводятся при отсутствии выраженного и тяжелого иммунодефицита.
13. При проведении вакцинации населения используются вакцины, содержащие актуальные для Российской Федерации антигены, позволяющие обеспечить максимальную эффективность иммунизации.
14. При проведении вакцинации против гепатита В детей первого года жизни, против гриппа детей с 6-месячного возраста, обучающихся в общеобразовательных организациях, беременных женщин используются вакцины, не содержащие консервантов.
Дата: 2019-03-05, просмотров: 374.