В сложной проблеме газообмена нередко теряется из вида роль эритроцита -клетки, ответственной за доставку О2 к периферическим тканям и удаление образующегося в процессе метаболизма СО2. Эритроцит происходит из недифференцированной костномозговой стволовой клетки. При созревании клетка утрачивает ядро, рибосомы и митохондрии. Вследствие этого эритроцит не способен выполнять обычные для клеток млекопитающих функции, в том числе клеточное деление, окислительное фосфорилирование и синтез белка. Источником энергии для эритроцита служит преимущественно глюкоза, метаболизируемая в цикле Эмбдена—Мейерго-фа, или гексозомонофосфатном шунте.
Мембрана эритроцита
Клеточная мембрана эритроцита обладает свойствами, позволяющими ему эффективно переносить О2. Гибкость мембраны способствует прохождению эритроцита через узкие капилляры, а ее прочность обеспечивает устойчивость к дей-с i вию турбулентного потока в крупных кровеносных сосудах. Клеточная мембрана имеет типичную липидную двуслойную структуру. Она содержит фосфолипиды, пеэтерифицированный холестерин, гликолипиды и белки. Мембранные белки вы пашяют важные функции поддержания кальциевого гомеостаза, объема клетки, * 'бмена анионов. Эти белки служат также в качестве мембранных каналов и поверхностных рецепторов клетки.
Гемоглобин
Наиболее важным внутриклеточным белком для транспорта О2 и СО,, является '•моглобин (I Ib). Каждая молекула гемоглобина состоит из белка /лобина \\ /ема.
Геморрагия легких
Острая альвеолярная геморрагия сопровождается увеличением DLCO. Дополнительное количество гемоглобина в альвеолярных пространствах увеличивает накопление СО, обусловливая больший перенос СО во время измерения DLCO. Хроническая рецидивирующая альвеолярная геморрагия вызывает легочный фиброз и снижает DLCO.
Полицитемия и анемия
Повышение гематокрита (полицитемия) увеличивает DLCO за счет роста количества эритроцитов в капиллярах (большее "вместилище" для СО), в то время как уменьшение гематокрита (анемия) снижает DLCO. Изменения величины гематокрита должны быть математически учтены для корректной интерпретации DLCO как меры легочной функции. Коррекция выполняется с помощью поправочных уравнений, выведенных на основе клинических данных.
Обмен СО2 в легких
Поскольку растворимость СО2 в тканях примерно в 20 раз больше, чем О2, то и скорость диффузии СО2 через альвеолярно-капиллярную мембрану в 20 раз выше. Поэтому система в целом располагает значительными резервами относительно диффузии СО2, и незначительные изменения в состоянии паренхимы легких не сопровождаются появлением артериально-альвеолярного градиента СО2.
При умеренном или значительном утолщении альвеолярно-капиллярной мембраны перенос СО2из крови в альвеолы может затрудняться. Когда DLCO снижается примерно до 25 % нормальной величины, перенос СО2 ухудшается и развивается артериально-альвеолярный градиент СО2.
Избранная литература
Cotes]. Е., DabbsJ. M., Elwood P. С., Hall A. M, McDonald A., Saimdres M. J. Iron deficiency anemia: Its effect on transfer factor for the lung ( diffusing capacity) and ventilation and cardiac frequency during sub-maximal exercise. Clin. Sci. 42:325-335,1972.
Filley G. F., Macintosh D. J., Wright G. W. Carbon monoxide uptake and pulmonary diffusing capacity in normal subjects at rest and during exercise. J. Clin. Invest. 33: 530-539,1954.
Forster R E. Exchange of gases between alveolar air and pulmonary capillary blood: Pulmonary diffusion capacity. Physiol. Rev. 37:391—452,1957.
Krogh M. The diffusion of gases through the lungs of man.). Physiol 49: 271—300, 1915.
Ogilvie C. M., Forster R. E., Blakemore W. S., Morton J. W. A standardized breath holding technique for the clinical measurement of the diffusing capacity of the lung for carbon monoxide. J. Clin. Invest. 36: 1 — 17,1957.
Roughton F. J. W., Forster R. E. Relative importance of diffusion and chemical reaction rates in determining the rate of exchange of gases in the human lung, with special reference to true diffusing capacity of pulmonary membrane and volume of blood in the lung capillaries. J. Appl. Physiol. 11: 290-302, 1957.
Рис. 10-1. Структура гемоглобина. Молекула гемоглобина состоит из двух а- и двух р-цспей. Каждая цепь содержит половину тема, в которую входит двухвалентное железо, способное присоединять О2. Конформа-ционные изменения субъединиц по мере присоединения О2 облегчают дополнительную загрузку кислородом. (Из: Schrier S. L. Hematology. Scientific American Medicine 2: 7, 1988.)
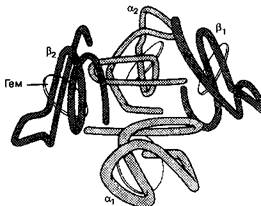
Глобин представляет собой тетрамер полипептидной цепи. Гемоглобин А (НЬА), основной гемоглобин взрослых, содержит две а- и две р-цепи и обозначается как а2(32. Неосновной гемоглобин взрослых, НЬА^, содержит две а- и две дельта (8)-цепи
(<*252).
Первичную структуру белковой молекулы определяет последовательность аминокислот глобиновых цепей, спиральное расположение цепей придает белкам вторичную структуру. Каждая а-субъединица НЬА содержит 141 аминокислоту, уложенных в 8 спиралей. Каждая р-цепь состоит из 196 аминокислот, составляющих 7
спиралей.
Укладывание протеиновых спиралей в трехмерную форму придает белкам третичную структуру — состояние, которое энергетически наиболее выгодно и максимально стабильно. Третичная структура определяется гидрофобным взаимодействием между углеводородными фрагментами боковых цепей полипептидов.
Четвертичная глобиновая структура- конечный уровень организации молекулы гемоглобина - очень сложна. Она определяется прежде всего нековалентными связями между полипептидными цепями. Четвертичная структура молекулы подвержена значительным конформационным сдвигам во время выполнения эритроцитом своих функций, включая связывание О2.
Другой компонент гемоглобина, гем, состоит из одного иона железа (Fe2*), встроенного в порфириновое кольцо (протопорфирин IX). Кислород связывается непосредственно с половиной тема, встроенной в спиральную структуру каждой глоби-новой полипептидной цепи. Ион железа тема обратимо присоединяет одну молекулу О2. С одной молекулой гемоглобина связываются максимально четыре молекулы О2. Гемоглобин, полностью загруженный О2, называется оксигемоглобином, а гемоглобин без О;» или присоединивший менее четырех молекул О2 — деоксшенирован-ным гемоглобином.
Уникальное расположение тема и молекул протеина в гемоглобине человека имеет решающее значение для обратимого связывания О2. В изолированной ионной форме железосодержащий гем связывает О2необратимо, образуя окисленный гем (Fe н), который не освобождает кислород на тканевом уровне. В интактной молекуле гемоглобина связывание О2 с Fe^-гемом вызывает значительные конформацион-ные изменения как третичной, так и четвертичной структуры глобина, предотвращающие образование Неи ионов. В результате происходит обргшшлю*? связывание О2 гемоглобином, что имеет важное значение для высвобождения кислорода, его по-
Транспорт кислорода
Связывание О2 с гемоглобином зависит от разницы Р()2 между альвеолами и эритроцитами (гл. 9). Венозная кровь с низким содержанием кислорода обеспечивает своего рода "резервуар" для его связывания, способствуя продвижению О2 в эритроцит. О2 транспортируется артериальной кровью в двух формах: связанный с гемоглобином внутри эритроцита и растворенный в плазме.
Дата: 2019-03-05, просмотров: 420.