Технологические приемы получения металлических циркония и гафния практически не отличаются друг от друга. Энергетические характеристики их соединений, используемых в металлотермических процессах, чрезвычайно близки (табл. 29).
Таблица 29
Энергия Гиббса D Go298 теплота образования D Ho298 соединений циркония и гафния (в расчете на один атом окислителя)
| соединение | -DGo298 | -DНo298 | соединение | -DGo298 | -DНo298 |
| HfO2 | 126,2 | 133,1 | HfCl4 | 58,4 | 62,5 |
| ZrO2 | 123,9 | 130,8 | ZrF3 | 111,0 | 117,0 |
| ZrCl2 | 67,0 | 72,8 | ZrF2 | 109,5 | 116,7 |
| ZrCl3 | 64,3 | 69,3 | ZrF4 | 106,2 | 111,2 |
| ZrCl4 | 52,3 | 57,7 | HfF4 | 103,3 | 108,8 |
Специфика получения циркония и гафния в сравнении с титаном обусловлена некоторыми различиями в химическом поведении и агрегатном состоянии их соединений.
Восстановление окислов
Двуокись циркония восстанавливают кальцием, процесс начинается при 700° С и проходит полностью при 1000° С. При повышении температуры > 1100° С наблюдается спекание зерен, и получаемый порошок обладает меньшей пирофорностью. Избыток кальция сверх теоретически необходимого по реакции
ZrO2 + 2Са = 2СаО + Zr
составляет 10-50%.
Процесс осуществляют в герметически закрытом реакторе, в который послойно загружается ZrO2 (крупностью 0,175 мм} и и кальций в виде стружки (2х5х20 мм). Добавка CaClz может быть меньше, чем в случае восстановления титана, так как порошок циркония обладает большей коррозионной стойкостью и окисляется в меньшей степени, несмотря на мелкозернистость. Процесс следует проводить в вакууме либо в атмосфере инертного газа.
Восстановление ZrO2 гидридом кальция протекает в тех же условиях, что и восстановление титана.
Восстановление фторидов
Фториды имеют преимущество перед хлоридами вследствие их малой гигроскопичности. В настоящее время в промышленных масштабах производят тетрафторид циркония ZrF4 и фторцирконат калия K2ZrF6. Фториды циркония и гафния могут быть восстановлены натрием, кальцием, магнием и алюминием. Использование в качестве восстановителя кальция и магния приводит к образованию нерастворимых фторидов, в то время как NaF легко удаляется из реакционной смеси в результате обработки водой.
Теплоты реакции восстановления
K2ZrF6 + 4Na = Zr + 4NaF + 2KF
не хватает для самопроизвольного протекания процесса, поэтому для поддержания температуры реакции (800-900° С) необходим внешний подогрев.
Схема аппарата для натриетермического восстановления фторцирконата калия представлена на рис. 73. В толстостенный тигель вставлен реакционный цилиндр из нержавеющей стали. Готовят расплав, состоящий из смеси 90 кг K2ZrF6, 16,5 кг KCl и 16,5 кг NaCl. KC1 и NaCl добавляют для снижения температуры плавления смеси. Застывший расплав измельчают (до 1 мм} и засыпают в бункер. В реакционный сосуд заливают расплавленный натрий, повышают температуру до 800° С и из бункера подают смесь K2ZrF6+KCl+NaCl. Фторцирконат падает на поверхность расплавленного натрия, и образующиеся кристаллы металлического циркония опускаются на дно реактора. Жидкий натрий и расплавленные хлориды защищают образующийся металл от контакта с газом (обычно во время реакции аппарат заполняется водородом). В дальнейшем реакционную массу измельчают и выщелачивают водой. В результате реакции восстановления образуется большое количество солей, что приводит к формированию мелких кристаллов порошка циркония и его загрязнению кислородом. Содержание циркония в таком порошке 98-99%. Его используют в основном в военном деле (для различных взрывчатых и воспламеняющихся смесей), в пиротехнике и в электровакуумной технике (в качестве геттера).
-
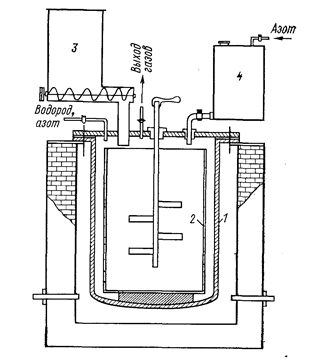
Рис. 73. Схема аппарата для натриетермического восстановления фторцирконата калия (Меерсон Г. А., Зеликман А. Н., 1955, с. 385, рис. 123):
1 - тигель; 2 - реактор; 3 - бункер; 4 - бачок с расплавленным натрием.
Представляет большой интерес получение слитка циркония непосредственно в печи для восстановления. В этом плане более перспективным представляется восстановление фторидов из-за более низкого давления насыщенного пара при высокой температуре и меньшей склонности к гидролизу.
Металлический кальций является самым эффективным восстановителем для тетрафторида и низших фторидов циркония. Учитывая возможность стадийного протекания процесса кальциетермического восстановления с образованием в качестве промежуточных продуктов низших фторидов циркония, можно предположить протекание следующих реакций:
ZrF4 + 2Са = Zr + 2CaF2; (I)
ZrF4 + ½ Са = ZrF3 + ½ CaF2; (II)
ZrF3 + 3/2 Са = Zr + 3/2 CaF2; (III)
ZrF3 + ½ Са = ZrF2 + ½ CaF2; (IV)
ZrF4 + Са = ZrF2 + CaF2; (V)
ZrF4 + Са = Zr + CaF2. (VI)
Значения теплового эффекта и энергии Гиббса реакций (I)-(VI) для интервала 298-1100° К представлены в табл. 30.
Таблица 30
Зависимость теплового эффекта и энергии Гиббса реакций (I) - (VI) от температуры
| реакция | Величина, ккал | Температура, К | ||||
| 298 | 500 | 800 | 1000 | 1100 | ||
| (I) | -DHoT -DGoT | 132,200 131,394 | 131,869 130,892 | 132,259 130,381 | 131,372 129,907 | 132,463 129,639 |
| (II) | -DHoT -DGoT | 51,450 49,826 | 51,516 48,697 | 51,594 47,008 | 51,447 45,977 | 51,391 45,317 |
| (III) | -DHoT -DGoT | 80,750 81,567 | 80,353 82,195 | 80,665 83,372 | 80,895 84,030 | 81,072 84,322 |
| (IV) | -DHoT -DGoT | 22,250 24,613 | 20,581 26,669 | 18,268 30,944 | 16,445 34,320 | 15,462 36,151 |
| (V) | -DHoT -DGoT | 73,700 74,440 | 72,097 75,366 | 69,862 77,953 | 67,922 80,197 | 66,852 81,468 |
| (VI) | -DHoT -DGoT | 58,500 56,954 | 59,772 55,526 | 62,397 52,428 | 64,450 49,710 | 65,611 48,171 |
Величина теплового эффекта свидетельствует о значительной экзотермичности реакций, а значения энергии Гиббса – o возможности протекания их во всем указанном температурном интервале.
Для получения слитка циркония необходим перегрев продуктов реакции на 200-250° С выше температуры плавления металлического циркония (2125° К). В табл. 31 приведено количество тепла, необходимое для нагрева продуктов реакций (I), (III), (VI) от 298 до 2400° К.
Таблица 31
Дата: 2019-03-05, просмотров: 660.