Еще в 1826 г. Мозандер впервые получил металлический церий восстановлением СеСl3 калием в атмосфере водорода.
Основной металлотермической реакцией получения редкоземельных металлов является реакция восстановления галогенидов (обычно хлоридов) натрием, калием, кальцием и алюминием. Трихлориды самария, европия и иттербия не могут быть восстановлены кальцием до металла, так как образуются устойчивые дихлориды перечисленных металлов.
Гадолиний и иттрий также не удается получить восстановлением хлоридов кальцием, так как при температуре, достаточной для расплавления получаемых металлов, хлорид кальция сильно вспенивается, что делает невозможным отделение металла от шлака. Проблема разрешается заменой хлоридов на фториды. Фториды менее гигроскопичны, а в результате восстановления образуется стабильный фторидный шлак, что обеспечивает полное разделение металла и шлака. Кроме того, применение танталовых тиглей сильно снизило загрязнение металла материалом тигля. Методом восстановления фторидов кальцием можно получить все редкоземельные металлы, кроме самария, европия и иттербия.
Шихтовку кальция и фторида редкоземельного металла производят в атмосфере инертного газа. Кальций берут с 10%-ным избытком против требуемого по реакции
ЗСа + 2RР3 == 3CаР2 + 2R.
Шихту загружают в танталовый тигель, который закрывают перфорированной танталовой крышкой, помещают в кварцевую трубу вакуумной индукционной печи и медленно нагревают для дегазации до 600° С. При этой температуре в систему вводят очищенный аргон до остаточного давления 500 мм рт.ст. В зависимости от получаемого металла температуру реакции поддерживают от 800 до 1000° С. Для разделения металла и шлака температуру в конце процесса поднимают до расплавления компонентов. Желательна температура процесса как минимум на 50° С выше точки плавления получаемого металла. Для разделения металла и шлака смесь выдерживают 15 мин при этой максимальной температуре. После охлаждения тигля металл извлекают и очищают от шлака. В танталовом тигле диаметром 50 и высотой 200 мм можно выплавить корольки металла массой до 300 г.
В настоящее время разработан промышленный метод получения иттрия высокой чистоты восстановлением фторида кальцием в присутствии магния по схеме:
НF (г.)
Y2O3 ¾¾¾® F3 (I)
750оС
Ca, Mg, CaCl2
YF3 ¾¾¾¾® Y-Mg (сплав) (II)
750оС
Дробление, отгонка в вакууме
Y-Mg ¾¾¾¾¾¾¾¾® Y (губка) (III)
750-1200оС
Металлический самарий, европий и иттербий получают методом, основанным на разнице значения давления пара лантана и значительно более высокого значения давления пара трех указанных металлов при одинаковой температуре. Шихту, состоящую из окислов Sm2O3, Eu2O3 или Yb2O3 и лантановой стружки, взятой с 10%-ным избытком, нагревают в вакууме в танталовом тигле. При этом протекает реакция ¾®
2La + Sm2O3 = La2O3 + 2Sm.
Нижняя часть тигля, помещенная в зону наивысшей температуры, служит зоной реакции, верхняя - конденсатором, на стенках которого конденсируется восстанавливаемый летучий металл. Используя реакционную камеру диаметром 50 мм, за одну операцию получают 300-400 г металла. Верхняя часть реактора изготовлена в виде медного конденсатора, охлаждаемого воздухом. Температура конденсатора 300-490° С. При этой температуре обеспечивается хороший рост зерен. Слишком низкая температура конденсатора приводит к образованию пирофорного порошкообразного осадка.
Вместо лантана в качестве восстановителя можно использовать церий и даже мишметалл. Увеличение размеров тигля позволяет получить большое количество металла в одной загрузке.
Получение титана
Особенности металлургии титана связаны с его способностью поглощать газы при повышенной температуре и взаимодействовать с материалом реакторов. Многовалентность титана и образование ряда соединений низшей валентности также определяют специфику процесса.
С термодинамической точки зрения осуществимо восстановление титана из окислов атомарным водородом, однако использование метода ограничивается серьезными техническими трудностями, а также возможностью образования гидрида.
Зависимость от температуры lgK реакции
TiO2 + 2СО = Ti + 2CO2
(lg K = -18300/T +0,612) показывает, что даже при 3000° К lgK = - 5,49. Для процесса восстановления двуокиси титана углеродом с выделением СО lgК = 0,98 при 2000° К, однако одновременно с металлом при этом образуется карбид. Восстановление карбидом кальция невозможно не только из-за образования карбида, но и вследствие образования титаната кальция, восстанавливающегося труднее, чем двуокись титана. При сравнительно низкой температуре с достаточной полнотой протекает реакция
TiO2 + 2СаН « Ti + 2СаО + H2 - 7200 кал;
lg K = -1575/T + 12,41
Однако практического применения этот метод не нашел.
В качестве восстановителей двуокиси (в соответствии с зависимостью DG° от температуры) можно использовать Аl, Mg, Ca, Zr, Be. Два последних металла не применяют по экономическим соображениям.
Реакция восстановления TiO2 алюминием и магнием описывается уравнениями:
З TiO2 + 4А1 = 2А12О3 + 3Ti - 143 000 кал;
TiO2 + 2Mg = 2MgO + Ti - 69 000 кал.
Практическое осуществление этих процессов наталкивается на некоторые трудности. При восстановлении магнием образуется TiO, а не металлический титан. Для успешного проведения процесса необходимо повысить температуру до более 1000° С, что неприемлемо из-за взаимодействия металлического титана при этой температуре с материалом реактора. Алюминий образует с титаном сплав, удаление восстановителя из которого затруднено. Кроме того, получающийся металл содержит повышенное количество кислорода.
Восстановление TiCl4 магнием
В промышленной практике широко используют восстановление хлоридов титана. Восстановление TiCl4 металлами осуществляется в крупномасштабном производстве, поэтому выбор подходящего восстановителя определяется не только термодинамическими данными, но также соображениями экономики и технической осуществимости. Наиболее интересны с этой точки зрения реакции, перечисленные в табл. 27.
Таблица 27
Уравнения для расчета изменения энергии Гиббса реакции восстановления металлами
| Реакция | Уравнение энергии Гиббса, кал |
| ½ TiCl4 + 2Na = 2NaCl + ½ Ti | - 110 200 + 28 Т |
| ½ TiCl4 + Ca = CaCl2 + ½ Ti | - 94 200 + 15,9Т |
| ½ TiCl4 + Mg = MgCl2 + ½ Ti | - 66 800 + 22Т |
| ½ TiCl4 + ⅔Al = ⅔ AlCl3 + ½ Ti | - 9600 + 12, ЗТ |
В промышленности широкое распространение получили процессы восстановления магнием и натрием. Для восстановления TiCl4 алюминием требуется более высокая температура. Этот процесс осложнен также образованием сплава Ti-Al.
Способ магниетермического восстановления TiCl4 - основной в технологии титана. Достаточно сказать, что при проектировании всех заводов в СССР принят этот способ производства металлического титана. Приемлемый для промышленного производства способ получения титана магниетермическим восстановлением впервые был предложен Кроллем в 1940 г., причем первый аппарат Кролля был рассчитан на получение менее 300 г металла за цикл. Советский Союз по производству титана вышел на одно из первых мест в мире. В нашей стране созданы аппараты, позволяющие за один цикл получать 1,5-2 т титановой губки («Редмет-500», «Редмет-501»)
Для реакции
½ TiCl4 + Mg = MgCl2 + ½ Ti
выражение для константы имеет вид
Kp = 1/ [pTiCl4.p2Mg]
При избытке магния pMg = const и определяется температурой проведения реакции. Зная pMg и рассчитывая Кр реакции по уравнению (13), легко определить равновесное давление пара TiCl4, или, иными словами, полноту протекания процесса. Так, принимая для 800° С DGo » 80 ккал, имеем lg Kp = 80000/[4,57.1053] » 16. При избытке магния (800° С) pMg = 0,04ат: pTiCl4 =1/ p2MgKp = 1/ 0,042.1016 = 6,25.10-14 ат.
В реакционной системе кроме основной реакции восстановления могут протекать и другие реакции:
А. 2TiCl4 + Mg = 2ТiО3 + MgCl2 (I);
TiCl4 + Mg = ТiCl2 + MgCl2 (II);
TiCl4 + 2Mg = Ti + 2MgCl3 (III);
2TiCl3 + Mg = 2 TiCl4 + MgCl2 (IV);
2/зTiCl3 + Mg = 2/з Ti+MgCl2 (V);
TiCl2 + Mg = Ti + MgCl2 (VI);
Б. TiCl4 + Ti = 2TiCl2 (VII);
2TiCl4 + 2 TiCl2 = 4TiCl3 (VIII);
2TiCl4 + ⅔Ti = 8/3TiCl3 (IX);
2TiCl3 + Ti = 3TiCl2 (X);
B. 2TiCl4 + 2Mg = 2TiCl3 + 2MgCl (XI);
2TiCl4 + 2MgCl = 2TiCl3 + 2MgCl2 (XII);
2ТiСl3 + 2Mg = 2TiCl2 + 2MgCl (XIII);
2ТiСl3 + 2MgCl = 2TiCl2 + 2MgCl2 (XIV);
TiCl2 + 2MgCl = Ti + 2MgCl2 (XV);
Все возможные реакции разбиты на три группы: А - основные реакции - восстановление TiCl4 магнием до TiCl3, TiCl2, Ti, а также реакции довосстановления низших хлоридов; Б - вторичные реакции - взаимодействие TiCl4 с продуктами основных реакций, реакции диспропорционирования низших хлоридов; В - реакции с образованием субхлорида магния и его участием в качестве восстановителя.
При взаимодействии в конденсированных фазах термодинамически вероятны реакции (I-VI), а также (XI-XIII). Из вторичных процессов наиболее вероятна реакция (VII). Реакции (VIII) и (IX) характеризуются малой убылью энергии Гиббса, однако протекание их возможно, поскольку TiCl3 обладает высоким давлением насыщенного пара и может удаляться из сферы реакции.
В газовой фазе наиболее вероятны реакции первичного образования низших хлоридов TiCl2 и TiCl3; возможны также и вторичные реакции их образования.
Все реакции с участием субхлорида магния в качестве восстановителя характеризуются большой убылью энергии Гиббса, что может способствовать протеканию реакций его образования.
В настоящее время реакторы восстановления в промышленных условиях имеют диаметры от 850-1000 до 1300-1500 м.и при высоте от 1800-2000 до 3000 мм. Наиболее употребляемые материалы для их изготовления - малоуглеродистые, хромоникелевые стали, а также биметаллы.
Обычно используют два типа реакторов: с вставным реакционным стаканом и без стакана. Реакционный стакан предохраняет корпус реактора от проплавления и облегчает удаление реакционной массы, однако зазор между стенками стакана и аппарата резко ухудшает теплоотвод, уменьшает полезный объем аппарата. Вакуумируют реактор и подают в него TiCl4 и аргон через центральную трубу на крышке, MgCl2 сливают с помощью сифона или патрубков, расположенных сбоку или в центре днища. На рис. 69 приведена схема промышленного аппарата без стакана. Тепло от реактора отводят, как правило, охлаждая зону преимущественного протекания реакции воздухом. Охлаждающий воздух подают в нескольких точках по окружности печи. Вентиляторы включают и подают охлаждающий воздух с помощью автоматической системы.
Разнообразие возможных реакций определяет сложность установления истинного механизма протекания процесса восстановления. В настоящее время наибольшее распространение получило следующее описание процесса. Реакция происходит между жидким магнием и TiCl4 на поверхности губки, растущей у стенок аппарата, выше первоначального уровня восстановителя.
Магний к поверхности губки поднимается капиллярными силами по порам и покрывает ее поверхность пленкой. Процесс носит автокаталитический характер. Катализатором служит активная (не перекрытая хлористым магнием) поверхность губки. Предполагается, что молекулы TiCl4 проходят через стадию активированной адсорбции.
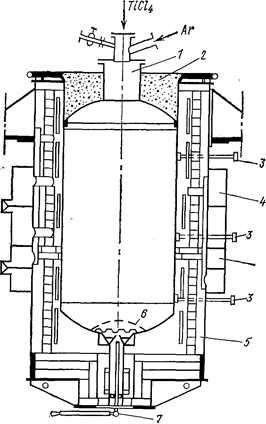
Рис. 69. Схема электропечи и реактора для восстановления магнием (Самсонов Г. В., Перминов В. П., 1971, с. 92, рис. 17):
1- реактор; 2 - крышка; 3 - термопары; 4 - воздушные коллекторы для подачи в печь охлаждающего воздуха; 5 - электропечь; 6 - перфорированное дно; 7 - запорное устройство.
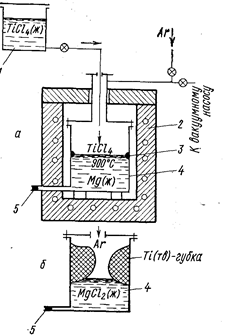
Рис. 70. Восстановление TiCl4 магнием (Вольский А. Н Сергиевская Е. М., 1968, с. 260, рис. 128):
а - начало процесса; б - конец процесса;
1- бачок с TiCl4; 2 - электропечь; 3 – место появления титановой губки; 4 - аппарат вос-становления; 5 - летка для выпуска расплава MgCl2.
Образующийся по реакции хлористый магний опускается под слой расплавленного магния (плотность MgCl2 1,68 г/см3, Mg 1,57 г/см3). Схематично рост губки в аппарате восстановления TiCl4, представлен на рис. 70. Плотность титана больше плотности MgCl2, и часть титана опускается на дно.
При высокой температуре TiCl4 реагирует с материалом реактора - железом. При этом получаются низшие хлориды и титаниды железа:
Fe + 2TiCl4 = FeCl2 + 2TiCl3;
Fe + TiCl4 = FeCl2 + TiCl2;
Fe + 2TiCl2 = FeTi + TiCl4;
Fe + 4TiCl3 = FeTi + 3TiCl4;
3Ti + 2FeCl2 = 2FeTi + TiCl4.
Побочные реакции загрязняют губку железом и низшими хлоридами. Часть низших хлоридов растворяется в хлористом магнии и довосстанавливается до титана магнием, также растворенным в MgCl2. Однако значительная часть образовавшихся низших хлоридов остается на поверхности губки, крышке и боковых стенках реактора. При демонтаже реактора низшие хлориды взаимодействуют с влагой воздуха и разлагаются с образованием окиси титана и НСl. Происходит также реакция диспропорционирования с образованием тонкодисперсного порошка металлического титана и паров TiCl4. Мелкодисперсный титан пирофорен и при выборке губки часто загорается. Пары TiCl4 портят вакуумное масло и насосы.
Большинство исследователей считают, что реакции в газовой фазе не имеют места или протекают в особых условиях (пониженные концентрации, начало процесса и т. п.).
В настоящее время из двух вариантов процесса: с догрузкой восстановителя и с единовременной загрузкой - предпочтение отдается последнему.
Представляет интерес разработка процесса восстановления TiCl4 магнием в условиях одновременной подачи исходных реагентов: магния и TiCl4. При этом могут создаться более благоприятные условия для реагирования.
Рассмотрим более подробно современную технологию. Реакционный стакан и реактор перед проведением процесса тщательно очищают (механическим способом, травлением соляной кислотой, металлическими щетками и обдувкой). Магний загружают в виде чушек, слитков или в расплавленном состоянии. Твердый магний перед загрузкой очищают от поверхностных пленок и шлаковых включений травлением в 0,5-1%-ном растворе НС1 с последующей промывкой водой. Загрузка в реактор проводится в «сухих комнатах». Для загрузки расплава применяют специальный вакуумный тигель-дозатор. Реактор перед установкой в печь восстановления вакуумируют и проверяют на герметичность, затем заполняют сухим инертным газом. В печи реактор разогревается до 400-600° С с одновременным вакуумированием. Затем его снова заполняют аргоном и разогревают до 650-760° С. При этой температуре давление инертного газа в реакторе снижают до 0,05-0,1 ат и подают TiCl4.
Вначале процесс восстановления протекает медленно - до появления на стенках реактора первых частиц титана. После этого процесс вступает в основную стадию. В процессе восстановления периодически производится слив MgCl2. В конце процесса восстановления после прекращения подачи TiCl4 для довосстановления низших хлоридов и более полного отделения MgCl2 делают 30-60-минутную выдержку при 900° С, после чего проводят последний слив MgCl2. Затем в аппарат подают аргон и охлаждают в печи до 800° С (если реактор изготовлен из нержавеющей стали) или до 600° С (из малоуглеродистой стали), чтобы избежать окисления поверхности реактора на воздухе. Дальнейшее охлаждение аппарата до 20-40° С проводят на специальном стенде с орошением его поверхности водой или обдувкой.
Реакционная масса состоит из 45-60% губчатого титана, 15-35% MgCl2 и 25-35% Mg. Содержимое аппарата восстановления высверливается на станке или удаляется с помощью отбойного молотка.
Предложено несколько режимов подачи TiCl4 в аппарат, однако лучшие показатели получены для режима стабильной максимально возможной скорости подачи в течение всего процесса. На рис. 71 показана схема автоматического регулирования процесса восстановления.
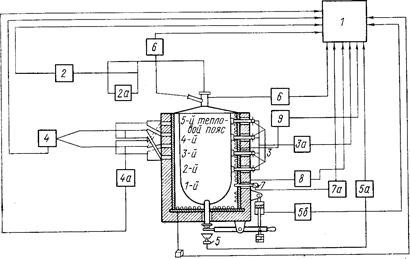
Рис. 71. Схема автоматического регулирования процесса восстановления (Самсонов Г. В., Перминов В. П., 1971, с. 70, рис. 14):
1- пульт программирования и сигнализация; 2 - расходомер TiCl4 с регулирующим клапаном 2а; 3 - термощупы для измерения температуры в зоне реакции с многопозиционным потенциометром За; 4 - вентилятор охлаждения печи с исполнительным механизмом переключения шиберов воздушного коллектора 4а: 5 - тензовесы с весомером 5а и клапаном 5б пневмоцилиндра привода устройства для слива хлористого магния; 6 - приборы регулирования давления аргона и TiCl4 в реакторе; 7 - термопара с потенциометром 7а для измерения температуры в нижней зоне реактора; 8, 9 -вольт-амперметры.
Титановую губку можно отделить от MgCl2 и магния дистилляцией в вакууме, гидрометаллургическим способом и по комбинированной схеме. В настоящее время предпочтение отдают дистилляционному методу сепарации губки. Дистилляция исключает возможность окисления порошка титана и поглощения водорода, неизбежных при гидрометаллургической обработке. Отгонка магния и MgCl в вакууме основана на высоком давлении насыщенного пара этих веществ при повышенной температуре (табл. 28).
Таблица 28
Давление насыщенного пара магния и MgСl2; мм рт.ст.
| Температура, °С | Mg | MgCl2 | Температура, °С | Мg | MgCl2 |
| 700 | 5 | - | 900 | 80 | 8,0 |
| 750 | 12 | 1,9 | 100 | 250 | 80 |
| 800 | 25 | 2,2 | 1107 | 760 | 150 |
| 850 | 45 | 3,8 | 1412 | - | 760 |
Отгонку можно осуществлять как в аппарате восстановления, так и в отдельном аппарате. Аппарат для сепарации схематично показан на рис. 72. Головка реторты, подвергающаяся нагреванию в печи, изготовляется из нержавеющей стали толщиной 13 мм; нижняя часть реторты, заключенная в охлаждаемую водой рубашку, - из малоуглеродистой стали. Реакционный стакан аппарата восстановления останавливают на подставке в опрокинутом положении. В том случае, если реакционную массу предварительно выбирают из реактора, куски несепазированной губки загружают в перфорированную корзину, по оси которой проходит также перфорированная труба, что облегчает испарение примесей. Примерные размеры корзины: диаметр 420, высота 610 мм, загрузка 100 кг губки.
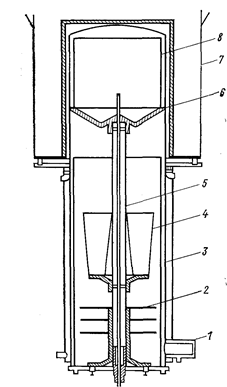
Рис. 72. Печь для дистилляции (Самсонов Г. В., Перминов В. П„ 1971, с. 103, рис. 28);
1 - вакуумное соединение; 2 - отражатели; 3 - охлаждаемая водой рубашка; 4 - резервуар для соли; 5 - опорная колонна; 6 - реторта; 7 – печь; 8 - восстановительный тигель.
Перед началом отгонки корзину устанавливают на решетчатой опорной плите и поднимают в верхнюю часть реторты из нержавеющей стали. Для предотвращения нагрева сконденсированных продуктов теплоизлучением из верхней зоны посредине реторты устанавливают стальные отражательные экраны. Верхняя часть реторты нагревается вакуумной электропечью, в зоне нагревателей которой создается вакуум для предохранения от смятия стенок реторты при нагреве. До включения обогрева в реторте вакуум 3.10-7 мм рт.ст., а в вакуумной печи - 2.10-4 мм рт.ст. В процессе нагрева вакуум в реторте обычно составляет 2.10-6мм рт.ст. Температура испарения 925° С. Процесс длится 48 ч. Время остывания реторты около 20 ч. Во время остывания производят откачку, а затем реторту заполняют сухим аргоном или гелием. Разгрузку производят при продувке реторты сухим аргоном.
Очищенную губку измельчают на щековой дробилке и просеивают через грохот с размером ячеек 12-13 мм. Средний расход энергии на дистилляцию 4,6 квт-ч на 1 кг рафинированной губки. Проведение процесса сепарации в отдельном аппарате сопряжено с соприкосновением губки с воздухом и частичным окислением. Для повышения качества металла разработаны процессы сепарации в аппарате восстановления. Получаемая титановая губка содержит обычно: 0,03-0,15% О; 0,01-0,04% N; 0,02-0,15% Fe; около 0,002-0,005% Н; 0,02-0,12% С1; 0,01-0,05% Si; 0,01-0,03% С; около 0,01% А1; 0,01% Ni и др. Твердость губки по Бриннеллю колеблется от 90-100 до 160-180 кгс/мм2, а в отдельных случаях до 200-220 кгс/мм2.
Обычно центральная часть блока губки получается наиболее качественной, гарниссажная губка и губка низов содержат больше примесей и более тверды. Еще хуже качество губки, соприкасающейся со стенками реактора.
Стоимость энергии и трудовые затраты на переделе восстановления и очистки титана составляют примерно 25% стоимости получаемой титановой губки, стоимость исходного TiCl4 - около 30% стоимости губки.
В настоящее время ведутся большие работы по созданию непрерывного процесса получения титана магниетермическим методом. Главное осложнение при осуществлении непрерывного процесса - трудность непрерывного вывода продуктов реакции из реакторов из-за приваривания титана к стенкам.
Можно осуществить подачу жидкого восстановителя в реактор, вдувая его с помощью аргона. TiCl4 подается в парообразном виде. Возможна подача обоих компонентов реакции в виде пара. Иногда жидкий восстановитель подается в виде капель, которые реагируют с TiCl4 и образуют гранулы реакционной массы, выводящиеся из зоны реакции.
По одному из способов жидкий магний нагревают в испарителе до 1043° С (при этом давление его насыщенного пара достигает 400 мм рт. ст). Аргон, нагретый до 800° С и с высокой скоростью пропускаемый через испарительную камеру, подает в реактор пары магния сверху. Расплавленный магний имеет постоянную поверхность, что при постоянной температуре позволяет регулировать скорость испарения количестом пропускаемого аргона. TiCl4 поступает из испарительной камеры, обогреваемой газовой горелкой, в трубопровод, конденсируется, во второй испаритель, где мгновенно испаряется, и с высокой скоростью через сопло, направленное вниз, поступает в реактор. Продукты реакции поступают в зону охлаждения и затем в циклон.
По другому методу капли жидкого восстановителя подаются в кипящий TiCl4, находящийся все время во вращении для предотвращения приваривания частиц титана к стенкам реактора. При этом состав гранул, спускающихся на дно реактора по мере увеличения содержания титана, следующий: 79% MgCl2, 1% Mg, 19-20% Ti, 0,5-1,5% низших соединений титана. Наилучшее использование магния достигается при диаметре капель 2-5 мм.
В настоящее время можно считать решенной проблему непрерывного ввода в реактор восстановителя и TiCl4, однако технология, обеспечивающая непрерывный вывод продуктов реакции, еще требует детальной разработки.
Восстановление TiCl4 натрием
До 1955 г. магниетермический способ восстановления TiCl4 был единственным промышленным способом, получившим широкое распространение. Главным недостатком этого способа является его периодичность.
Применение натрия дает возможность снизить температуру восстановления. В этих условиях непрерывный процесс представляется более осуществимым. Если процесс восстановления магнием достигает заметной скорости при температуре выше 750° С, то в случае натриетермического восстановления процесс идет с заметной скоростью уже при 200° С, а приемлемая для промышленных целей скорость достигается при температуре 500-700° С. При такой температуре можно избежать сваривания титана со стенками реактора, что является главным препятствием к осуществлению непрерывного процесса.
Восстановление TiCl4 натрием можно в принципе осуществить по трем вариантам:
1) при температуре ниже точки плавления NaCl (800° С);
2) в интервале 800-880° С - ниже температуры кипения металлического натрия;
3) выше температуры кипения натрия (в газовой фазе).
Третий вариант связан с трудностями, главная из которых - зарастание впускного отверстия форсунок для подачи парообразного металла продуктами реакции. В этих условиях получается мелкодисперсный титан, который трудно отделить от хлорида металла-восстановителя. Аналогичные трудности возникают, если использовать в качестве восстановителя парообразный магний.
Второй вариант неудобен из-за очень узкого интервала рабочей температуры. Реакция восстановления экзотермична, и трудно предотвратить местные перегревы.
Первый вариант представляет наибольший интерес. Получающаяся в результате реакции смесь легче поддается гидрометаллургической обработке, чем реакционная масса после восстановления магнием. Обладающий низкой температурой кипения натрий легко отогнать из реакционной массы в вакууме или же перевести в раствор выщелачиванием аммиачной водой. Коэффициент использования натрия в процессе восстановления значительно выше, чем при работе с магнием, поэтому содержание металла-восстановителя в реакционной массе меньше.
Более низкая температура плавления натрия облегчает очистку и подачу восстановителя в жидком виде в реактор:
TiCl4 + 4Na = Ti + 4NaCl - 209800 кал;
TiCl4 + 2Mg = Ti + 2MgCl2 - 123 400 кал.
Количество тепла, выделяющегося при натриетермическом восстановлении (750 кал на 1 г шихты), выше, чем в случае использования магния (в расчете на единицу массы восстановленного титана), что приводит к необходимости отвода тепла и препятствует ведению процесса с высокой скоростью. Объем образующихся продуктов реакции больше объема продуктов магниевого процесса. Все это снижает удельную производительность реакторов при восстановлении натрием (по сравнению с магниетермией).
Расход энергии при электролизе натрия составляет 14 квт-ч/кг, а магния 20 квт-ч/кг. Однако расход натрия при восстановлении больше, чем магния, поэтому и расход энергии на восстановитель в этом случае на 25% выше. Кроме того, 90 % MgCl2, получающегося при восстановлении, используют для электролиза и возврата металла-восстановителя, что значительно снижает стоимость магния. NaCl - весьма дешевый продукт, поэтому его возвращение на электролиз не может существенно сказаться на стоимости восстановителя. Однако замена вакуумной сепарации губки после магниетермического восстановления не требующим больших капитальных затрат выщелачиванием сказывается на стоимости получаемого титана и в ряде случаев делает натриетермический процесс более выгодным. В настоящее время в Англии и США работают заводы, использующие натриетермию. На некоторых заводах процесс восстановления осуществляется но непрерывной схеме.
По одному из способов восстановление идет при температуре, близкой к температуре плавления NaCl. В закрытый реактор, наполовину заполненный твердым NaCl, подают TiCl4 и жидкий натрий (с избытком 1 % сверх стехиометрического). Образующаяся реакционная масса, состоящая из NaCl и титана, непрерывно перемешивается и постепенно выводится из реактора и затем охлаждается. Получающийся губчатый титан имеет чистоту 99,5%. Низкая температура реакции обусловливает образование мелкого порошка титана. С целью укрупнения кристаллов реакционную массу перед выпуском нагревают несколько выше 800° С и выдерживают при этой температуре непродолжительное время. При этом порошок превращается в губку. Перед выщелачиванием NaCl значительная часть его обычно выплавляется с возвратом на электролиз. Оставшаяся реакционная масса выщелачивается.
По другому способу TiCl4 восстанавливается .амальгамой натрия, которая получается в результате электролиза расплава NaCl с ртутным катодом. Титан отделяется от ртути перегонкой в вакууме. Металлический натрий в амальгаме дешевле и более чист.
Присутствие в реакционной массе низших хлоридов вредно лз-за возможности их гидролиза:
6 TiCl2 + бН2О « 4 TiCl3 + 2Ti(OH)3 + 3H2;
ТiСl3 + ЗН2О « 2Ti(OH)3 + 3HСl.
Поэтому выщелачивание целесообразно вести подкисленным раствором (0,5% кислоты):
TiCl3 + ЗНNO3 « 3HCl + Ti(NO3)3;
2TiCl3 + ЗН2SО4 « 6HCl + Ti2(SO3)3;
При этом образуются растворимые соли, удаляющиеся при выщелачивании, и губка не загрязняется кислородом.
Полученную титановую губку сушат при температуре несколько выше 100° С. Для предотвращения окисления необходима герметизация сушильных аппаратов. При строгом соблюдении условий выщелачивания порошок можно прессовать в электроды для переплавки в дуговых печах без дополнительной дегазации.
Восстановление TiO2 кальцием
Порошкообразный титан можно получить восстановлением двуокиси титана кальцием по реакции
ТiO2 + 2Са « Ti + 2СаО + 25,4 ккал.
Температура процесса 1000° С. При этом разница в сродстве кальция к кислороду (DG° = -124 ккал} и титана к кислороду (DG° = -118 ккал) составляет всего 6 ккал. Поэтому для обеспечения быстрого протекания реакции надо создать большой избыток восстановителя (25-50%) над теоретически необходимым количеством. Выделяющегося тепла недостаточно для поддержания необходимой температуры. При температуре процесса кальций находится в жидком состоянии, а давление его насыщенного пара высокое (11 мм рт.ст. при 1000° С), что обеспечивает хороший контакт восстановителя с ТiO2. Последнюю загружают в реактор в виде порошка, кальций - в виде мелких кусочков или стружки. К кальцию предъявляют высокие требования по чистоте, так как он может поглощать из воздуха азот и углекислоту, которые переходят в восстановленный титан. Перед восстановлением кальций обычно очищают дистилляцией.
Восстановление проводят в герметическом реакторе (бомбе) из нержавеющей стали. Реактор после загрузки шихты и откачки воздуха заполняют аргоном. Во избежание повышения давления при разогреве во время реакции к реактору через открытый патрубок присоединяют резиновый буферный баллон с аргоном. Крышка реактора должна обогреваться, чтобы предотвратить конденсацию на ней паров кальция. Чтобы обеспечить контакт между компонентами, шихту брикетируют. Реактор выдерживают около часа при 1000-1100° С. Затем его удаляют из печи, и после остывания выгружают застывший солевой плав. Для отделения порошка титана от СаО и избытка кальция реакционную массу обрабатывают большим количеством H2O и затем слабой кислотой. Получающийся мелкий порошок титана (2-3 мкм) в процессе выщелачивания заметно окисляется. Более крупные кристаллы титана (100 мкм} получают, добавляя в шихту CaCl2 (в количестве, равном по массе образующейся СаО). При 1000° С СаО частично растворяется в расплаве CaCl2 и прослойка твердой СаО, мешающая росту кристаллов титана, не образуется. Кроме того, в расплаве CaCl2 частично растворяются металлический кальций (при 1000°С около 25%) и TiO2. Реакция восстановления при этом протекает в растворе:
ТiO2 + 2СаСl2 = TiCl4 + 2СаО;
TiCl4 + 2Са = Ti + 2СаСl2.
Получающийся металл загрязнен кислородом.
Восстановление Т iO2 гидридом кальция
В промышленности получил применение процесс восстановления двуокиси титана гидридом кальция с получением гидрида титана:
ТiO2 + 2СаН2 = TiH2+ 2СаО + Н2
с последующим разложением гидрида титана на водород и титан.
Гидрид кальция получают прокаливанием кусков металлического кальция в чистом сухом водороде при 400-600° С. Он представляет собой хрупкое солеподобное соединение ионного типа, легко измельчающееся в порошок. СаН2 легко разлагается водой:
СаН2 + 2Н2О = Са (ОН)2 + 2Н2,
поэтому при шихтовании с ТiO2 следует принимать меры, предотвращающие попадание влаги. Для уменьшения скорости разложения гидрид не следует измельчать до мелкого порошка.
Получающийся порошкообразный гидрид титана (3-5 мкм) вследствие большой коррозионной стойкости по сравнению с чистым металлом окисляется при промывке и сушке в меньшей степени.
Восстановление производят в реторте из стали при температуре 1100° С. После эвакуации реторту заполняют водородом. Спек, состоящий из смеси порошка титана и СаО, вымывают водой из реторты, в которой происходило восстановление. СаО выщелачивают слабым раствором НСl. Титановый порошок отфильтровывают, сушат, прессуют и подвергают спеканию в печи с индукционным нагревом при 1400-1450° С и давлении 10-3 мм рт. ст.
В отмытом порошке гидрида содержится около 0,5% кислорода в виде пленок окислов. Однако при спекании в вакууме брикетов, спрессованных из порошка гидрида, происходит, по-видимому, частичное восстановление пленок окислов выделяющимся в результате диссоциации гидрида атомарным водородом. Получающийся компактный металл содержит меньшее по сравнению с исходным порошком гидрида количество кислорода и следы водорода.
Дата: 2019-03-05, просмотров: 626.