Глава 9
МЕТАЛЛОТЕРМИЯ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Металлотермия - это процесс восстановления металлов из их соединений другими металлами, химически более активными, при повышенной температуре. Иногда сюда включают также процессы восстановления неметаллами.
Многие редкие элементы впервые получены и производятся в настоящее время в больших масштабах металлотермическим методом, который отличается относительной простотой процессов и технологического оборудования. Основоположником металлотермии был русский ученый Николай Николаевич Бекетов (1827—1911).
При разработке высокотемпературных химико-технологических процессов обычно производят предварительную оценку вероятности протекания тех или иных реакций, а также соотношения продуктов реакции и исходных веществ в состоянии равновесия - константы равновесия.
Реакцию металлотермического восстановления в общем виде можно представить уравнением
MeX’ + Me'' « Me''X + Me’ + DH, (67)
где Х - анион; DH - тепловой эффект.
Протекание реакции в сторону образования продуктов (восстановление Me’) возможно при условии
DGo = (DGoT, Me''X - DGoT, Me'X) <0,
где DGoT, Me'X - энергия Гиббса реакций образования соединений МеХ из элементов при температуре реакции. Обычно считается, что в случае, когда G°T>0, реакция не идет. Однако, принимая во внимание уравнение (3), легко видеть, что Кр всегда больше нуля и при контакте исходных веществ (Me'X + Me") в любом случае получается какое-то количество продуктов реакции (минимальное для DGoT >0). Если при этом возможно осуществление процесса с отводом восстанавливаемого металла (восстановление летучего металла в вакууме), реакция протекает достаточно полно даже в случае положительного значения DGoT, и возможность технологического ее осуществления определяется в основном экономическими соображениями.
Сдвиг величины DG в нужную сторону можно осуществить, если обеспечивается связывание образующегося продукта (Me''X), например его отшлакование. Иногда для этой цели в исходную смесь специально вводят вещество, образующее устойчивые легкоплавкие соединения nMe'''X.mMe''X.
Изменение энергии Гиббса вычисляют обычными методами по уравнению (6). Для приближенной оценки возможности протекания реакции восстановления удобно пользоваться диаграммами (рис. 65-67), на которых приведены значения энергии Гиббса реакций Ме + Х ® МеХ.
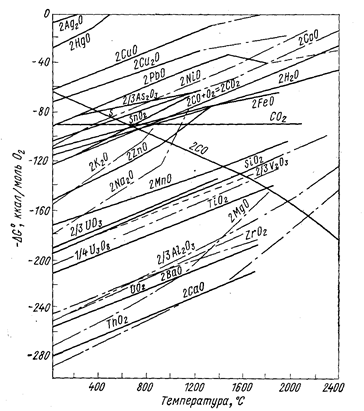
Рис. 65. Зависимость энергии Гиббса образования окислов металлов из элементов от температуры (Вольский А. А., Сергиевская Е. М., 1968, с. 251, рис. 122).
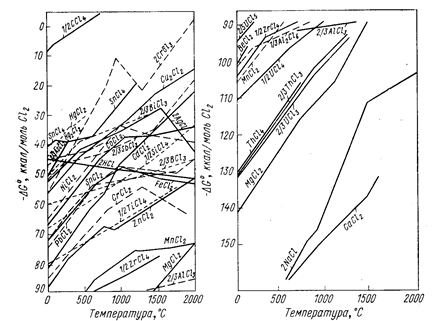
Рис. 66. Зависимость энергии Гиббса образования хлоридов из элементов от температуры (Вольский А. Н., Сергиевская Е. М., 1968, с. 256- 257, рис. 126).
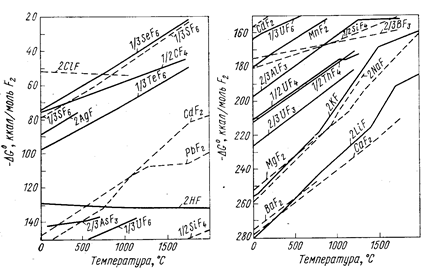
Рис. 67. Зависимость энергии Гиббса образования фторидов из элементов от температуры (Вольский А. Н.. Сергиевская Е. М., 1968, с. 267, рис. 130).
Чем больше по абсолютному значению DG° образования данного соединения, тем более оно устойчиво и тем сильнее восстановительная способность металла, входящего в это соединение. Все значения энергии Гиббса образования (см. рис. 65-67) рассчитаны не на моль образующегося соединения, а на моль газа, принимающего участие в реакции, например, по уравнениям:
½ Ti + Fa ® ½ TiF4;
Mg + F2 ® MgF2
и т. п., что делает их сопоставимыми.
Практически во всех случаях абсолютное значение DG° с повышением температуры уменьшается, что говорит об уменьшении прочности соединений, стремлении их к диссоциации.
Зависимость DG° от температуры имеет вид степенного ряда, однако кривые приведенных диаграмм приближаются к прямым в тех пределах, где отсутствуют фазовые превращения металла или соли. В точках плавления, кипения и аллотропического перехода эти прямые претерпевают излом и приобретают другой наклон. Принимая в первом приближении величину DG° не зависящей от температуры, легко показать, что угловой коэффициент каждого участка, прямой приблизительно равен отрицательному значению изменения энтропии: ∂(DG°)/∂T = -DS°. В соответствии с закономерностями изменения энтропии системы прямая претерпевает излом вверх при фазовом превращении металла и вниз при превращении соединения. Изломы резче всего в точках кипения (из-за резкого изменения энтропии системы при образовании газовой фазы). В точках полиморфного превращения изломы незначительны.
Определенность понятий металл-восстановитель и восстанавливаемый металл относительна, так как после пересечения кривых зависимости DG° от Т элементы меняются местами и реакция идет в сторону вытеснения металла, который до пересечения являлся восстановителем. В пределах твердого и жидкого состояний металлов и их соединений угловые коэффициенты прямых чаще всего близки и они почти не пересекаются. Следовательно, вплоть до точек кипения металлов и их солей повышение температуры редко изменяет последовательность вытеснения одних металлов другими. Но последовательность, часто изменяется при температуре выше точки кипения.
Кривая изменения энергии Гиббса при образовании СО (см. рис. 65) имеет обратный наклон по отношению к другим кривым, поэтому углеродом при достаточно высокой температуре можно восстановить практически все металлы из окислов (табл. 24), однако, к сожалению, при этом чаще получаются стойкие карбиды, а не чистые металлы.
Положение кривых рис. 65-67 определяет также возможность рафинировки металлов избирательным образованием соединений металлов-примесей с последующим их отшлакованием. Действительно, металлы-примеси, обладающие большими абсолютными значениями DG° образования, например, окислов, могут быть переведены в шлак избирательным окислением. Возможно удаление, например, Са и Mg из Al-сплавов продуванием кислорода, однако удаление Zr, Ti и др. таким путем осуществить не удается, так как сначала должен образоваться окисел очищаемого металла. Расположение кривой для АlСl3 показывает термодинамическую невозможность удаления из алюминиевых сплавов примесей титана избирательным хлорированием. Данные диаграмм DG° = f(T) определяют также возможность применять добавки одних металлов для «раскисления» (удаления вредных примесей) других.
Таблица 24
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ
Получение лития
В настоящее время основной промышленный способ получения металлического лития - электролиз. Однако определенные недостатки этого процесса заставляют искать другие методы получения металла. В литературе описаны лабораторные опыты по металлотермическому восстановлению лития: восстановление гидроокиси лития магнием в железной реторте с последующей отгонкой металла. При этом литий содержал много магния и гидрида.
Делались попытки восстановить LiCl кальцием. Получавшийся металл содержал 3—4% Са.
Для получения лития особой чистоты может быть применен процесс восстановления хромата лития порошкообразным цирконием:
2Li2CrO4 + Zr ® 4Li + Zr (CrO4)2.
Реакционную смесь прессуют и загружают в аппарат. Восстановление проводят в вакууме при 450-600° С. Образовавшийся литий отгоняют при 1000° С. Выход металла при этом невелик. В более поздних работах делались попытки применить вакуумное металлотермическое восстановление LiF, LiCl, Li2O магнием, алюминием и кремнием. При этом реакционную смесь в виде брикетов загружают в вакуумную реторту. Остаточное давление в реторте обычно l0-3 мм.pт.cт. В качестве продуктов реакции восстановления получается моноалюминат или ортосиликат лития. Для предотвращения связывания лития в моноалюминат в шихту вводят СаО. В этом случае реакция восстановления описывается уравнениями:
3Li2O + СаО + 2А1 ® CaO.Al2O3 + 6Li
или
3Li2O + СаО + Si ® 2CaO.SiO2 + 4Li
Металл, полученный по второй реакции, содержал 0,01% Si,. 0,01 % A1 и 0,04% Са; выход составлял 81-84%.
Исследовали процесс восстановления алюмината лития порошком алюминия в вакууме 0,1-0,5 мм рт.ст. при 1150-1200° С. Выход металлического лития достигал 90%. Таким методом получают металлический литий достаточно высокой чистоты. Анализ зависимости энергии Гиббса соединений, принимающих участие в реакциях восстановления лития, от температуры показывает, что для большинства восстановителей реакцию удается осуществить лишь благодаря большой летучести лития (удалению его из сферы реакции и сдвигу тем самым равновесия. Величина DG° для соединений лития мало отличается от DG° для соединений металлов-восстановителей (Mg, Са). Поэтому литий можно получить лишь вакуумной металлотермией.
Исходными продуктами для металлотермического способа восстановления лития являются карбонат (после его термического разложения до окиси) или гидроокись лития, т. е. продукты большинства схем переработки рудных концентратов. Литий получают достаточно чистым непосредственно из технических солей. Однако этот способ получения металлического лития до настоящего времени находится в стадии лабораторных разработок.
Большой интерес представляют работы по получению лития непосредственно из сподумена восстановлением ферросилицием или алюминием. Описаны также попытки использовать магний для восстановления сподумена. Восстановление измельченного сподумена проводят в реторте из жаростойкой стали при 1050-1100°С и вакууме 0,61-0,02 мм рт.ст. В шихту вводят также известь (СаО). Извлечение достигает 85%. Получающийся литий загрязнен магнием, натрием и калием (которые попадают в конденсируемый металл из извести и исходного сподумена). Прямое восстановление лития из сподумена имеет некоторые преимущества, однако при этом невозможно получить чистый металл. Вакуумная разгонка чернового металла сильно удорожает продукт, сводя на нет выгоды прямого процесса. Кроме того, малое содержание лития в брикетах требует значительного избытка восстановителя.
Получение лития металлотермическим способом имеет следующие преимущества перед электролизом: возможность использования карбоната или гидроокиси в качестве исходных соединений и получение лития, свободного от натрия и калия, непосредственно из технических солей.
Получение титана
Особенности металлургии титана связаны с его способностью поглощать газы при повышенной температуре и взаимодействовать с материалом реакторов. Многовалентность титана и образование ряда соединений низшей валентности также определяют специфику процесса.
С термодинамической точки зрения осуществимо восстановление титана из окислов атомарным водородом, однако использование метода ограничивается серьезными техническими трудностями, а также возможностью образования гидрида.
Зависимость от температуры lgK реакции
TiO2 + 2СО = Ti + 2CO2
(lg K = -18300/T +0,612) показывает, что даже при 3000° К lgK = - 5,49. Для процесса восстановления двуокиси титана углеродом с выделением СО lgК = 0,98 при 2000° К, однако одновременно с металлом при этом образуется карбид. Восстановление карбидом кальция невозможно не только из-за образования карбида, но и вследствие образования титаната кальция, восстанавливающегося труднее, чем двуокись титана. При сравнительно низкой температуре с достаточной полнотой протекает реакция
TiO2 + 2СаН « Ti + 2СаО + H2 - 7200 кал;
lg K = -1575/T + 12,41
Однако практического применения этот метод не нашел.
В качестве восстановителей двуокиси (в соответствии с зависимостью DG° от температуры) можно использовать Аl, Mg, Ca, Zr, Be. Два последних металла не применяют по экономическим соображениям.
Реакция восстановления TiO2 алюминием и магнием описывается уравнениями:
З TiO2 + 4А1 = 2А12О3 + 3Ti - 143 000 кал;
TiO2 + 2Mg = 2MgO + Ti - 69 000 кал.
Практическое осуществление этих процессов наталкивается на некоторые трудности. При восстановлении магнием образуется TiO, а не металлический титан. Для успешного проведения процесса необходимо повысить температуру до более 1000° С, что неприемлемо из-за взаимодействия металлического титана при этой температуре с материалом реактора. Алюминий образует с титаном сплав, удаление восстановителя из которого затруднено. Кроме того, получающийся металл содержит повышенное количество кислорода.
Восстановление TiCl4 магнием
В промышленной практике широко используют восстановление хлоридов титана. Восстановление TiCl4 металлами осуществляется в крупномасштабном производстве, поэтому выбор подходящего восстановителя определяется не только термодинамическими данными, но также соображениями экономики и технической осуществимости. Наиболее интересны с этой точки зрения реакции, перечисленные в табл. 27.
Таблица 27
Уравнения для расчета изменения энергии Гиббса реакции восстановления металлами
| Реакция | Уравнение энергии Гиббса, кал |
| ½ TiCl4 + 2Na = 2NaCl + ½ Ti | - 110 200 + 28 Т |
| ½ TiCl4 + Ca = CaCl2 + ½ Ti | - 94 200 + 15,9Т |
| ½ TiCl4 + Mg = MgCl2 + ½ Ti | - 66 800 + 22Т |
| ½ TiCl4 + ⅔Al = ⅔ AlCl3 + ½ Ti | - 9600 + 12, ЗТ |
В промышленности широкое распространение получили процессы восстановления магнием и натрием. Для восстановления TiCl4 алюминием требуется более высокая температура. Этот процесс осложнен также образованием сплава Ti-Al.
Способ магниетермического восстановления TiCl4 - основной в технологии титана. Достаточно сказать, что при проектировании всех заводов в СССР принят этот способ производства металлического титана. Приемлемый для промышленного производства способ получения титана магниетермическим восстановлением впервые был предложен Кроллем в 1940 г., причем первый аппарат Кролля был рассчитан на получение менее 300 г металла за цикл. Советский Союз по производству титана вышел на одно из первых мест в мире. В нашей стране созданы аппараты, позволяющие за один цикл получать 1,5-2 т титановой губки («Редмет-500», «Редмет-501»)
Для реакции
½ TiCl4 + Mg = MgCl2 + ½ Ti
выражение для константы имеет вид
Kp = 1/ [pTiCl4.p2Mg]
При избытке магния pMg = const и определяется температурой проведения реакции. Зная pMg и рассчитывая Кр реакции по уравнению (13), легко определить равновесное давление пара TiCl4, или, иными словами, полноту протекания процесса. Так, принимая для 800° С DGo » 80 ккал, имеем lg Kp = 80000/[4,57.1053] » 16. При избытке магния (800° С) pMg = 0,04ат: pTiCl4 =1/ p2MgKp = 1/ 0,042.1016 = 6,25.10-14 ат.
В реакционной системе кроме основной реакции восстановления могут протекать и другие реакции:
А. 2TiCl4 + Mg = 2ТiО3 + MgCl2 (I);
TiCl4 + Mg = ТiCl2 + MgCl2 (II);
TiCl4 + 2Mg = Ti + 2MgCl3 (III);
2TiCl3 + Mg = 2 TiCl4 + MgCl2 (IV);
2/зTiCl3 + Mg = 2/з Ti+MgCl2 (V);
TiCl2 + Mg = Ti + MgCl2 (VI);
Б. TiCl4 + Ti = 2TiCl2 (VII);
2TiCl4 + 2 TiCl2 = 4TiCl3 (VIII);
2TiCl4 + ⅔Ti = 8/3TiCl3 (IX);
2TiCl3 + Ti = 3TiCl2 (X);
B. 2TiCl4 + 2Mg = 2TiCl3 + 2MgCl (XI);
2TiCl4 + 2MgCl = 2TiCl3 + 2MgCl2 (XII);
2ТiСl3 + 2Mg = 2TiCl2 + 2MgCl (XIII);
2ТiСl3 + 2MgCl = 2TiCl2 + 2MgCl2 (XIV);
TiCl2 + 2MgCl = Ti + 2MgCl2 (XV);
Все возможные реакции разбиты на три группы: А - основные реакции - восстановление TiCl4 магнием до TiCl3, TiCl2, Ti, а также реакции довосстановления низших хлоридов; Б - вторичные реакции - взаимодействие TiCl4 с продуктами основных реакций, реакции диспропорционирования низших хлоридов; В - реакции с образованием субхлорида магния и его участием в качестве восстановителя.
При взаимодействии в конденсированных фазах термодинамически вероятны реакции (I-VI), а также (XI-XIII). Из вторичных процессов наиболее вероятна реакция (VII). Реакции (VIII) и (IX) характеризуются малой убылью энергии Гиббса, однако протекание их возможно, поскольку TiCl3 обладает высоким давлением насыщенного пара и может удаляться из сферы реакции.
В газовой фазе наиболее вероятны реакции первичного образования низших хлоридов TiCl2 и TiCl3; возможны также и вторичные реакции их образования.
Все реакции с участием субхлорида магния в качестве восстановителя характеризуются большой убылью энергии Гиббса, что может способствовать протеканию реакций его образования.
В настоящее время реакторы восстановления в промышленных условиях имеют диаметры от 850-1000 до 1300-1500 м.и при высоте от 1800-2000 до 3000 мм. Наиболее употребляемые материалы для их изготовления - малоуглеродистые, хромоникелевые стали, а также биметаллы.
Обычно используют два типа реакторов: с вставным реакционным стаканом и без стакана. Реакционный стакан предохраняет корпус реактора от проплавления и облегчает удаление реакционной массы, однако зазор между стенками стакана и аппарата резко ухудшает теплоотвод, уменьшает полезный объем аппарата. Вакуумируют реактор и подают в него TiCl4 и аргон через центральную трубу на крышке, MgCl2 сливают с помощью сифона или патрубков, расположенных сбоку или в центре днища. На рис. 69 приведена схема промышленного аппарата без стакана. Тепло от реактора отводят, как правило, охлаждая зону преимущественного протекания реакции воздухом. Охлаждающий воздух подают в нескольких точках по окружности печи. Вентиляторы включают и подают охлаждающий воздух с помощью автоматической системы.
Разнообразие возможных реакций определяет сложность установления истинного механизма протекания процесса восстановления. В настоящее время наибольшее распространение получило следующее описание процесса. Реакция происходит между жидким магнием и TiCl4 на поверхности губки, растущей у стенок аппарата, выше первоначального уровня восстановителя.
Магний к поверхности губки поднимается капиллярными силами по порам и покрывает ее поверхность пленкой. Процесс носит автокаталитический характер. Катализатором служит активная (не перекрытая хлористым магнием) поверхность губки. Предполагается, что молекулы TiCl4 проходят через стадию активированной адсорбции.
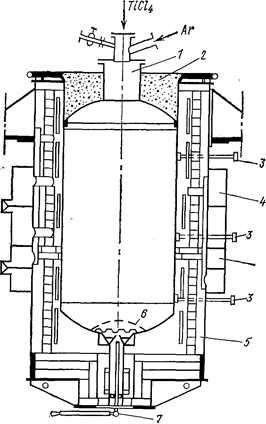
Рис. 69. Схема электропечи и реактора для восстановления магнием (Самсонов Г. В., Перминов В. П., 1971, с. 92, рис. 17):
1- реактор; 2 - крышка; 3 - термопары; 4 - воздушные коллекторы для подачи в печь охлаждающего воздуха; 5 - электропечь; 6 - перфорированное дно; 7 - запорное устройство.
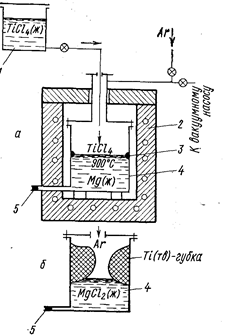
Рис. 70. Восстановление TiCl4 магнием (Вольский А. Н Сергиевская Е. М., 1968, с. 260, рис. 128):
а - начало процесса; б - конец процесса;
1- бачок с TiCl4; 2 - электропечь; 3 – место появления титановой губки; 4 - аппарат вос-становления; 5 - летка для выпуска расплава MgCl2.
Образующийся по реакции хлористый магний опускается под слой расплавленного магния (плотность MgCl2 1,68 г/см3, Mg 1,57 г/см3). Схематично рост губки в аппарате восстановления TiCl4, представлен на рис. 70. Плотность титана больше плотности MgCl2, и часть титана опускается на дно.
При высокой температуре TiCl4 реагирует с материалом реактора - железом. При этом получаются низшие хлориды и титаниды железа:
Fe + 2TiCl4 = FeCl2 + 2TiCl3;
Fe + TiCl4 = FeCl2 + TiCl2;
Fe + 2TiCl2 = FeTi + TiCl4;
Fe + 4TiCl3 = FeTi + 3TiCl4;
3Ti + 2FeCl2 = 2FeTi + TiCl4.
Побочные реакции загрязняют губку железом и низшими хлоридами. Часть низших хлоридов растворяется в хлористом магнии и довосстанавливается до титана магнием, также растворенным в MgCl2. Однако значительная часть образовавшихся низших хлоридов остается на поверхности губки, крышке и боковых стенках реактора. При демонтаже реактора низшие хлориды взаимодействуют с влагой воздуха и разлагаются с образованием окиси титана и НСl. Происходит также реакция диспропорционирования с образованием тонкодисперсного порошка металлического титана и паров TiCl4. Мелкодисперсный титан пирофорен и при выборке губки часто загорается. Пары TiCl4 портят вакуумное масло и насосы.
Большинство исследователей считают, что реакции в газовой фазе не имеют места или протекают в особых условиях (пониженные концентрации, начало процесса и т. п.).
В настоящее время из двух вариантов процесса: с догрузкой восстановителя и с единовременной загрузкой - предпочтение отдается последнему.
Представляет интерес разработка процесса восстановления TiCl4 магнием в условиях одновременной подачи исходных реагентов: магния и TiCl4. При этом могут создаться более благоприятные условия для реагирования.
Рассмотрим более подробно современную технологию. Реакционный стакан и реактор перед проведением процесса тщательно очищают (механическим способом, травлением соляной кислотой, металлическими щетками и обдувкой). Магний загружают в виде чушек, слитков или в расплавленном состоянии. Твердый магний перед загрузкой очищают от поверхностных пленок и шлаковых включений травлением в 0,5-1%-ном растворе НС1 с последующей промывкой водой. Загрузка в реактор проводится в «сухих комнатах». Для загрузки расплава применяют специальный вакуумный тигель-дозатор. Реактор перед установкой в печь восстановления вакуумируют и проверяют на герметичность, затем заполняют сухим инертным газом. В печи реактор разогревается до 400-600° С с одновременным вакуумированием. Затем его снова заполняют аргоном и разогревают до 650-760° С. При этой температуре давление инертного газа в реакторе снижают до 0,05-0,1 ат и подают TiCl4.
Вначале процесс восстановления протекает медленно - до появления на стенках реактора первых частиц титана. После этого процесс вступает в основную стадию. В процессе восстановления периодически производится слив MgCl2. В конце процесса восстановления после прекращения подачи TiCl4 для довосстановления низших хлоридов и более полного отделения MgCl2 делают 30-60-минутную выдержку при 900° С, после чего проводят последний слив MgCl2. Затем в аппарат подают аргон и охлаждают в печи до 800° С (если реактор изготовлен из нержавеющей стали) или до 600° С (из малоуглеродистой стали), чтобы избежать окисления поверхности реактора на воздухе. Дальнейшее охлаждение аппарата до 20-40° С проводят на специальном стенде с орошением его поверхности водой или обдувкой.
Реакционная масса состоит из 45-60% губчатого титана, 15-35% MgCl2 и 25-35% Mg. Содержимое аппарата восстановления высверливается на станке или удаляется с помощью отбойного молотка.
Предложено несколько режимов подачи TiCl4 в аппарат, однако лучшие показатели получены для режима стабильной максимально возможной скорости подачи в течение всего процесса. На рис. 71 показана схема автоматического регулирования процесса восстановления.
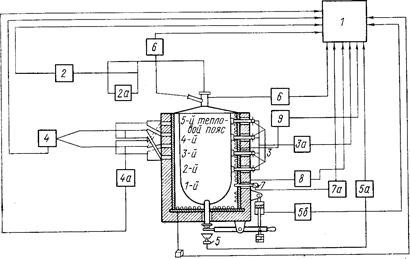
Рис. 71. Схема автоматического регулирования процесса восстановления (Самсонов Г. В., Перминов В. П., 1971, с. 70, рис. 14):
1- пульт программирования и сигнализация; 2 - расходомер TiCl4 с регулирующим клапаном 2а; 3 - термощупы для измерения температуры в зоне реакции с многопозиционным потенциометром За; 4 - вентилятор охлаждения печи с исполнительным механизмом переключения шиберов воздушного коллектора 4а: 5 - тензовесы с весомером 5а и клапаном 5б пневмоцилиндра привода устройства для слива хлористого магния; 6 - приборы регулирования давления аргона и TiCl4 в реакторе; 7 - термопара с потенциометром 7а для измерения температуры в нижней зоне реактора; 8, 9 -вольт-амперметры.
Титановую губку можно отделить от MgCl2 и магния дистилляцией в вакууме, гидрометаллургическим способом и по комбинированной схеме. В настоящее время предпочтение отдают дистилляционному методу сепарации губки. Дистилляция исключает возможность окисления порошка титана и поглощения водорода, неизбежных при гидрометаллургической обработке. Отгонка магния и MgCl в вакууме основана на высоком давлении насыщенного пара этих веществ при повышенной температуре (табл. 28).
Таблица 28
Давление насыщенного пара магния и MgСl2; мм рт.ст.
| Температура, °С | Mg | MgCl2 | Температура, °С | Мg | MgCl2 |
| 700 | 5 | - | 900 | 80 | 8,0 |
| 750 | 12 | 1,9 | 100 | 250 | 80 |
| 800 | 25 | 2,2 | 1107 | 760 | 150 |
| 850 | 45 | 3,8 | 1412 | - | 760 |
Отгонку можно осуществлять как в аппарате восстановления, так и в отдельном аппарате. Аппарат для сепарации схематично показан на рис. 72. Головка реторты, подвергающаяся нагреванию в печи, изготовляется из нержавеющей стали толщиной 13 мм; нижняя часть реторты, заключенная в охлаждаемую водой рубашку, - из малоуглеродистой стали. Реакционный стакан аппарата восстановления останавливают на подставке в опрокинутом положении. В том случае, если реакционную массу предварительно выбирают из реактора, куски несепазированной губки загружают в перфорированную корзину, по оси которой проходит также перфорированная труба, что облегчает испарение примесей. Примерные размеры корзины: диаметр 420, высота 610 мм, загрузка 100 кг губки.
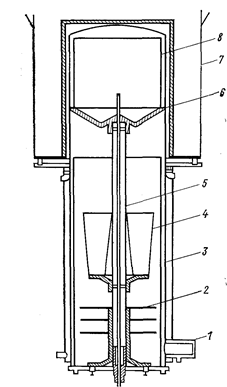
Рис. 72. Печь для дистилляции (Самсонов Г. В., Перминов В. П„ 1971, с. 103, рис. 28);
1 - вакуумное соединение; 2 - отражатели; 3 - охлаждаемая водой рубашка; 4 - резервуар для соли; 5 - опорная колонна; 6 - реторта; 7 – печь; 8 - восстановительный тигель.
Перед началом отгонки корзину устанавливают на решетчатой опорной плите и поднимают в верхнюю часть реторты из нержавеющей стали. Для предотвращения нагрева сконденсированных продуктов теплоизлучением из верхней зоны посредине реторты устанавливают стальные отражательные экраны. Верхняя часть реторты нагревается вакуумной электропечью, в зоне нагревателей которой создается вакуум для предохранения от смятия стенок реторты при нагреве. До включения обогрева в реторте вакуум 3.10-7 мм рт.ст., а в вакуумной печи - 2.10-4 мм рт.ст. В процессе нагрева вакуум в реторте обычно составляет 2.10-6мм рт.ст. Температура испарения 925° С. Процесс длится 48 ч. Время остывания реторты около 20 ч. Во время остывания производят откачку, а затем реторту заполняют сухим аргоном или гелием. Разгрузку производят при продувке реторты сухим аргоном.
Очищенную губку измельчают на щековой дробилке и просеивают через грохот с размером ячеек 12-13 мм. Средний расход энергии на дистилляцию 4,6 квт-ч на 1 кг рафинированной губки. Проведение процесса сепарации в отдельном аппарате сопряжено с соприкосновением губки с воздухом и частичным окислением. Для повышения качества металла разработаны процессы сепарации в аппарате восстановления. Получаемая титановая губка содержит обычно: 0,03-0,15% О; 0,01-0,04% N; 0,02-0,15% Fe; около 0,002-0,005% Н; 0,02-0,12% С1; 0,01-0,05% Si; 0,01-0,03% С; около 0,01% А1; 0,01% Ni и др. Твердость губки по Бриннеллю колеблется от 90-100 до 160-180 кгс/мм2, а в отдельных случаях до 200-220 кгс/мм2.
Обычно центральная часть блока губки получается наиболее качественной, гарниссажная губка и губка низов содержат больше примесей и более тверды. Еще хуже качество губки, соприкасающейся со стенками реактора.
Стоимость энергии и трудовые затраты на переделе восстановления и очистки титана составляют примерно 25% стоимости получаемой титановой губки, стоимость исходного TiCl4 - около 30% стоимости губки.
В настоящее время ведутся большие работы по созданию непрерывного процесса получения титана магниетермическим методом. Главное осложнение при осуществлении непрерывного процесса - трудность непрерывного вывода продуктов реакции из реакторов из-за приваривания титана к стенкам.
Можно осуществить подачу жидкого восстановителя в реактор, вдувая его с помощью аргона. TiCl4 подается в парообразном виде. Возможна подача обоих компонентов реакции в виде пара. Иногда жидкий восстановитель подается в виде капель, которые реагируют с TiCl4 и образуют гранулы реакционной массы, выводящиеся из зоны реакции.
По одному из способов жидкий магний нагревают в испарителе до 1043° С (при этом давление его насыщенного пара достигает 400 мм рт. ст). Аргон, нагретый до 800° С и с высокой скоростью пропускаемый через испарительную камеру, подает в реактор пары магния сверху. Расплавленный магний имеет постоянную поверхность, что при постоянной температуре позволяет регулировать скорость испарения количестом пропускаемого аргона. TiCl4 поступает из испарительной камеры, обогреваемой газовой горелкой, в трубопровод, конденсируется, во второй испаритель, где мгновенно испаряется, и с высокой скоростью через сопло, направленное вниз, поступает в реактор. Продукты реакции поступают в зону охлаждения и затем в циклон.
По другому методу капли жидкого восстановителя подаются в кипящий TiCl4, находящийся все время во вращении для предотвращения приваривания частиц титана к стенкам реактора. При этом состав гранул, спускающихся на дно реактора по мере увеличения содержания титана, следующий: 79% MgCl2, 1% Mg, 19-20% Ti, 0,5-1,5% низших соединений титана. Наилучшее использование магния достигается при диаметре капель 2-5 мм.
В настоящее время можно считать решенной проблему непрерывного ввода в реактор восстановителя и TiCl4, однако технология, обеспечивающая непрерывный вывод продуктов реакции, еще требует детальной разработки.
Восстановление TiCl4 натрием
До 1955 г. магниетермический способ восстановления TiCl4 был единственным промышленным способом, получившим широкое распространение. Главным недостатком этого способа является его периодичность.
Применение натрия дает возможность снизить температуру восстановления. В этих условиях непрерывный процесс представляется более осуществимым. Если процесс восстановления магнием достигает заметной скорости при температуре выше 750° С, то в случае натриетермического восстановления процесс идет с заметной скоростью уже при 200° С, а приемлемая для промышленных целей скорость достигается при температуре 500-700° С. При такой температуре можно избежать сваривания титана со стенками реактора, что является главным препятствием к осуществлению непрерывного процесса.
Восстановление TiCl4 натрием можно в принципе осуществить по трем вариантам:
1) при температуре ниже точки плавления NaCl (800° С);
2) в интервале 800-880° С - ниже температуры кипения металлического натрия;
3) выше температуры кипения натрия (в газовой фазе).
Третий вариант связан с трудностями, главная из которых - зарастание впускного отверстия форсунок для подачи парообразного металла продуктами реакции. В этих условиях получается мелкодисперсный титан, который трудно отделить от хлорида металла-восстановителя. Аналогичные трудности возникают, если использовать в качестве восстановителя парообразный магний.
Второй вариант неудобен из-за очень узкого интервала рабочей температуры. Реакция восстановления экзотермична, и трудно предотвратить местные перегревы.
Первый вариант представляет наибольший интерес. Получающаяся в результате реакции смесь легче поддается гидрометаллургической обработке, чем реакционная масса после восстановления магнием. Обладающий низкой температурой кипения натрий легко отогнать из реакционной массы в вакууме или же перевести в раствор выщелачиванием аммиачной водой. Коэффициент использования натрия в процессе восстановления значительно выше, чем при работе с магнием, поэтому содержание металла-восстановителя в реакционной массе меньше.
Более низкая температура плавления натрия облегчает очистку и подачу восстановителя в жидком виде в реактор:
TiCl4 + 4Na = Ti + 4NaCl - 209800 кал;
TiCl4 + 2Mg = Ti + 2MgCl2 - 123 400 кал.
Количество тепла, выделяющегося при натриетермическом восстановлении (750 кал на 1 г шихты), выше, чем в случае использования магния (в расчете на единицу массы восстановленного титана), что приводит к необходимости отвода тепла и препятствует ведению процесса с высокой скоростью. Объем образующихся продуктов реакции больше объема продуктов магниевого процесса. Все это снижает удельную производительность реакторов при восстановлении натрием (по сравнению с магниетермией).
Расход энергии при электролизе натрия составляет 14 квт-ч/кг, а магния 20 квт-ч/кг. Однако расход натрия при восстановлении больше, чем магния, поэтому и расход энергии на восстановитель в этом случае на 25% выше. Кроме того, 90 % MgCl2, получающегося при восстановлении, используют для электролиза и возврата металла-восстановителя, что значительно снижает стоимость магния. NaCl - весьма дешевый продукт, поэтому его возвращение на электролиз не может существенно сказаться на стоимости восстановителя. Однако замена вакуумной сепарации губки после магниетермического восстановления не требующим больших капитальных затрат выщелачиванием сказывается на стоимости получаемого титана и в ряде случаев делает натриетермический процесс более выгодным. В настоящее время в Англии и США работают заводы, использующие натриетермию. На некоторых заводах процесс восстановления осуществляется но непрерывной схеме.
По одному из способов восстановление идет при температуре, близкой к температуре плавления NaCl. В закрытый реактор, наполовину заполненный твердым NaCl, подают TiCl4 и жидкий натрий (с избытком 1 % сверх стехиометрического). Образующаяся реакционная масса, состоящая из NaCl и титана, непрерывно перемешивается и постепенно выводится из реактора и затем охлаждается. Получающийся губчатый титан имеет чистоту 99,5%. Низкая температура реакции обусловливает образование мелкого порошка титана. С целью укрупнения кристаллов реакционную массу перед выпуском нагревают несколько выше 800° С и выдерживают при этой температуре непродолжительное время. При этом порошок превращается в губку. Перед выщелачиванием NaCl значительная часть его обычно выплавляется с возвратом на электролиз. Оставшаяся реакционная масса выщелачивается.
По другому способу TiCl4 восстанавливается .амальгамой натрия, которая получается в результате электролиза расплава NaCl с ртутным катодом. Титан отделяется от ртути перегонкой в вакууме. Металлический натрий в амальгаме дешевле и более чист.
Присутствие в реакционной массе низших хлоридов вредно лз-за возможности их гидролиза:
6 TiCl2 + бН2О « 4 TiCl3 + 2Ti(OH)3 + 3H2;
ТiСl3 + ЗН2О « 2Ti(OH)3 + 3HСl.
Поэтому выщелачивание целесообразно вести подкисленным раствором (0,5% кислоты):
TiCl3 + ЗНNO3 « 3HCl + Ti(NO3)3;
2TiCl3 + ЗН2SО4 « 6HCl + Ti2(SO3)3;
При этом образуются растворимые соли, удаляющиеся при выщелачивании, и губка не загрязняется кислородом.
Полученную титановую губку сушат при температуре несколько выше 100° С. Для предотвращения окисления необходима герметизация сушильных аппаратов. При строгом соблюдении условий выщелачивания порошок можно прессовать в электроды для переплавки в дуговых печах без дополнительной дегазации.
Восстановление TiO2 кальцием
Порошкообразный титан можно получить восстановлением двуокиси титана кальцием по реакции
ТiO2 + 2Са « Ti + 2СаО + 25,4 ккал.
Температура процесса 1000° С. При этом разница в сродстве кальция к кислороду (DG° = -124 ккал} и титана к кислороду (DG° = -118 ккал) составляет всего 6 ккал. Поэтому для обеспечения быстрого протекания реакции надо создать большой избыток восстановителя (25-50%) над теоретически необходимым количеством. Выделяющегося тепла недостаточно для поддержания необходимой температуры. При температуре процесса кальций находится в жидком состоянии, а давление его насыщенного пара высокое (11 мм рт.ст. при 1000° С), что обеспечивает хороший контакт восстановителя с ТiO2. Последнюю загружают в реактор в виде порошка, кальций - в виде мелких кусочков или стружки. К кальцию предъявляют высокие требования по чистоте, так как он может поглощать из воздуха азот и углекислоту, которые переходят в восстановленный титан. Перед восстановлением кальций обычно очищают дистилляцией.
Восстановление проводят в герметическом реакторе (бомбе) из нержавеющей стали. Реактор после загрузки шихты и откачки воздуха заполняют аргоном. Во избежание повышения давления при разогреве во время реакции к реактору через открытый патрубок присоединяют резиновый буферный баллон с аргоном. Крышка реактора должна обогреваться, чтобы предотвратить конденсацию на ней паров кальция. Чтобы обеспечить контакт между компонентами, шихту брикетируют. Реактор выдерживают около часа при 1000-1100° С. Затем его удаляют из печи, и после остывания выгружают застывший солевой плав. Для отделения порошка титана от СаО и избытка кальция реакционную массу обрабатывают большим количеством H2O и затем слабой кислотой. Получающийся мелкий порошок титана (2-3 мкм) в процессе выщелачивания заметно окисляется. Более крупные кристаллы титана (100 мкм} получают, добавляя в шихту CaCl2 (в количестве, равном по массе образующейся СаО). При 1000° С СаО частично растворяется в расплаве CaCl2 и прослойка твердой СаО, мешающая росту кристаллов титана, не образуется. Кроме того, в расплаве CaCl2 частично растворяются металлический кальций (при 1000°С около 25%) и TiO2. Реакция восстановления при этом протекает в растворе:
ТiO2 + 2СаСl2 = TiCl4 + 2СаО;
TiCl4 + 2Са = Ti + 2СаСl2.
Получающийся металл загрязнен кислородом.
Восстановление Т iO2 гидридом кальция
В промышленности получил применение процесс восстановления двуокиси титана гидридом кальция с получением гидрида титана:
ТiO2 + 2СаН2 = TiH2+ 2СаО + Н2
с последующим разложением гидрида титана на водород и титан.
Гидрид кальция получают прокаливанием кусков металлического кальция в чистом сухом водороде при 400-600° С. Он представляет собой хрупкое солеподобное соединение ионного типа, легко измельчающееся в порошок. СаН2 легко разлагается водой:
СаН2 + 2Н2О = Са (ОН)2 + 2Н2,
поэтому при шихтовании с ТiO2 следует принимать меры, предотвращающие попадание влаги. Для уменьшения скорости разложения гидрид не следует измельчать до мелкого порошка.
Получающийся порошкообразный гидрид титана (3-5 мкм) вследствие большой коррозионной стойкости по сравнению с чистым металлом окисляется при промывке и сушке в меньшей степени.
Восстановление производят в реторте из стали при температуре 1100° С. После эвакуации реторту заполняют водородом. Спек, состоящий из смеси порошка титана и СаО, вымывают водой из реторты, в которой происходило восстановление. СаО выщелачивают слабым раствором НСl. Титановый порошок отфильтровывают, сушат, прессуют и подвергают спеканию в печи с индукционным нагревом при 1400-1450° С и давлении 10-3 мм рт. ст.
В отмытом порошке гидрида содержится около 0,5% кислорода в виде пленок окислов. Однако при спекании в вакууме брикетов, спрессованных из порошка гидрида, происходит, по-видимому, частичное восстановление пленок окислов выделяющимся в результате диссоциации гидрида атомарным водородом. Получающийся компактный металл содержит меньшее по сравнению с исходным порошком гидрида количество кислорода и следы водорода.
Восстановление окислов
Двуокись циркония восстанавливают кальцием, процесс начинается при 700° С и проходит полностью при 1000° С. При повышении температуры > 1100° С наблюдается спекание зерен, и получаемый порошок обладает меньшей пирофорностью. Избыток кальция сверх теоретически необходимого по реакции
ZrO2 + 2Са = 2СаО + Zr
составляет 10-50%.
Процесс осуществляют в герметически закрытом реакторе, в который послойно загружается ZrO2 (крупностью 0,175 мм} и и кальций в виде стружки (2х5х20 мм). Добавка CaClz может быть меньше, чем в случае восстановления титана, так как порошок циркония обладает большей коррозионной стойкостью и окисляется в меньшей степени, несмотря на мелкозернистость. Процесс следует проводить в вакууме либо в атмосфере инертного газа.
Восстановление ZrO2 гидридом кальция протекает в тех же условиях, что и восстановление титана.
Восстановление фторидов
Фториды имеют преимущество перед хлоридами вследствие их малой гигроскопичности. В настоящее время в промышленных масштабах производят тетрафторид циркония ZrF4 и фторцирконат калия K2ZrF6. Фториды циркония и гафния могут быть восстановлены натрием, кальцием, магнием и алюминием. Использование в качестве восстановителя кальция и магния приводит к образованию нерастворимых фторидов, в то время как NaF легко удаляется из реакционной смеси в результате обработки водой.
Теплоты реакции восстановления
K2ZrF6 + 4Na = Zr + 4NaF + 2KF
не хватает для самопроизвольного протекания процесса, поэтому для поддержания температуры реакции (800-900° С) необходим внешний подогрев.
Схема аппарата для натриетермического восстановления фторцирконата калия представлена на рис. 73. В толстостенный тигель вставлен реакционный цилиндр из нержавеющей стали. Готовят расплав, состоящий из смеси 90 кг K2ZrF6, 16,5 кг KCl и 16,5 кг NaCl. KC1 и NaCl добавляют для снижения температуры плавления смеси. Застывший расплав измельчают (до 1 мм} и засыпают в бункер. В реакционный сосуд заливают расплавленный натрий, повышают температуру до 800° С и из бункера подают смесь K2ZrF6+KCl+NaCl. Фторцирконат падает на поверхность расплавленного натрия, и образующиеся кристаллы металлического циркония опускаются на дно реактора. Жидкий натрий и расплавленные хлориды защищают образующийся металл от контакта с газом (обычно во время реакции аппарат заполняется водородом). В дальнейшем реакционную массу измельчают и выщелачивают водой. В результате реакции восстановления образуется большое количество солей, что приводит к формированию мелких кристаллов порошка циркония и его загрязнению кислородом. Содержание циркония в таком порошке 98-99%. Его используют в основном в военном деле (для различных взрывчатых и воспламеняющихся смесей), в пиротехнике и в электровакуумной технике (в качестве геттера).
-
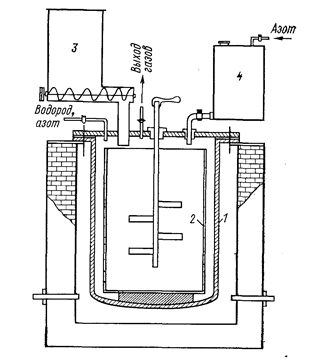
Рис. 73. Схема аппарата для натриетермического восстановления фторцирконата калия (Меерсон Г. А., Зеликман А. Н., 1955, с. 385, рис. 123):
1 - тигель; 2 - реактор; 3 - бункер; 4 - бачок с расплавленным натрием.
Представляет большой интерес получение слитка циркония непосредственно в печи для восстановления. В этом плане более перспективным представляется восстановление фторидов из-за более низкого давления насыщенного пара при высокой температуре и меньшей склонности к гидролизу.
Металлический кальций является самым эффективным восстановителем для тетрафторида и низших фторидов циркония. Учитывая возможность стадийного протекания процесса кальциетермического восстановления с образованием в качестве промежуточных продуктов низших фторидов циркония, можно предположить протекание следующих реакций:
ZrF4 + 2Са = Zr + 2CaF2; (I)
ZrF4 + ½ Са = ZrF3 + ½ CaF2; (II)
ZrF3 + 3/2 Са = Zr + 3/2 CaF2; (III)
ZrF3 + ½ Са = ZrF2 + ½ CaF2; (IV)
ZrF4 + Са = ZrF2 + CaF2; (V)
ZrF4 + Са = Zr + CaF2. (VI)
Значения теплового эффекта и энергии Гиббса реакций (I)-(VI) для интервала 298-1100° К представлены в табл. 30.
Таблица 30
Зависимость теплового эффекта и энергии Гиббса реакций (I) - (VI) от температуры
| реакция | Величина, ккал | Температура, К | ||||
| 298 | 500 | 800 | 1000 | 1100 | ||
| (I) | -DHoT -DGoT | 132,200 131,394 | 131,869 130,892 | 132,259 130,381 | 131,372 129,907 | 132,463 129,639 |
| (II) | -DHoT -DGoT | 51,450 49,826 | 51,516 48,697 | 51,594 47,008 | 51,447 45,977 | 51,391 45,317 |
| (III) | -DHoT -DGoT | 80,750 81,567 | 80,353 82,195 | 80,665 83,372 | 80,895 84,030 | 81,072 84,322 |
| (IV) | -DHoT -DGoT | 22,250 24,613 | 20,581 26,669 | 18,268 30,944 | 16,445 34,320 | 15,462 36,151 |
| (V) | -DHoT -DGoT | 73,700 74,440 | 72,097 75,366 | 69,862 77,953 | 67,922 80,197 | 66,852 81,468 |
| (VI) | -DHoT -DGoT | 58,500 56,954 | 59,772 55,526 | 62,397 52,428 | 64,450 49,710 | 65,611 48,171 |
Величина теплового эффекта свидетельствует о значительной экзотермичности реакций, а значения энергии Гиббса – o возможности протекания их во всем указанном температурном интервале.
Для получения слитка циркония необходим перегрев продуктов реакции на 200-250° С выше температуры плавления металлического циркония (2125° К). В табл. 31 приведено количество тепла, необходимое для нагрева продуктов реакций (I), (III), (VI) от 298 до 2400° К.
Таблица 31
Восстановление хлоридов
Восстановление хлоридов - основной метод металлотермического получения циркония и гафния. Тетрахлориды циркония и гафния - это кристаллические вещества, возгоняющиеся при повышении температуры (давление насыщенного пара ZrCl4 достигает 1 атм при 331oС, HfCl4 при 317°С). Для успешного проведения процесса восстановления хлорид должен быть очищен от примесей возгонкой.
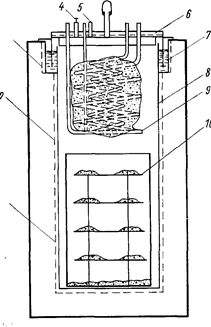
Рис. 74. Аппарат для сублимации тетрахлорида циркония (Технология редких и рассеянных элементов. Под ред. Большакова, 1969, с 465, рис. 126):
1-3 - нагреватели; 4 -клапан; 5 - трубка для откачки реторты: 6 - крышка реторты; 7 - гидравлический затвор из легкоплавкого сплава; 8 - реторта; 9 - змеевик, охлаждаемый водой; 10 – контейнеры.
Конструкция аппарата для возгонки тетрахлорида представлена на рис. 74. Реторту из нержавеющей стали, в которой происходит процесс очистки, помещают в шахтную электрическую печь. В печи имеются три независимые зоны нагрева: зона сублимации 1, зона конденсации 2 и зона уплотнения затвора 3. Крышка реторты установлена на желобе, заполненном сплавом свинец - сурьма (температура плавления 247° С) 7. Сплав можно расплавить при включении верхней зоны нагрева или заморозить (охлаждением воздухом или водой). Расплавленный Pb-Sb – затвор создает возможность сброса избыточного давления в реторте. Нормальная рабочая температура крышки и верхней зоны не выше 650° С, а средней и нижней - не выше 900° С.
На дно реторты устанавливают контейнеры, изготовленные из сплава инконель (состав сплава инконель X: 72,7% Ni, 15% Cr, 7% Fe, 1% Nb, 2,5% Ti, 0,7% Al, 0,7% Mn, 0,4% Si, 0,05% С). Контейнер представляет собой этажерку, на которую загружают неочищенный хлорид циркония. Реторту закрывают крышкой, которую погружают в предварительно расплавленный сплав Рb-Sb. Затем сплав замораживают, реторту эвакуируют, дважды заполняют водородом, нижнюю зону нагревают до 200° С, при этом удаляется остаточный SiCl4, а FеСl3 восстанавливается до малолетучего FeCl2. После этого свинцовый затвор расплавляют, температуру нижней зоны повышают до 450° С, возгоняя ZrCl4. Температуру крышки и стенок поддерживают выше температуры возгонки (чтобы избежать конденсации на них ZrCl4). Тетрахлорид осаждается только на охлаждаемом водой змеевике 9. Необходимо обеспечить равенство скорости возгонки и осаждения. По окончании процесса установку охлаждают до комнатной температуры. Аппарат размером 700 мм в диаметре и 1750 мм высотой позволяет очистить за один раз до 200 кг ZrCl4. Цикл длится до 30 ч. Хлорид на змеевике отличается большой плотностью. Большая часть примесей остается на «этажерке».
Затем крышку со змеевиком переносят в аппарат для восстановления, по конструкции аналогичной первому. На дне этого аппарата устанавливают никелевый тигель с ~20%-ньш избытком магния против теоретически необходимого. Над тиглем размещаются экраны, препятствующие передаче тепла излучением из одной зоны в другую, а также предотвращающие попадание на поверхность магния случайных брызг сплава Pb-Sb из затвора.
Реакцию восстановления хлоридов циркония и гафния можно представить в общем виде
MeCl4 (г.) + 2Mg (ж.) « Me (тв.) + 2MgCl2 (ж.).
При 827° С величины DH° и DG° для циркония равны -79,3 и -48,0 ккал, для гафния -55,4 и -25,2 ккал соответственно. Реакция восстановления хлорида гафния менее экзотермична, при его восстановлении применяют больший избыток магния (40-65% для восстановления HfCl4, 20-25% для ZrCl4).
Верхний предел температуры процесса восстановления определяется образованием Fe-Zr-эвтектики с температурой плавления 940° С. Кроме того, перегрев ведет к повышению давления пара магния и образованию мелкого пирофорного порошка циркония вследствие протекания реакции в газовой фазе. Поэтому нижняя зона нагрева сосуда восстановления обеспечивает температуру около 825° С, что несколько выше температуры плавления MgCl2. Сосуд для восстановления закрывают крышкой с грушей ZrCl4 и после расплавления и замораживания затвора эвакуируют его и заполняют аргоном. Магний в тигле нагревают до 825° С, а верхнюю зону, где расположена груша ZrCl4,—до 450-500° С, в результате хлорид циркония постепенно испаряется и его пары контактируют с расплавом магния. Скорость процесса можно регулировать скоростью испарения хлорида. Слишком высокая скорость приводит к перегреву реактора. Расплавленный магний находится на поверхности расплава MgCl2, а образующиеся кристаллы циркония опускаются на дно тигля. Стенки и крышка реактора во время процесса восстановления имеют температуру не ниже 450° С.
Процесс возгонки можно регулировать подачей в змеевик холодного воздуха. Процесс восстановления длится 4-5 ч. После этого температура нижней зоны поддерживается в течение одного часа около 920° С для укрупнения кристаллов циркония. При этом необходим строгий контроль за температурой, так как при 940° С губка загрязняется железом в местах соприкосновения со стенками тигля вследствие образования эвтектики Fe-Zr. При необходимости температуру снижают, вводя в реторту холодный инертный газ. По окончании восстановления реторту охлаждают, крышку снимают и тигель, содержащий циркониевую губку, MgCl2 и магний, удаляют из реторты. Возможно совмещение процессов возгонки и восстановления в одном аппарате. При этом если полный цикл раздельных операций очистки и восстановления продолжается 64 ч, то по совмещенному процессу продолжительность цикла 44 ч.
Следующей стадией процесса является отделение губки от MgCl2 и избытка магния. При гидрометаллургическом методе обработки губки металл содержит большое количество кислорода. В настоящее время используют метод вакуумтермической очистки в аппарате, конструкция которого в основном подобна .аппарату, представленному на рис. 72, В верхней части реторты помещают перевернутый тигель из аппарата восстановления. Затем при температуре выше 712° С выплавляют основную массу MgCl2, который стекает в резервуар для солей, расположенный в нижней части реактора. Дальнейшее повышение температуры верхней части реактора выше 900°С обусловливает отгонку магния и остатков MgCl2 в вакууме. Оставшаяся губка содержит обычно не более 0,02% Mg и 0,04% Cl.
Гафниевая губка более пирофорна, чем циркониевая. Прямое извлечение гафния при очистке технического хлорида составляет ~94%, при восстановлении 97%, при дистилляции ~96%.
Тетрахлорид циркония может быть восстановлен натрием (табл. 32). С термодинамической точки зрения процесс восстановления тетрахлоридов натрием более благоприятен, чем магнием. Недостатки и преимущества натриетермического метода имеют тот же характер, что и при восстановлении TiCl4.
Таблица 32
Тепловой эффект и энергия Гиббса реакции восстановления ZrCl4, HfCl4 натрием, ккал/моль
| toC | ZrCl4 | HfCl4 | ||
| -DHo | -DGo | -DHo | -DGo | |
| 327 | 164,1 | 152,5 | 165,0 | 127,0 |
| 527 | 187,5 | 137,7 | 163,3 | 114,6 |
| 727 | 156,0 | 120,3 | 132,2 | 97,5 |
| 927 | 246,7 | 115,4 | 223,8 | 92,7 |
| 1227 | 238,9 | 83,5 | 216,1 | 60,8 |
Для использования в ядерной технике цирконий должен содержать не более, 10-4 %: Cd - 0,5-1; Li и РЗЭ -1; Со - 20;. Ni - 2; Ti и Mn -50; Al - 75; Hf, С, Р и Si - 100; O - 800. В табл. 33 дано содержание примесей в цирконии, полученном различными методами (иодидный метод-см. ниже).
Таблица 33
Содержание примесей в цирконии, %
| Способ получения | O | N | C | Fe | Si | Al | Mn | Ca | Mg | C | ||
| Иодидный | 0,03 | 0,01 | 0,01-0,05 | 0,04 | 0,05 | следы | - | - | следы | |||
| ZrCl4+Mg | 0,08 | 0,04 | 0,08 | 0,2 | - | следы | ||||||
| Кальциетер-мический | 0,13 | 0,06 | - | - | - | - | - | - | - | - | ||
Осуществление непрерывного металлотермического процесса применительно к цирконию, по-видимому, ограничено решением тех же проблем, что и в аналогичном процессе титановой технологии. Наиболее перспективной в этом отношении следует считать натриетермию (см. соответствующий раздел металлотермии титана).
Восстановление галогенидов
До недавнего времени практически единственным промышленным методом разделения ниобия и тантала была фракционная кристаллизация комплексных фтористых солей - фтортанталата и фторниобата калия. Поэтому были разработаны методы получения металлов из этих солей. В основе процесса лежит реакция:
K2Nb(Ta)F7 + 5Na = Nb (Та) + 2KF + 5NaF.
Сухую комплексную соль и пластины натрия (взятого с 5-15%-ным избытком) загружают послойно в стальной стакан и смесь прессуют. Шихту засыпают сверху слоем сухого NaCl, который также уплотняют. Стакан с шихтой помещают в шахтную печь, нагревают до 1000° С и при этой температуре выдерживают в течение 1-1,5 ч. Солевой расплав предохраняет частицы металла от контакта с атмосферой, что позволяет проводить восстановление без инертного газа или вакуума.
Скорость процесса определяется испарением натрия и его растворением в расплаве солей (NaCl при 850°С растворяет около 20% Na). Избыток натрия конденсируется в слое NaCl, верхняя часть которого должна находиться в зоне печи с невысокой температурой. Восстановленную массу после остывания извлекают из стакана, дробят и обрабатывают сначала холодной, а затем горячей водой. При повышении щелочности (из-за растворения избыточного натрия) раствор нейтрализуют соляной кислотой, поскольку в щелочном растворе качество порошка ухудшается. Избыток кислоты тоже недопустим, так как образующаяся HF растворяет металл. Порошок отмывают до исчезновения реакции на ион фтора.
В дальнейшем порошок обрабатывают на холоду 10%-ной НNО3 или 5%-ным НСl при тв:ж=1:10 с перемешиванием в течение 4 ч, затем водой и 2,5%-ным HF при перемешивании в течение 5-15 мин и вновь водой. Обработка соляной или азотной кислотой снижает содержание примесей Ti, Si, Fe и др.
Плавиковая кислота растворяет окисные пленки на зернах металла и способствует уменьшению содержания кислорода. Отмытый порошок высушивают на воздухе при температуре не выше 120° С. Затем производят рассев на фракции различной крупности. Извлечение ниобия из фторниобата в порошок составляет 90%. Порошок содержит 99-99,4% (по массе) Nb+ Та; по 0,02-0,06% Ti, Si, Fe; 0,5% О; 0,09-0,15% С; 0,1-0,3% Pb; до 0,1% Ni; 0,003% S; 0,01% Р.
Аналогично ниобий получают восстановлением обезвоженного оксифторниобата калия.
В последние годы существенное внимание уделяется методу восстановления хлоридов тантала водородом. Пентахлориды ниобия и тантала очищают от железа восстановлением водородом при 300° С, после чего тантал отделяют предпочтительным восстановлением пентахлорида ниобия водородом при 500° С до трихлорида ниобия. Последний восстанавливают водородом при 600-1000° С до порошка металла. Процесс осложняется склонностью высших хлоридов к гидролизу (с разложением образующихся при этом оксихлоридов при нагревании на окислы и пентахлориды) и диспропорционированием низших хлоридов ниобия.
Разработан способ восстановления, по которому пары пентахлорида ниобия подают в реактор, заполненный кипящим слоем из порошка ниобия, создаваемым потоком водорода. Процесс ведут при 816° С. Образующийся металлический ниобий осаждается на частицах порошка металла, которые выводят из реактора и заменяют более мелким порошком, полученным измельчением готового продукта. Применяют 90-кратный избыток водорода. Производительность реактора 17 кг/ч на 1 м2 его поперечного сечения. Процесс можно осуществить как непрерывный. Ниобий содержит менее 0,05% примесей. Восстановление хлоридов водородом становится весьма перспективным методом получения ниобия и тантала.
В последнее время появились сообщения о выделении V, Nb и Та восстановлением водородом пентафторидов. Восстановление протекает достаточно полно при создании двух-пятикратного избытка водорода (по отношению к стехиометрическому). Концентрация пентафторида в исходной смеси 7-16 об.%, температура реакции 1300-1500° С для TaF5 и 1000-1200° С для NbF5.
Возможно восстановление пентахлорида тантала (и ниобия) магнием. При этом смесь пентахлорида и стружки магния (с 10%-ным избытком) загружают в тигель, помещенный в герметически закрывающийся реактор. Реактор нагревают до 450° С, при этом начинается реакция между твердым магнием и парами MeCl5 (для TaCl5 tкип=240° С). Температуру затем повышают до 750° С. В основе процесса лежит реакция:
2TaCl5 (г.) + 5Mg (ж.) = 2Та (тв.) + 5MgCl2 (ж.);
DН298 = 205 ккал;
DGoT = 5DGoMgCl2 - 2DGoTaCl5 ;
Kp = 1/pTaCl52
При 750°С DGoMgCl2 = -111 ккал, DGoTaCl5 = -65 ккал, Следовательно, DGo750 = -425 ккал, lg Kp » 90; pTaCl5 »10-45 ат. Исчезающе малая величина pTaCl5 говорит о возможности полного восстановления. Для снижения температуры плавления MgCl2 добавляют КСl или NaCl. После остывания реакционной массы порошок тантала отмывают водой и слабым раствором НСl, сушат и упаковывают.
Глава 9
МЕТАЛЛОТЕРМИЯ
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Металлотермия - это процесс восстановления металлов из их соединений другими металлами, химически более активными, при повышенной температуре. Иногда сюда включают также процессы восстановления неметаллами.
Многие редкие элементы впервые получены и производятся в настоящее время в больших масштабах металлотермическим методом, который отличается относительной простотой процессов и технологического оборудования. Основоположником металлотермии был русский ученый Николай Николаевич Бекетов (1827—1911).
При разработке высокотемпературных химико-технологических процессов обычно производят предварительную оценку вероятности протекания тех или иных реакций, а также соотношения продуктов реакции и исходных веществ в состоянии равновесия - константы равновесия.
Реакцию металлотермического восстановления в общем виде можно представить уравнением
MeX’ + Me'' « Me''X + Me’ + DH, (67)
где Х - анион; DH - тепловой эффект.
Протекание реакции в сторону образования продуктов (восстановление Me’) возможно при условии
DGo = (DGoT, Me''X - DGoT, Me'X) <0,
где DGoT, Me'X - энергия Гиббса реакций образования соединений МеХ из элементов при температуре реакции. Обычно считается, что в случае, когда G°T>0, реакция не идет. Однако, принимая во внимание уравнение (3), легко видеть, что Кр всегда больше нуля и при контакте исходных веществ (Me'X + Me") в любом случае получается какое-то количество продуктов реакции (минимальное для DGoT >0). Если при этом возможно осуществление процесса с отводом восстанавливаемого металла (восстановление летучего металла в вакууме), реакция протекает достаточно полно даже в случае положительного значения DGoT, и возможность технологического ее осуществления определяется в основном экономическими соображениями.
Сдвиг величины DG в нужную сторону можно осуществить, если обеспечивается связывание образующегося продукта (Me''X), например его отшлакование. Иногда для этой цели в исходную смесь специально вводят вещество, образующее устойчивые легкоплавкие соединения nMe'''X.mMe''X.
Изменение энергии Гиббса вычисляют обычными методами по уравнению (6). Для приближенной оценки возможности протекания реакции восстановления удобно пользоваться диаграммами (рис. 65-67), на которых приведены значения энергии Гиббса реакций Ме + Х ® МеХ.

Рис. 65. Зависимость энергии Гиббса образования окислов металлов из элементов от температуры (Вольский А. А., Сергиевская Е. М., 1968, с. 251, рис. 122).

Рис. 66. Зависимость энергии Гиббса образования хлоридов из элементов от температуры (Вольский А. Н., Сергиевская Е. М., 1968, с. 256- 257, рис. 126).

Рис. 67. Зависимость энергии Гиббса образования фторидов из элементов от температуры (Вольский А. Н.. Сергиевская Е. М., 1968, с. 267, рис. 130).
Чем больше по абсолютному значению DG° образования данного соединения, тем более оно устойчиво и тем сильнее восстановительная способность металла, входящего в это соединение. Все значения энергии Гиббса образования (см. рис. 65-67) рассчитаны не на моль образующегося соединения, а на моль газа, принимающего участие в реакции, например, по уравнениям:
½ Ti + Fa ® ½ TiF4;
Mg + F2 ® MgF2
и т. п., что делает их сопоставимыми.
Практически во всех случаях абсолютное значение DG° с повышением температуры уменьшается, что говорит об уменьшении прочности соединений, стремлении их к диссоциации.
Зависимость DG° от температуры имеет вид степенного ряда, однако кривые приведенных диаграмм приближаются к прямым в тех пределах, где отсутствуют фазовые превращения металла или соли. В точках плавления, кипения и аллотропического перехода эти прямые претерпевают излом и приобретают другой наклон. Принимая в первом приближении величину DG° не зависящей от температуры, легко показать, что угловой коэффициент каждого участка, прямой приблизительно равен отрицательному значению изменения энтропии: ∂(DG°)/∂T = -DS°. В соответствии с закономерностями изменения энтропии системы прямая претерпевает излом вверх при фазовом превращении металла и вниз при превращении соединения. Изломы резче всего в точках кипения (из-за резкого изменения энтропии системы при образовании газовой фазы). В точках полиморфного превращения изломы незначительны.
Определенность понятий металл-восстановитель и восстанавливаемый металл относительна, так как после пересечения кривых зависимости DG° от Т элементы меняются местами и реакция идет в сторону вытеснения металла, который до пересечения являлся восстановителем. В пределах твердого и жидкого состояний металлов и их соединений угловые коэффициенты прямых чаще всего близки и они почти не пересекаются. Следовательно, вплоть до точек кипения металлов и их солей повышение температуры редко изменяет последовательность вытеснения одних металлов другими. Но последовательность, часто изменяется при температуре выше точки кипения.
Кривая изменения энергии Гиббса при образовании СО (см. рис. 65) имеет обратный наклон по отношению к другим кривым, поэтому углеродом при достаточно высокой температуре можно восстановить практически все металлы из окислов (табл. 24), однако, к сожалению, при этом чаще получаются стойкие карбиды, а не чистые металлы.
Положение кривых рис. 65-67 определяет также возможность рафинировки металлов избирательным образованием соединений металлов-примесей с последующим их отшлакованием. Действительно, металлы-примеси, обладающие большими абсолютными значениями DG° образования, например, окислов, могут быть переведены в шлак избирательным окислением. Возможно удаление, например, Са и Mg из Al-сплавов продуванием кислорода, однако удаление Zr, Ti и др. таким путем осуществить не удается, так как сначала должен образоваться окисел очищаемого металла. Расположение кривой для АlСl3 показывает термодинамическую невозможность удаления из алюминиевых сплавов примесей титана избирательным хлорированием. Данные диаграмм DG° = f(T) определяют также возможность применять добавки одних металлов для «раскисления» (удаления вредных примесей) других.
Таблица 24
Температура начала восстановления некоторых окислов углеродом
| окисел | Температура, °С | окисел | Температура, °С | ||
| при давлении 760 мм рт. cт. | в вакууме | при давлении 760 мм рт. cт. | в вакууме | ||
| V2O5 | - | 650 | Ta2O5 | - | 1100 |
| Cr2O3 | 1105 | 690 | SiO2 | 1460 | 1250 |
| La2O3 | - | 700 | BeO | - | 1315 |
| UO2 | 1480 | 800 | MgO | 1800 | 1350 |
| CeO2 | - | 800 | Al2O3 | 1950 | 1350 |
| TiO2 | - | 1000 | ThO2 | 1600 | 1380 |
Из рис. 65-67 можно сделать вывод, что кальций является лучшим восстановителем металлов из их окислов, хлоридов и фторидов. Однако при выборе восстановителя необходимо принимать во внимание экономические показатели процесса, а также технологические условия. Для получения чистого металла необходимо, чтобы восстановитель не образовывал с ним сплавов и соединений, а избыток восстановителя и шлак легко отделялись (механическим путем, отшлакованием, отмывкой, отгонкой и т. п.). Необходимо, чтобы стоимость полученного металла оправдывала расходы на восстановитель.
Количество тепла, выделяемого в металлотермическом процессе, определяется как разность теплот образования соединений из элементов.
Часто энергия Гиббса реакции определяет принципиальную возможность ее протекания при низкой температуре с достаточной полнотой, однако скорость реакции может оказаться настолько низкой, что практическое ее осуществление становится невозможным. Выделяемое тепло при этом рассеивается без заметного повышения температуры системы. Чтобы обеспечить повышение температуры реакционной массы за счет выделяющегося тепла, необходима минимальная температура tн - температура начала реакции. По достижении tн реакция распространяется по всему объему исходной смеси и температура повышается до максимальной tт.р. - температуры реакции.
Для определения теоретической температуры реакции необходимо составить тепловой баланс процесса по схеме: провести реакцию при 298° К с выделением DH298, затем нагреть продукты реакции этим теплом до искомой температуры tт.р., учитывая теплоты полиморфных превращений, плавления, испарения продуктов реакции, теплоты растворения Me" в Me' и в Ме"Х и т. д., составить уравнение теплового баланса и решить его относительно tт.р..
Для реакции без избытка восстановителя
tпл Me''X tпл Me'
DH298 = ∫Ср Ме"Х(тв.) dt + ∫Ср Ме’(тв.) dt + ∑lпол. Me’и Me''X + ∑lпл. Me’и Me''X + ∑lисп. Me’и Me''X +
298 298 tт.р. tт.р.
+ ∫Ср Ме"Х(ж.) dt + ∫Ср Ме’(ж.) dt (68)
tпл Me''X tпл Me'
где DH298 - тепловой эффект металлотермической реакции при 298° К при стехиометрическом соотношении восстанавливаемого соединения и восстановителя; lпл, lпол, lисп - молярная теплота плавления продуктов реакции, полиморфного превращения и испарения; Ср - молярная теплоемкость; tпл - температура плавления.
Расчет справедлив для случая больших значений константы реакции восстановления, когда равновесным количеством исходных веществ можно пренебречь. Для реакции с избытком восстановителя необходимо учитывать растворение избытка восстановителя в Me’ и шлаке Ме"Х и т. п. Если tт.р>tкип шлака, надо включить в расчет теплоту испарения шлака.
Практически получаемая температура меньше tт.р. из-за потерь тепла за время прохождения реакции и зависит от конструкции реактора, скорости процесса и других факторов. Увеличение масштаба плавки способствует относительному уменьшению тепловых потерь. Сокращению потерь способствуют также уменьшение удельного объема шихты, повышение скорости реакции, теплоизоляция стенок реактора и т. п.
Если условия проведения процесса требуют достижения определенной температуры (например, для получения восстанавливаемого металла в расплавленном состоянии), применяют подогревающие добавки, часто состоящие из соединений, реагирующих с восстановителем с большим выделением тепла. Перегрев шихты может привести к бурному парообразованию и выбросу реакционной смеси. В этом случае применяют охлаждающие добавки, в качестве которых могут служить избыток восстановителя или инертные (разбавляющие) материалы.
Для приближенной оценки развиваемой в процессе реакции восстановления температуры можно пользоваться величиной термичности Т, выражающей количество тепла, выделяющегося на 1 г шихты:
T = [DHМе"Х - DHМе’Х] / [nMМе" + mMМе’Х] (69)
где DH - тепловые эффекты образования соединений МеХ; nMМе" и mMМе’Х - значения молекулярной массы реагирующих веществ, взятые в стехиометрическом соотношении (n:m). В табл. 25 приведены значения термичности процессов восстановления окислов некоторых редких металлов магнием.
Таблица 25
Дата: 2019-03-05, просмотров: 860.