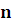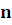В рефрактометрии используют два способа расчета концентрации вещества в растворе по измеренному показателю преломления.
1. Расчет концентрации по формуле:
n - n 0
C % = -------
F
Значение фактора показателя преломления берется из рефрактометрических таблиц.
2. Расчет концентрации по рефрактометрическим таблицам:
Измерив, показатель преломления, в таблице находят соответствующее ему значение концентрации. Если измеренный показатель преломления в таблице не приведен, проводится интерполирование.
Пример: Расчет концентрации по формуле:
Рассчитать процентное содержание глюкозы в растворе, если показатель преломления раствора глюкозы равен n = 1,3373, nводы = 1,3333. Фактор F глюкозы безводной-0,00142.
Решение:
n-n0 1,3373-1,3333
C% = ------- = --------------------- = 2,8 %
F 0,00142
Вывод: Процентное содержание глюкозы C% = 2,8 %.
Задание: Определение концентрации веществ в растворах с неизвестной концентрацией.
Выполнить задание по предложенному алгоритму:
1. Проверить правильность работы рефрактометра: нанести на призму несколько капель воды очищенной.
2. Определить ее показатель преломления (n 0). Он должен быть равен 1,333.
3. Определить показатель преломления исследуемого раствора (n).
4. По рефрактометрической таблице определить % концентрацию раствора соответствующую этому показателю.
5. Если n отсутствует в таблице, рассчитайте концентрацию по формуле
n - n 0
C % =-------
F
Для этого вам необходимо с помощью рефрактометрической таблицы определить F.
6. Сделайте вывод, сравнив % концентрацию раствора, определенную по рефрактометру, с концентрацией на этикетке.
7. Оформить работу в дневниках для практических работ.
15. Задание: Определение процентного содержания в % растворов веществ неизвестной концентрации
Оформить результаты в таблице в дневниках для практических работ:
| Наименование раствора | n 0 | n | f |  % %
|
Приложение 1
Схема оформления дневника практических работ
Таблица 1
Схема оформления дневника практических работ по разделу «Качественный анализ»
Дата Практическая работа № 1
Тема: «…………………………………………….»
| Название опыта | Уравнение реакции | Наблюдаемый эффект | Выводы |
Таблица 2
Схема оформления дневника практических работ по разделу «Количественный анализ»
Дата Практическая работа № 1
Тема: «…………………………………………….»
| Название задания | Метод количественного анализа, титрованный раствор, индикатор, точка эквивалентности, уравнение реакции, особые условия | Расчеты | Выводы |
Приложение 2
Классификация катионов
Таблица 1
| Номер группы, | Изучаемые катионы | Групповой реагент | Продукты реакции с групповым реагентом и аналитический эффект |
| I | Na+, K+, NH4+ | Нет | - |
| II | Ag+, Pb2+, Hg2+ | Раствор HCl | AgCl↓ l, PbCl↓2, Hg2Cl2 ↓ осадки белого цвета |
| III | Ca2+, Ba2+ | Раствор H2SO4 | CaSO4 ↓, BaSO4 ↓ осадки белого цвета |
| IV | Al3+, Zn2+ | Недостаток раствора NaOH (KOH) | Al(OH)3↓, Zn(OH)2↓ осадки белого цвета |
| V | Fe2+,Fe3+,Mg2+,Mn2+ | раствор NaOH и KOH | Fe(OH)2 ↓осадок зеленый, Fe(OH)3,↓осадок бурый, Mg(OH)2↓осадок белый, Mn(OH)2↓ осадок белый |
| VI | Cu2+,Hg2+ | Раствор NH4OH | (CuOH)2SO4↓осадок голубой, [Hg(NH2)]Cl↓осадок белый |
Приложение 3
Классификация анионов
Таблица 1
| Номер группы | Изучаемые анионы | Групповой реагент | Продукты реакции с групповым реагентом |
| I | SO32-, SO42-, СО32- С2O42-, CrO42-, ВО33-, В4О72-, S2O32-, PO43- | раствор BaCl2 | Все осадки белого цвета, кроме хроматов (желтого цвета) |
| II | Cl-Вr- I- | раствор AgNO3 | AgCl ↓ осадок белый творожистый) AgВr (осадок желтоватый) AgI (осадок желтый) |
| III | NO3- NO2- CH3COO- C6H5COO- C6H4OHCOO- | нет | --- |
Приложение № 4
Величины показателей преломления и факторы водных растворов веществ
Таблица 1
| Концентрация % | ||
Натрия хлорид
Натрия бромид
Натрия бензоат
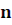
| 1 | 1.3347 | 0.00170 | 1.3343 | 0.00130 | 1.3351 | 0.00211 |
| 2 | 1.3364 | 0.00170 | 1.3356 | 0.00130 | 13372 | 0.00211 |
| 3 | 1.3381 | 0.00170 | 1.3370 | 0.00133 | 1.3393 | 0.00210 |
| 4 | 1.3397 | 0.00170 | 1.3383 | 0.00133 | 1.3414 | 0.00210 |
| 5 | 1.3414 | 0.00170 | 1.3397 | 0.00134 | 1.3435 | 0.00210 |
| 6 | 1.3430 | 0.00170 | 1.3410 | 0.00133 | 1.3456 | 0.00210 |
| 7 | 1.3447 | 0.00170 | 1.3423 | 0.00133 | 1.3477 | 0.00210 |
| 8 | 1.3462 | 0.00165 | 1.3436 | 0.00133 | 1.3497 | 0.00209 |
| 9 | 1.3478 | 0.00164 | 1.3449 | 0.00132 | 1.3518 | 0.00209 |
| 10 | 1.3495 | 0.00165 | 1.3462 | 0.00132 | 1.3539 | 0.00209 |
| 11 | 1.3510 | 0.00164 | 1.3476 | 0.00133 | 1.3560 | 0.00209 |
| 12 | 1.3525 | 0.00162 | 1.3489 | 0.00133 | 1.3581 | 0.00209 |
| 13 | 1.3540 | 0.00160 | 1.3502 | 0.00132 | 1.3601 | 0.00208 |
| 14 | 1.3556 | 0.00160 | 1.3514 | 0.00131 | 1.3621 | 0.00208 |
| 15 | 1.3571 | 0.00160 | 1.3527 | 0.00131 | 1.3642 | 0.00208 |
| 16 | 1.3585 | 0.00160 | 1.3540 | 0.00131 | 1.3563 | 0.00206 |
| 17 | 1.3599 | 0.00160 | 1.3552 | 0.00130 | 1.3581 | 0.00208 |
| 18 | 1.3614 | 0.00160 | 1.3565 | 0.00130 | 1.3703 | 0.00207 |
| 19 | 1.3628 | 0.00160 | 1.3578 | 0.00130 | 1.3723 | 0.00207 |
| 20 | 1.3644 | 0.00157 | 1.3590 | 0.00130 | 1.3744 | 0.00207 |
| 21 | 1.3657 | 0.00156 | ||||
| 22 | 1.3672 | 0.00155 | ||||
| 23 | 1.3687 | 0.00151 | ||||
| 24 | 1.3700 | 0.00154 | ||||
| 25 | 1.3715 | 0.00154 |
|
Концент- Рация % |
Кальция хлорид |
Концент- Рация % |
Кальция хлорид | ||||
|
| f |
| f | ||||
| 1 | 1,3342 | 0,00120 | 39 | 1.3759 | 0.00110 | ||
| 2 | 1,3354 | 0,00120 | 40 | 1.3769 | 0.00109 | ||
| 3 | 1,3366 | 0,00120 | 41 | 1.3779 | 0.00109 | ||
| 4 | 1,3377 | 0,00117 | 42 | 1.3789 | 0.00109 | ||
| 5 | 1,3388 | 0,00116 | 43 | 1.3799 | 0.00109 | ||
| 6 | 1,3400 | 0,00116 | 44 | 1.3810 | 0.00109 | ||
| 7 | 1,3411 | 0,00116 | 45 | 1.3819 | 0.00109 | ||
| 8 | 1,3422 | 0,00115 | 46 | 1.3829 | 0.00108 | ||
| 9 | 1,3434 | 0,00115 | 47 | 1.3840 | 0.00108 | ||
| 10 | 1,3445 | 0,00115 | 48 | 1.3850 | 0.00108 | ||
| 11 | 1,3457 | 0,00115 | |||||
| 12 | 1.3469 | 0.00115 | |||||
| 13 | 1.3480 | 0.00115 | |||||
| 14 | 1.3491 | 0.00115 | |||||
| 15 | 1.3502 | 0.00115 | |||||
| 16 | 1.3514 | 0.00115 | |||||
| 17 | 1.3524 | 0.00114 | |||||
| 18 | 1.3536 | 0.00114 | |||||
| 19 | 1.3547 | 0.00114 | |||||
| 20 | 1.3556 | 0.00113 | |||||
| 21 | 1.3568 | 0.00113 | |||||
| 22 | 1.3580 | 0.00114 | |||||
| 23 | 1.3591 | 000113 | |||||
| 24 | 1.3601 | 0.00113 | |||||
| 25 | 1.3611 | 0.00112 | |||||
| 26 | 1.3623 | 0.00113 | |||||
| 27 | 1.3633 | 0.00112 | |||||
| 28 | 1.3643 | 0.00112 | |||||
| 29 | 1.3665 | 0.00112 | |||||
| 30 | 1.3666 | 0.00112 | |||||
| 31 | 1.3677 | 0.00112 | |||||
| 32 | 1.3688 | 0.00112 | |||||
| 33 | 1.3698 | 0.00111 | |||||
| 34 | 1.3708 | 0.00111 | |||||
| 35 | 1.3719 | 0.00111 | |||||
| 36 | 1.3729 | 0.00111 | |||||
| 37 | 1.3738 | 0.00110 | |||||
| 38 | 1.3749 | 0.00110 | |||||
Приложение 5
Таблица растворимости кислот, солей, оснований
Таблица 1
Обозначения : р - хорошо растворимый, м - малорастворимый, н - практически нерастворимый, + - полностью реагирует с водой или не осаждается из водного раствора, − - не существует, ? - данные о растворимости отсутствуют. | 
|
Приложение 6
Периодическая таблица Д.И. Менделеева
Таблица 1
| Пери- оды | I | II | III | IV | V | VI | VII | |||
VIII
2
гелий
He
4,0026
10
неон
Ne
20,179
18
аргон
Ar
39,948
36
криптон
Kr
83,80
54
ксенон
Xe
131,29
86
радон
Rn
[222]
*Лантаноиды
| 58 церий Ce 140,12 | 59 празеодим Pr 140,9077 | 60 неодим Nd 144,24 | 61 прометий Pm [145] | 62 самарий Sm 150,36 | 63 европий Eu 151,96 | 64 гадолиний Gd 157,25 | 65 тербий Tb 158,9254 | 66 диспрозий Dy 162,50 | 67 гольмий Ho 164,9304 | 68 эрбий Er 167,26 | 69 тулий Tm 168,9342 | 70 иттербий Yb 173,04 | 71 лютеций Lu 174.967 |
**Актиноиды
| 90 торий Th 232,0381 | 91 | 92 | 93 | 94 | 95 америций Am [243] | 96 кюрий Cm [247] | 97 берклий Bk [247] | 98 калифор-ний Cf [251] | 99 эйнштей-ний Es [252] | 100 фермий Fm [257] | 101 менделе-вий Md [258] | 102 нобелий No [255] | 103 лоуренсий Lr [260] | ||||
| s | p | d | f | ||||||||||||||
Приложение 7
Дата: 2019-02-19, просмотров: 445.