АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания к практическим занятиям для студентов, получающих второе профессиональное образование
Иваново 2013
Негосударственное образовательное учреждение
Ивановский фармацевтический колледж

О.В. Куратова, И. Н. Фадеева
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания к практическим занятиям для студентов, получающих второе профессиональное образование
Иваново 2013
Методические указания к практическим занятиям по аналитической химии предназначены для студентов 3-го курса (специальность Фармация, второе профессиональное образование)
Методические указания одобрены Методические указания на заседании цикловых методических составлены в
комиссий общепрофессиональных соответствии с ФГОС
и специальных дисциплин СПО по специальности
Методические указания утверждены Фармация
на заседании Методического
совета колледжа
Составители:
Куратова О.В., преподаватель химических дисциплин высшей квалификационной категории Ивановского фармацевтического колледжа
Фадеева И.Н., преподаватель химических дисциплин первой квалификационной категории Ивановского фармацевтического колледжа
Рецензент:
Морозов Л.Н., доктор технических наук, профессор Ивановского химико-технологического университета
Методические указания рекомендованы к изданию Методическим советом Ивановского фармацевтического колледжа для использования в учебном процессе по специальности Фармация
СОДЕРЖАНИЕ
Введение………………………………………………………………………….......4
Инструкция по охране труда и технике безопасности ……………………………5
1. Качественный анализ
1.1. Основные понятия качественного анализа...…………………………….7
1.2. Практические задания по качественному анализу
1.2.1. Катионы I аналитической группы……………………………………….8
1.2.2. Катионы II аналитической группы…………………………………….9
1.2.3. Катионы III аналитической группы……………………………...........10
1.2.4. Катионы IV аналитической группы…………………………….............11
1.2.5. Катионы V аналитической группы…………………………………….12
1.2.6. Катионы VI аналитической группы……………………………………13
1.2.7. Анионы I аналитической группы………………………………..........14
1.2.8. Анионы II аналитической группы……………………………………..16
1.2.9. Анионы III аналитической группы…………………………………….17
1.2.10. Анализ неизвестного вещества……………………………………..18
2. Количественный анализ
2.1. Основные понятия количественного анализа…………………………20
2.2. Практические задания по количественному анализу
2.2.1. Методы кислотно-основного титрования…………………………….28
2.2.2. Методы окислительно-восстановительного титрования…………….30
2.2.3. Осадительное титрование. Аргентометрия……………………………31
2.2.4. Комплексонометрия. Трилонометрия…………………………………33
2.2.5. Физико - химические методы анализа. Определение процентной концентрации однокомпонентных веществ в растворе методом рефрактометрии…………………………………………………………34
Приложение 1. Схема оформления дневника практических работ……………..39
Приложение 2. Классификация катионов……………………………………......40 Приложение 3. Классификация анионов………………………….........................41
Приложение 4. Величины показателей преломления и факторы водных растворов веществ………………………………………………………………….42
Приложение 5. Таблица растворимости кислот, солей, оснований ………….44
Приложение 6. Периодическая система элементов Д.И. Менделеева………….45
Приложение 7. Методы титриметрического анализа………………………….46
Список литературы…………………………………………………………….....47
ВВЕДЕНИЕ
Данные методические указания к практическим занятиям по аналитической химии предназначены для студентов колледжа, получающих второе профессиональное образование по специальности Фармация.
Методические указания по аналитической химии созданы в помощь студентам для самоподготовки и выполнения практических работ и включают в себя следующие разделы:
- Введение.
- Инструкцию по охране труда и по технике безопасности.
- Основные понятия качественного анализа.
- Задания к практическим работам по качественному анализу.
- Основные понятия количественного анализа.
- Задания к практическим работам по количественному анализу.
- Приложения.
- Список литературы.
Приобретенные на занятиях общие и профессиональные компетенции в области химического анализа, способствуют формированию профессиональных компетенций в области контроля качества лекарственных веществ.
Для выполнения практической работы студент обязан подготовиться теоретически, чтобы на занятиях овладеть техникой выполнения качественного и количественного анализа, решать ситуационные задачи. Студент должен:
- уметь организовать рабочее место;
- соблюдать правила техники безопасности;
- овладеть техникой качественного и количественного анализа;
- грамотно пользоваться химической посудой и оборудованием химической лаборатории;
- работать с учебно-наглядными и методическими пособиями;
- решать ситуационные задачи.
По окончании занятия студент должен оформить дневник практических работ для закрепления полученных компетенций. Дневник необходимо оформить по определённой схеме (приложение №1).
Каждое практическое занятие оценивается преподавателем с учетом теоретической и практической подготовки студента.
ТЕХНИКЕ БЕЗОПАСНОСТИ
1. Общие требования безопасности
1.1. Рационально строить свою работу.
1.2. Все работы вести точно и аккуратно.
1.3. Соблюдать все меры предосторожности при работе с ядовитыми, взрывоопасными и огнеопасными веществами.
1.4. Не загромождать свое рабочее место ненужными предметами.
1.5. Немедленно убирать с пола осколки разбитой посуды, пролитые жидкости или жиры.
1.6. Осторожно обращаться с легко-воспламеняющими, горячими и взрывоопасными веществами. При случайных проливах огнеопасных жидкостей необходимо выключить нагревательные приборы, спиртовки, место пролива жидкости засыпать песком или собрать тряпкой, затем тряпки и песок удалить, а место, где была пролита жидкость, хорошо промыть водой.
1.7. Нельзя хранить на рабочем месте, какие – либо вещества неизвестного происхождения.
1.8. Нельзя хранить и применять пищу на рабочем месте.
Требования безопасности перед началом работы
2.1. В лаборатории разрешено находится в белом халате и медицинской шапочке, во второй обуви
2.2. Дежурные студенты принимают химическую лабораторию у предыдущей группы.
2.3. Внимательно прочитать инструкцию к выполнению данной работы и продумать последовательность операций.
2.4. Предварительно подробно ознакомиться с проведением химического опыта и хорошо понять химизм процессов, которые предстоит изучить на практике.
2.2. Тщательно проверить, имеется ли все необходимое для проведения данной работы.
Требования безопасности во время работы
3.1. При работе с реактивами необходимо: реактивы закрывать пробкой или крышками. Если на склянке или банке нет этикетки, нельзя применять реактив.
3.2. Нельзя выливать или засыпать реактив обратно в склянку.
3.3. Применять реактивы следует в той концентрации и том количестве, которое указано в методическом указании.
3.4. Нельзя работать с грязной посудой.
3.5. Нельзя пробовать вещества на вкус.
3.6. Нюхать вещества, можно направляя к себе движением руки струю газа или пара, держа отверстие сосуда с веществом на некотором расстоянии от лица.
3.7. С сильно пахнущими веществами следует работать в вытяжном шкафу.
3.8. При растворении кислот наливают кислоту в воду, а не наоборот.
3.9. Не наклоняться над сосудом с кипящей жидкостью.
3.10. Нагревать жидкость в пробирке следует с верхних слоев, постепенно прогревая всю пробирку. Пробирку следует держать так, чтобы отверстие было направлено в сторону от себя и соседей, вдоль рабочего стола.
3.12. Нельзя путать крышки от склянок с разными веществами - это загрязняет реактивы.
3.13. Зажигать спиртовку следует спичками, ни в коем случае зажигалками или другой горящей спиртовкой. Нельзя перемещать горящую спиртовку.
Требования безопасности в аварийных ситуациях
4.1. Перед проведением очередного занятия в лаборатории преподаватель должен повторить указания о мерах предосторожности, которые необходимо соблюдать при использовании в данных опытах тех или иных реактивов.
4.2. При ранении стеклом нужно убедиться, что в ранке не осталось стекла, быстро протереть ранку ваткой, смоченной спиртом, смазать йодом и забинтовать.
4.3. При термических ожогах на обожженное место следует приложить бинт, смоченной холодной водой и обратиться в медицинский пункт колледжа.
4.4. В случае ожога лица, рук кислотой или щелочью немедленно обмыть пораженное место большим количеством воды, При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды и обратиться в медицинский пункт колледжа.
4.5. При необходимости пострадавшего после оказания первой помощи доставить в поликлинику.
Требования безопасности по окончанию работы
5.1. После окончания работы привести в порядок рабочее место, вымыть посуду, которая использовалась в химическом анализе, и сдать его лаборанту, дежурному или преподавателю. Посуда должна быть чисто вымыта и ополоснута дистиллированной водой.
5.2. Нельзя выливать в раковину отходы реактивов, вредные, пахучие вещества, для этого имеются специальные банки «Слив реактивов».
1. КАЧЕСТВЕННЫЙ АНАЛИЗ
1.1 Основные понятия качественного анализа
Аналитическая химия – это химическая дисциплина, в задачи которой входит изучение методов проведения химического анализа.
Объектами исследования аналитической химии могут быть органические и неорганические вещества.
Программа по аналитической химии состоит из качественного и количественного анализа.
Качественный анализ проводится с целью идентификации катионов, анионов, функциональных групп и состоящих из них соединений. Для этого используются химические, физические и физико-химические методы. Химические методы качественного анализа основаны на химических реакциях. В основе химического качественного анализа лежит классификации катионов и анионов. Классификация катионов приведена в соответствии с кислотно - основной системой анализа (приложение №2), анионов– по классической схеме деления в соответствии с растворимостью солей (приложение №3). Для проведения химического анализа веществ используют химические реакции. Различают общие, групповые и характерные реакции.
1. Групповые реакции проводятся с групповыми реагентами. Групповые реагенты – это реагенты, взаимодействующие с определённой группой ионов с одинаковым или близким аналитическим эффектом, и позволяющие отделить одну группу ионов от другой.
2. Характерные реакции проводят с селективными или специфическими реагентами, которые взаимодействуют с небольшим количеством ионов, вызывая одинаковый аналитический эффект. Селективные реагенты реагируют с определённым ограниченным числом ионов. Специфические реагенты вступают в аналитические реакции, как правило, с одним ионом.
3. Аналитические реакции могут выполняться «сухим» и «мокрым» путем Сухим путем выполняются, например, пирохимические реакции. Мокрым путем выполняются химические реакции между растворами.
Способы выполнения аналитических реакций могут быть различными: пробирочный, капельный, микрокристаллоскопический, пирохимический и другие.
1. Пробирочный способ, проводится в пробирке с небольшим количеством исследуемого раствора и реагента.
2. Капельный способ – проводится на фильтровальной бумаге или на предметном стекле с минимальным количеством исследуемого раствора и реагента.
3. Микрокристаллоскопический способ - проводится с использованием микроскопа для наблюдения кристаллов характерной формы, цвета и размера.
4. Пирохимический способ – основан на окрашивание ионами бесцветного пламени спиртовки с помощью грифеля, медной или нихромовой проволоки или с использованием выпарительной чашки.
1.2. ПРАКТИЧЕСКИЕ ЗАДАНИЯ ПО КАЧЕСТВЕННОМУ АНАЛИЗУ
1.2.1. Тема: Катионы I аналитической группы
Цель: Овладеть навыками проведения качественных реакций на катионы I
аналитической группы.
Опыт № 1. Качественные реакции на катион калия (К+)
1.1. Пирохимическая реакция.
Проведите пирохимическую реакцию на ион калия, используя любую растворимую соль калия. Отметьте наблюдение – окрашивание пламени спиртовки в фиолетовый цвет.
1.2. С раствором виннокаменной кислоты в присутствии ацетата натрия.
На предметное стекло поместите 1-2 капли раствора соли калия, добавьте каплю ацетата натрия и 1 каплю раствора виннокаменной кислоты. Потрите стеклянной палочкой. Отметьте наблюдения (белый кристаллический осадок).
Допишите уравнение реакции:
K+ + NaHC4H4O6 =
1.3. Микрокристаллоскопическая реакция с раствором гексанитрокобальтата(II) натрия и свинца.
На предметное стекло поместите каплю раствора соли калия, выпарите и рядом добавьте каплю раствора реагента. Осторожно стеклянной палочкой приведите растворы в соприкосновение, посмотрите в микроскоп. Отметьте наблюдения – кубические кристаллы черно-коричневого цвета. Допишите уравнение реакции:
K+ + Na2Pb[Cu(NO2)6] =
Опыт№2. Качественные реакции на катион натрия (Na + )
2.1. Пирохимическая реакция.
Выполните пирохимическую реакцию на ион натрия, используя любую растворимую соль натрия. Отметьте наблюдение – окрашивание пламени спиртовки в жёлтый цвет.
2.2. Микрокристаллоскопическая реакция с раствором цинкуранилацетата.
На предметное стекло поместите каплю раствора соли натрия, выпарите и рядом добавьте каплю раствора реагента. Осторожно стеклянной палочкой приведите растворы в соприкосновение, посмотрите в микроскоп. Отметьте наблюдения – зеленовато-желтые мелкие кристаллы. Допишите уравнение реакции:
Na+ + HZn[(UO2)3(CH3COO)9] =
2.3. Микрокристаллоскопическая реакция с раствором пикриновой кислоты.
На предметное стекло поместите каплю раствора соли натрия, выпарите и рядом добавьте каплю раствора реагента. Осторожно стеклянной палочкой приведите растворы в соприкосновение, посмотрите в микроскоп. Отметьте
наблюдения – в микроскопе наблюдаются кристаллы характерной формы. Допишите схему реакции:
Na++ пикриновая кислота →……….
Опыт № 3. Качественные реакции на катион аммония(NH4+)
4.1. С раствором щелочи.
В пробирку поместите 2 капли соли аммония и 3-4 капли раствора гидроксида
натрия (не касаясь стенок пробирки). Держа у отверстия пробирки индикаторную бумажку, смоченную очищенной водой, нагрейте пробирку над пламенем спиртовки. Отметьте наблюдения. Допишите уравнения реакций:
NH4+ + NaOH =
NH4OH =
4.2. С реактивом Несслера.
На предметное стекло поместите 1 каплю раствора соли аммония и 2 капли реактива Несслера. Отметьте наблюдения – красно-бурый осадок. Допишите уравнение реакции:
NH4OH + 2K2[HgI4] + 4 KOH =
1.2.2. Тема: Катионы I I аналитической группы
Цель: Овладеть навыками проведения качественных реакций на катионы II
аналитической группы.
Опыт № 4. Действие группового реагента
На 2 предметных стекла поместите по 2 капли растворов солей серебра и свинца. Прибавьте раствор соляной кислоты (1-2 капли).
Отметьте наблюдения – выпадение осадков белого цвета. Проверьте растворимость осадков. Допишите уравнения реакций:
Ag+ + Cl- =
Pb2+ + 2Cl- =
Опыт № 5. Качественные реакции на катион серебра ( Ag + )
5.1. С раствором калия иодида.
На предметное стекло поместите 1- 2 капли раствора соли нитрата серебра и добавьте 1 каплю раствора калия иодида. Отметьте наблюдения – жёлтый осадок. Допишите уравнение реакции:
AgNO3+ KI =
5.2. С раствором натрия тиосульфата.
На предметное стекло поместите 2 капли раствора нитрата серебра прибавьте 2 капли раствора тиосульфата натрия. Отметьте наблюдения – образование белого осадка, переходящего в желтый, затем – в черный. Допишите уравнения реакций:
2AgNO3+Na2S2O3=
Ag2S2O3=
Ag2SO3+S↓+H2O=
5.3. С формальдегидом в аммиачной среде (реакция «серебряного зеркала»).
В хорошо промытую пробирку прибавьте 3 - 4 капель раствора соли серебра и 3-4 капель раствор аммиака, добавьте 3-4 капель формальдегида и нагрейте.
Отметьте наблюдения. Допишите уравнение реакции:
HCOH+2AgNO3+3NH4OH=
Опыт № 6. Качественные реакции на катион свинца (Р b 2+ )
6.1. С раствором калия иодида (реакция « золотой струи»)
В пробирку поместите по 3-4 капли раствора соли свинца (II) и раствора иодида калия. К полученному осадку прилейте 3-4 капли очищенной воды и 3-4 капли разведенной уксусной кислоты, нагрейте до растворения осадка, вылейте полученный раствор в холодную воду. Наблюдайте движение «золотой струи» при взбалтывании. Допишите уравнение реакции:
Pb(NO3)2+ 2KI=
6.2. С раствором калия хромата.
На предметное стекло поместите 2 капли соли свинца раствора и 2 капли раствора хромата калия. Отметьте наблюдения – образование желтого осадка. Допишите уравнение реакции:
Pb(NO3)2+K2CrO4=
1.2.3. Тема: Катионы I II аналитической группы
Цель: Овладеть навыками проведения качественных реакций на катионы III
аналитической группы.
Опыт № 7. Действие группового реагента
На предметное стекло поместите на некотором расстоянии по 2 капли растворов солей бария и кальция, добавьте в каждую каплю по 2 капли раствора серной кислоты и этанола. Отметьте наблюдения – образование осадков белого цвета. Допишите уравнения реакций:
Ba2+ + SO42- =
Ca2+ + SO42- =
Опыт № 8. Качественные реакции на катион кальция (Са2+)
8.1. С раствором оксалата аммония.
В пробирку поместите растворы соли кальция и оксалата аммония. Добавьте к полученному осадку соляной кислоты. Отметьте наблюдения. Допишите уравнение реакции:
CaCI2 +(NH4)2C2O4 =
8.2. С раствором гексацианоферрата ( II ) калия.
В пробирку поместите растворы соли кальция, аммиачного буфера, нагрейте и добавьте равный объем насыщенного раствора гексацианоферрата(II)калия. Отметьте наблюдение – осадок белого цвета. Допишите уравнение реакции:
CaCI2+ K4[Fe(CN)6] + 2NH4OH=
Опыт № 9. Качественные реакции на катион бария (Ва2+)
9.1. С раствором калия хромата.
На предметное стекло поместите 1 каплю раствора соли бария и 1каплю калия хромата. Отметьте наблюдение – желтый осадок. Допишите уравнение реакции:
BaCl2 + K2CrO4 =
9. 2 . С раствором бихромата калия.
На предметное стекло поместите 2 капли раствора соли бария и 1-2 капли раствора калия бихромата. Отметьте наблюдение – желтый осадок. Допишите уравнение реакции:
2BaCl2 +K2Cr2O7+H2O =
1.2.4. Тема: Катионы IV аналитической группы
Цель: Овладеть навыками проведения качественных реакций на катионы IV
аналитической группы.
Опыт№10. Действие группового реагента
На предметное стекло поместите на некотором расстоянии по 2 капли раствора соли цинка и алюминия, добавьте в каждую каплю по 1 капле гидроксида натрия. Проверьте растворимость осадков в избытке реагента.
Отметьте наблюдения. Допишите уравнения реакций:
А13++ NaOH=
А1(ОН)3+ NaOH=
Zn2++ NaOH=
Zn(ОН)2+ NaOH=
Опыт № 11. Качественные реакции на катион алюминия (А13+)
11.1. С раствором ализарина.
На фильтровальную бумагу поместите каплю раствора гексацианоферрата(II) калия. В центр влажного пятна поместите каплю раствора любой соли алюминия, обработайте пятно парами аммиака и добавьте каплю раствора ализарина и снова обработайте парами аммиака. Отметьте наблюдения. Допишите схему реакции:
AlCl3+ K4[Fe(CN)6] + NH4OH + ализарин →………
11.2. С раствором нитрата кобальта.
На фильтровальную бумагу поместите 1 каплю раствора соли алюминия и 1 каплю разбавленной азотной кислоты. Подсушите бумагу и добавьте 1 каплю раствора нитрата кобальта. Фильтровальную бумагу поместите в выпарительную чашку и подожгите. Отметьте наблюдения. Допишите уравнение реакции:
AlCl3+ Co(NO3)2=
Опыт № 12. Качественные реакции на катион цинка ( Zn 2+ )
12.1. С раствором нитрата кобальта.
На фильтровальную бумагу поместите 1 каплю раствора соли цинка и 1 каплю разбавленной азотной кислоты. Подсушите бумагу и добавьте 1 каплю раствора нитрата кобальта. Фильтровальную бумагу поместите в выпарительную чашку и подожгите. Отметьте наблюдения. Допишите уравнение реакции:
ZnSO4 + Co(NO3)2=
12.2. С раствором гексацианоферрата ( II ) калия
На предметное стекло поместите 1 каплю раствора соли цинка и 1 каплю раствора желтой кровяной соли. Отметьте наблюдения. Допишите уравнение реакции:
ZnSO4 + K4[Fe(CN)6] =
1.2.5. Тема: Катионы V аналитической группы
Цель: Овладеть навыками проведения качественных реакций на катионы V
аналитической группы
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Основные понятия количественного анализа
Количественный анализ предназначен для количественного определения элементов, входящих в состав вещества, самого вещества и примесей в нем. Количественный анализ проводят химическим, физическим и физико-химическим методами. Среди количественных методов анализа различают весовые, физические или физико-химические, объемные методы анализа и т. д.
Весовые методы предусматривают весовое определение продуктов реакции путем проведения химических реакций, сопровождающихся выпадением осадка. Осадок высушивают, прокаливают и взвешивают на аналитических весах. И по количеству осадка рассчитывают количество исходного вещества.
Физические или физико–химические методы - это изменение физических свойств веществ (изменение окраски пламени, спектра поглощения и испускания, t кип., t плав., угла преломления, величины электрического тока).
Объемные методы связаны с определением количества раствора реагента с точной концентрацией, пошедшего на взаимодействие с определяемым веществом. По объему раствора реагента определяют количество анализируемого вещества.
Объемные методы количественного определения связаны с операцией, называемой титрованием. Отсюда второе название метода — титриметрический. Титрование — процесс постепенного добавления раствора реагента с известной концентрацией к раствору вещества неизвестной или определяемой концентрацией (или наоборот).
В объемном анализе вместо взвешивания проводится измерение объемов. В титриметрическом анализе к применяемым реакциям предъявляются определенные требования:
1. Момент окончания реакции (называют точкой эквивалентности) должен четко и хорошо определяться: точка эквивалентности может фиксироваться по изменению окраски титруемого раствора, или с помощью индикатора; выпадению осадка; по изменению химико - физических показателей (электропроводность, потенциал, изменение угла преломления и т.д.).
2. Реакция не должна быть обратимой.
3. Скорость реакции должна быть достаточно высока, чтоб была возможность точного фиксирования точки эквивалентности.
4. При титровании не должно быть побочных реакций.
Из объемных методов анализа наиболее часто применяют методы, основанные на реакциях:
- нейтрализации;
- окисления — восстановления;
- комплексообразования;
- осаждения.
В соответствия с применяемой реакцией методы анализа получили названия: методы нейтрализации, методы осаждения, методы окисления — восстановления (редоксиметрии), методы комплексонометрии.
В количественном анализе растворы реагентов делятся по назначению:
1. Титранты (титрованные растворы, рабочие растворы)) — это растворы, с помощью которых определяют концентрацию анализируемого вещества.
2. Стандартные растворы — это растворы с помощью которых определяют точную концентрацию титранта.
При любом способе титрования всегда требуется титрованный раствор, точное измерение объемов, четкое определение точки эквивалентности правильное вычисление результатов анализа.
Мерная посуда
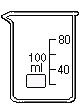
| Стакан с носиком служит для хранения жидких и твердых веществ, а также для проведения простейших химических операций (растворение, нагревание) |
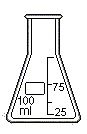
| Колба коническая используется для проведения различных химических операций, например титрования |
| Колба круглодонная служит для проведения разнообразных химических операций при нагревании. |

| Цилиндр используют для измерения объема жидкостей. |
| Воронка конусообразная служит для переливания жидкостей и фильтрования. |

| Стеклянная палочка предназначена для размешивания веществ в химической посуде. Для предохранения посуды от случайного растрескивания при размешивании веществ на конец стеклянной палочки надевают кусочек резиновой трубки. |

| Ложка фарфоровая (1), шпатель (2) служат для взятия твердых и сыпучих веществ. Ложка-дозатор (3) предназначена для взятия определенной порции вещества. |

| Чашка фарфоровая применяется для выпаривания жидкостей. |
| Ступка с пестиком служат для размельчения и растирания твердых веществ. |

| Штатив для пробирок, служит для размещения в нем пробирок. |

| Зажим пробирочный служит для закрепления пробирки, если вещество в пробирке требуется нагреть в пламени. |
| Склянка с пипеткой служит для хранения растворов реактивов при работе с малыми количествами веществ. |

| Мерная колба, предназначена для приготовления растворов точной концентрации, а также растворов разбавления. |

| Пипетки с делениями на слив от любой отметки до сливного кончика. Применяются для точного отмеривания определенных объемов жидкости. |

| Спиртовка предназначена для нагревания жидкостей. |
ПРАКТИЧЕСКИЕ ЗАДАНИЯ ПО КОЛИЧЕСТВЕННОМУ АНАЛИЗУ
Задание: Определение массовой доли соляной кислоты НСl в растворе.
Методика: Приготовить разведение 1:100. В коническую колбу поместить 1 мл разведения раствора соляной кислоты НСl , добавить 1-2 капли индикатора метилового оранжевого и титровать 0,1 М раствором гидроксида NаОН до изменения окраски от розовой до желтой. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, происходящей при титровании:
HCI + NaOH=
2.Выполнить расчеты по результатам титрования:
СЭ(NаОН) · МЭ(НСI) где СЭ(NаОН) – молярная концентрация
T(НСI) = ---------------------------------- , эквивалента рабочего раствора
1000 NаОН (СЭ(NаОН) = 0,1 М);
МЭ(НСI) – молярная масса эквивалента кислоты хлористоводородной(г/моль) ;
Т(НСl) · Vср (NаОН) · К(NаОН) ·100% VК.
ω%(НСI) = ----------------------------------------------------------- · ------,
q(НСI) VП.
где ω%(НСI) – массовая доля кислоты хлористоводородной в растворе(%);
Т(НСl) – титр кислоты хлористоводородной (г/мл);
Vср(NаОН) – средний объём рабочего раствора натрия гидроксида, который был израсходован на титрование разведения раствора кислоты хлористоводородной (мл);
К(NаОН) – поправочный коэффициент к концентрации рабочего раствора натрия гидроксида, если не обозначен на этикетке рабочего раствора принимают за единицу, т.е. К = 1);
q(НСI) – навеска определяемого раствора, т.е. количество разведения кислоты хлористоводородной взятое на титрование (мл);
VК – объём колбы, т.е. объём мерной колбы в которой готовили разведение (мл);
VП. – объём пипетки (мл), количество раствора кислоты хлористоводородной взятое для приготовления разведения.
2. Задание: Определение массовой доли борной кислоты Н3ВО3 в растворе.
Методика: В коническую колбу поместить 1 мл раствора борной кислоты Н3ВО3, добавить пальчиковым мерным цилиндром 1 мл глицерина нейтрализованного по фенолфталеину и 1-2 капли индикатора фенолфталеина, титровать 0,1 М раствором гидроксида NаОН до изменения окраски от бесцветной до розовой. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, происходящей при титровании:
Н3ВО3 + NaOH=
2. Выполнить расчеты по результатам титрования:
СЭ (NаОН) · МЭ(Н3ВО3)
T(Н3ВО3) = ---------------------------------- ,
1000
Т(Н3ВО3) · Vср (NаОН) · К(NаОН) ·100%
ω%( Н3ВО3) = -------------------------------------------------------
q(Н3ВО3)
3. Задание: Определение массовой доли натрия гидрокарбоната NaHCO 3 в растворе.
Методика: В колбу для титрования поместить 1 мл раствора натрия гидрокарбоната NaHCO3, добавить 1-2 капли индикатора метилового оранжевого и титровать 0,1 М раствором гидроксида НСI до изменения окраски от жёлтой до розовой. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции, происходящей при титровании:
NaHCO3 + НСI =
2. Выполнить расчеты по результатам титрования:
СЭ(1(НСI) · МЭ(NaHCO3)
T ( NaHCO3) = -----------------------------------,
1000
Т(NaHCO3) · Vср (НСI) · К(НСI) ·100%
ω%( NaHCO3) = -------------------------------------------------- .
q(NaHCO3)
Задание: Определение массовой доли калия иодида концентрации в растворе методом Фаянса.
Методика: В колбу для титрования поместить 1 мл раствора калия иодида, добавить 1,5 мл раствора разведенной уксусной кислоты, 1-2 капли 0,1 % раствора эозината натрия и титровать 0,1М раствором нитрата серебра до розово-малинового осадка. Титровать до трех сходящихся результатов.
1. Дописать уравнения реакций происходящие при титровании:
KI + AgNO3 =
2. Выполнить расчеты: определить титр и массовую долю калия йодида в растворе.
10. Задание: Определение массовой доли натрия бромида в растворе методом Фольгарда.
Определение основано на осаждении, бромид - ионов Вr- избытком 0,1 М раствора нитрата серебра АgNО3 в азотнокислой среде, не прореагирующую часть АgNО3 титровать раствором роданида калия или аммония в присутствии индикатора насыщенного раствора железоаммонийных квасцов
Методика: в колбу для титрования поместить 0,5 мл раствора натрия бромида, 1-2 мл разбавленного раствора азотной кислоты, 2 мл 0,1 М раствора нитрата серебра АgNО3, 1-2 капли индикатора насыщенного раствора железоаммонийных квасцов и титровать избыток АgNО3 0,1 М раствором роданида калия или аммония до красной окраски раствора. Титровать до трех сходящихся результатов.
1. Переписать уравнения реакции, происходящие при титровании:
NaВr + АgNО3 = АgВr↓ + NaNО3 + (АgNО3)избыток
АgNО3 + КSСN = КNО3 + АgSСN↓
в конечной точке титровании:
2FеNН4(SО4)2 + 6КSСN = 2Fе(SСN)3↓ + 3К2SО4 + (NН4)2SО4
2. Выполнить расчет массовой доли натрия бромида в растворе по формуле:
T (AgNO3/NaВr) · [V(АgNО3) · K(АgNО3) -V(КSСN ) · K(КSСN)] · 100%
ω%( NaВr ) = ------------------------------------------------------------------------------------------------
q(NaВr)
Задание: Определение массовой доли магния сульфата в растворе.
Методика: В колбу для титрования поместить 1 мл раствора магния сульфата, 1 мл аммиачного буферного раствора, несколько крупинок индикатора кислотного хрома темно-синего, титровать до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании.
 СН2-СООNа
СН2-СООNа
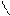 СН2 - N
СН2 - N
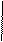 СН2-СООН + MgSO4 =
СН2-СООН + MgSO4 =
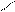 СН2- СООН
СН2- СООН
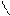 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчет: определить титр и массовую долю магния сульфата в растворе.
2.2.5. Тема: Физико - химические методы анализа. Определение процентной концентрации однокомпонентных веществ в растворе методом рефрактометрии.
Цель: Овладеть навыками работы с рефрактометром и определения концентрации веществ методом рефрактометрии
Устройство рефрактометра

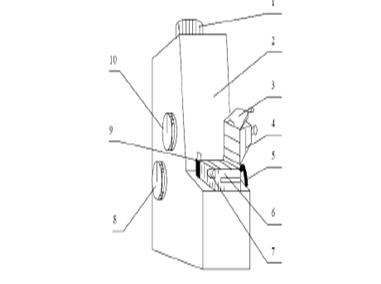
Рис 3. Внешний вид рефрактометра ИРФ-454
Рефрактометр ИРФ-454 состоит из следующих основных частей: корпуса 2, зрительной трубы с окуляром 1 и рефрактометрического блока 3, нижняя часть является измерительной призмой, а верхняя - осветительной.
Рефрактометрический блок жестко соединен со шкалой отсчетного устройства, расположенного внутри корпуса прибора. Чтобы найти границу
раздела и совместить ее с перекрестием сетки, необходимо, вращая винтом 8, наклонить рефрактометрический блок до нужного положения. Для
устранения окрашенности наблюдаемой границы раздела служит компенсатор. Винтом 10 можно вращать призмы компенсатора одновременно в разные стороны, устраняя при этом цветную кайму границы
раздела. Исследуемая жидкость подсвечивается зеркалом 6 (на рис. 3 оно
показано в закрытом положении), а шкала показателей преломления -
зеркалом 5.
Порядок работы
1. До начала измерений проверить чистоту соприкасающихся поверхностей призм.
2. Проверка нулевой точки. На поверхность измерительной призмы нанести 2-3 капли дистиллированной воды, осторожно закрыть осветительной призмой. Открыть осветительное оконце 3 и установить в направлении наибольшей интенсивности источника света с помощью зеркала 6. Путем вращения винта 8 получить резкое, четкое, бесцветное разграничение светлого и темного поля в поле зрения окуляра. Вращая винтом 8, нанести линию света и тени точно до совпадения с точкой пересечения линии в верхнем оконце окуляра. Вертикальная линия в нижнем оконце окуляра указывает результат измерения - показатель преломления воды при 20°С равен 1,333. В случае других показаний показатель преломления воды, следует повторить измерение, предварительно обработать рефрактометрический блок 3 спиртом и тщательно вытереть фильтровальной бумажкой.
3. После установки прибора на нулевую точку приподнимают камеру осветительной призмы и фильтровальной бумагой вытирают воду. Затем наносят 1-2 капли исследуемого раствора на плоскость измерительной призмы, камеру закрывают. Вращают винты до совпадения границы света и тени с точкой пересечений линий. По шкале в нижнем оконце окуляра производят отсчет коэффициента преломления раствора.
4. После каждого определения рефрактометрический блок необходимо промыть водой и вытереть досуха фильтровальной бумагой, между измерительной и осветительной призмой проложить фильтровальную бумажку.
5. Определение концентрации по таблицам. Существуют таблицы для определения концентрации водных растворов веществ, которые называются рефрактометрическими. В таблицах приведены коэффициенты преломления и соответствующие им концентрации веществ. В некоторых таблицах приведены коэффициенты преломления с точностью до третьего знака. В этом случае концентрация, соответствующая значению показателя преломления, взятому с четвертым знаком, определяется интерполированием.
Задание: Определение концентрации веществ в растворах с неизвестной концентрацией.
Выполнить задание по предложенному алгоритму:
1. Проверить правильность работы рефрактометра: нанести на призму несколько капель воды очищенной.
2. Определить ее показатель преломления (n 0). Он должен быть равен 1,333.
3. Определить показатель преломления исследуемого раствора (n).
4. По рефрактометрической таблице определить % концентрацию раствора соответствующую этому показателю.
5. Если n отсутствует в таблице, рассчитайте концентрацию по формуле
n - n 0
C % =-------
F
Для этого вам необходимо с помощью рефрактометрической таблицы определить F.
6. Сделайте вывод, сравнив % концентрацию раствора, определенную по рефрактометру, с концентрацией на этикетке.
7. Оформить работу в дневниках для практических работ.
15. Задание: Определение процентного содержания в % растворов веществ неизвестной концентрации
Оформить результаты в таблице в дневниках для практических работ:
| Наименование раствора | n 0 | n | f | 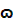 % %
|
Приложение 1
Схема оформления дневника практических работ
Таблица 1
Схема оформления дневника практических работ по разделу «Качественный анализ»
Дата Практическая работа № 1
Тема: «…………………………………………….»
| Название опыта | Уравнение реакции | Наблюдаемый эффект | Выводы |
Таблица 2
Схема оформления дневника практических работ по разделу «Количественный анализ»
Дата Практическая работа № 1
Тема: «…………………………………………….»
| Название задания | Метод количественного анализа, титрованный раствор, индикатор, точка эквивалентности, уравнение реакции, особые условия | Расчеты | Выводы |
Приложение 2
Классификация катионов
Таблица 1
| Номер группы, | Изучаемые катионы | Групповой реагент | Продукты реакции с групповым реагентом и аналитический эффект |
| I | Na+, K+, NH4+ | Нет | - |
| II | Ag+, Pb2+, Hg2+ | Раствор HCl | AgCl↓ l, PbCl↓2, Hg2Cl2 ↓ осадки белого цвета |
| III | Ca2+, Ba2+ | Раствор H2SO4 | CaSO4 ↓, BaSO4 ↓ осадки белого цвета |
| IV | Al3+, Zn2+ | Недостаток раствора NaOH (KOH) | Al(OH)3↓, Zn(OH)2↓ осадки белого цвета |
| V | Fe2+,Fe3+,Mg2+,Mn2+ | раствор NaOH и KOH | Fe(OH)2 ↓осадок зеленый, Fe(OH)3,↓осадок бурый, Mg(OH)2↓осадок белый, Mn(OH)2↓ осадок белый |
| VI | Cu2+,Hg2+ | Раствор NH4OH | (CuOH)2SO4↓осадок голубой, [Hg(NH2)]Cl↓осадок белый |
Приложение 3
Классификация анионов
Таблица 1
| Номер группы | Изучаемые анионы | Групповой реагент | Продукты реакции с групповым реагентом |
| I | SO32-, SO42-, СО32- С2O42-, CrO42-, ВО33-, В4О72-, S2O32-, PO43- | раствор BaCl2 | Все осадки белого цвета, кроме хроматов (желтого цвета) |
| II | Cl-Вr- I- | раствор AgNO3 | AgCl ↓ осадок белый творожистый) AgВr (осадок желтоватый) AgI (осадок желтый) |
| III | NO3- NO2- CH3COO- C6H5COO- C6H4OHCOO- | нет | --- |
Приложение № 4
Натрия хлорид
Натрия бромид
Натрия бензоат
| 1 | 1.3347 | 0.00170 | 1.3343 | 0.00130 | 1.3351 | 0.00211 |
| 2 | 1.3364 | 0.00170 | 1.3356 | 0.00130 | 13372 | 0.00211 |
| 3 | 1.3381 | 0.00170 | 1.3370 | 0.00133 | 1.3393 | 0.00210 |
| 4 | 1.3397 | 0.00170 | 1.3383 | 0.00133 | 1.3414 | 0.00210 |
| 5 | 1.3414 | 0.00170 | 1.3397 | 0.00134 | 1.3435 | 0.00210 |
| 6 | 1.3430 | 0.00170 | 1.3410 | 0.00133 | 1.3456 | 0.00210 |
| 7 | 1.3447 | 0.00170 | 1.3423 | 0.00133 | 1.3477 | 0.00210 |
| 8 | 1.3462 | 0.00165 | 1.3436 | 0.00133 | 1.3497 | 0.00209 |
| 9 | 1.3478 | 0.00164 | 1.3449 | 0.00132 | 1.3518 | 0.00209 |
| 10 | 1.3495 | 0.00165 | 1.3462 | 0.00132 | 1.3539 | 0.00209 |
| 11 | 1.3510 | 0.00164 | 1.3476 | 0.00133 | 1.3560 | 0.00209 |
| 12 | 1.3525 | 0.00162 | 1.3489 | 0.00133 | 1.3581 | 0.00209 |
| 13 | 1.3540 | 0.00160 | 1.3502 | 0.00132 | 1.3601 | 0.00208 |
| 14 | 1.3556 | 0.00160 | 1.3514 | 0.00131 | 1.3621 | 0.00208 |
| 15 | 1.3571 | 0.00160 | 1.3527 | 0.00131 | 1.3642 | 0.00208 |
| 16 | 1.3585 | 0.00160 | 1.3540 | 0.00131 | 1.3563 | 0.00206 |
| 17 | 1.3599 | 0.00160 | 1.3552 | 0.00130 | 1.3581 | 0.00208 |
| 18 | 1.3614 | 0.00160 | 1.3565 | 0.00130 | 1.3703 | 0.00207 |
| 19 | 1.3628 | 0.00160 | 1.3578 | 0.00130 | 1.3723 | 0.00207 |
| 20 | 1.3644 | 0.00157 | 1.3590 | 0.00130 | 1.3744 | 0.00207 |
| 21 | 1.3657 | 0.00156 | ||||
| 22 | 1.3672 | 0.00155 | ||||
| 23 | 1.3687 | 0.00151 | ||||
| 24 | 1.3700 | 0.00154 | ||||
| 25 | 1.3715 | 0.00154 |
|
Концент- Рация % |
Кальция хлорид |
Концент- Рация % |
Кальция хлорид | ||||
|
| f |
| f | ||||
| 1 | 1,3342 | 0,00120 | 39 | 1.3759 | 0.00110 | ||
| 2 | 1,3354 | 0,00120 | 40 | 1.3769 | 0.00109 | ||
| 3 | 1,3366 | 0,00120 | 41 | 1.3779 | 0.00109 | ||
| 4 | 1,3377 | 0,00117 | 42 | 1.3789 | 0.00109 | ||
| 5 | 1,3388 | 0,00116 | 43 | 1.3799 | 0.00109 | ||
| 6 | 1,3400 | 0,00116 | 44 | 1.3810 | 0.00109 | ||
| 7 | 1,3411 | 0,00116 | 45 | 1.3819 | 0.00109 | ||
| 8 | 1,3422 | 0,00115 | 46 | 1.3829 | 0.00108 | ||
| 9 | 1,3434 | 0,00115 | 47 | 1.3840 | 0.00108 | ||
| 10 | 1,3445 | 0,00115 | 48 | 1.3850 | 0.00108 | ||
| 11 | 1,3457 | 0,00115 | |||||
| 12 | 1.3469 | 0.00115 | |||||
| 13 | 1.3480 | 0.00115 | |||||
| 14 | 1.3491 | 0.00115 | |||||
| 15 | 1.3502 | 0.00115 | |||||
| 16 | 1.3514 | 0.00115 | |||||
| 17 | 1.3524 | 0.00114 | |||||
| 18 | 1.3536 | 0.00114 | |||||
| 19 | 1.3547 | 0.00114 | |||||
| 20 | 1.3556 | 0.00113 | |||||
| 21 | 1.3568 | 0.00113 | |||||
| 22 | 1.3580 | 0.00114 | |||||
| 23 | 1.3591 | 000113 | |||||
| 24 | 1.3601 | 0.00113 | |||||
| 25 | 1.3611 | 0.00112 | |||||
| 26 | 1.3623 | 0.00113 | |||||
| 27 | 1.3633 | 0.00112 | |||||
| 28 | 1.3643 | 0.00112 | |||||
| 29 | 1.3665 | 0.00112 | |||||
| 30 | 1.3666 | 0.00112 | |||||
| 31 | 1.3677 | 0.00112 | |||||
| 32 | 1.3688 | 0.00112 | |||||
| 33 | 1.3698 | 0.00111 | |||||
| 34 | 1.3708 | 0.00111 | |||||
| 35 | 1.3719 | 0.00111 | |||||
| 36 | 1.3729 | 0.00111 | |||||
| 37 | 1.3738 | 0.00110 | |||||
| 38 | 1.3749 | 0.00110 | |||||
Приложение 5
Таблица растворимости кислот, солей, оснований
Таблица 1
Обозначения : р - хорошо растворимый, м - малорастворимый, н - практически нерастворимый, + - полностью реагирует с водой или не осаждается из водного раствора, − - не существует, ? - данные о растворимости отсутствуют. | 
|
Приложение 6
Периодическая таблица Д.И. Менделеева
Таблица 1
| Пери- оды | I | II | III | IV | V | VI | VII | |||
VIII
2
гелий
He
4,0026
10
неон
Ne
20,179
18
аргон
Ar
39,948
36
криптон
Kr
83,80
54
ксенон
Xe
131,29
86
радон
Rn
[222]
*Лантаноиды
| 58 церий Ce 140,12 | 59 празеодим Pr 140,9077 | 60 неодим Nd 144,24 | 61 прометий Pm [145] | 62 самарий Sm 150,36 | 63 европий Eu 151,96 | 64 гадолиний Gd 157,25 | 65 тербий Tb 158,9254 | 66 диспрозий Dy 162,50 | 67 гольмий Ho 164,9304 | 68 эрбий Er 167,26 | 69 тулий Tm 168,9342 | 70 иттербий Yb 173,04 | 71 лютеций Lu 174.967 |
**Актиноиды
| 90 торий Th 232,0381 | 91 | 92 | 93 | 94 | 95 америций Am [243] | 96 кюрий Cm [247] | 97 берклий Bk [247] | 98 калифор-ний Cf [251] | 99 эйнштей-ний Es [252] | 100 фермий Fm [257] | 101 менделе-вий Md [258] | 102 нобелий No [255] | 103 лоуренсий Lr [260] | ||||
| s | p | d | f | ||||||||||||||
Приложение 7
Комплексонометрия
СПИСОК ЛИТЕРАТУРЫ
Обязательная литература
1. Ищенко, А.А. Аналитическая химия: учебник для учащ. сред. уч. завед. / А.А. Ищенко. – М.:ACADEMA, 2013. – 320c.
2. Келина, Н.Ю. Аналитическая химия в таблицах и схемах / Н.Ю. Келина, Н.В. Безручко. – Ростов н/Д: Феникс, 2008. – 374с.: ил. – (Среднее профессиональное образование).
3. Саенко, О.Е. Аналитическая химия: учебник для учащ. сред.уч. завед. / О.Е.Саенко. – Ростов-на-Дону.: Феникс, 2009. – 374с.
Дополнительная литература
1. Барсукова, З.А. Аналитическая химия: учебник / З.А. Барсукова. – М.: Высшая школа, 1990. – 319 с.
2. Лурье, Ю.Ю. Справочник по аналитической химии / Ю.Ю. Лурье. – М.: Химия, 1979. – 480с.
3. Основы аналитической химии: практическое руководство / под ред. Ю.А. Золотова. – М.: Высшая школа, 2005. – 464 с.
4. Пономарёв, В.Д. Аналитическая химия: учебник для учащ. мед. училищ / В. Д. Пономарёв. – М.: Высшая школа, 1982. – 303 с.
5. Практикум по аналитической химии / под ред В.Д. Пономарева, Л.И. Ивановой. – М.: Высшая школа, 1983. – 272 с.
6. Программа по аналитической химии с курсом инструментальных методов анализа для студентов фармацевтических вузов (факультетов) /сост.: Ю.Я. Харитонов, Л.И. Иванова. – М.: ГОУ ВУНМЦ МЗ РФ, 2006. – 27 с.
7. Харитонов Ю.Я. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ: учебник для вузов / Ю.Я.Харитонов. – М.: Высшая школа, 2007. – 615 с.
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания к практическим занятиям для студентов, получающих второе профессиональное образование
Иваново 2013
Негосударственное образовательное учреждение
Ивановский фармацевтический колледж

О.В. Куратова, И. Н. Фадеева
АНАЛИТИЧЕСКАЯ ХИМИЯ
Методические указания к практическим занятиям для студентов, получающих второе профессиональное образование
Иваново 2013
Методические указания к практическим занятиям по аналитической химии предназначены для студентов 3-го курса (специальность Фармация, второе профессиональное образование)
Методические указания одобрены Методические указания на заседании цикловых методических составлены в
комиссий общепрофессиональных соответствии с ФГОС
и специальных дисциплин СПО по специальности
Методические указания утверждены Фармация
на заседании Методического
совета колледжа
Составители:
Куратова О.В., преподаватель химических дисциплин высшей квалификационной категории Ивановского фармацевтического колледжа
Фадеева И.Н., преподаватель химических дисциплин первой квалификационной категории Ивановского фармацевтического колледжа
Рецензент:
Морозов Л.Н., доктор технических наук, профессор Ивановского химико-технологического университета
Методические указания рекомендованы к изданию Методическим советом Ивановского фармацевтического колледжа для использования в учебном процессе по специальности Фармация
СОДЕРЖАНИЕ
Введение………………………………………………………………………….......4
Инструкция по охране труда и технике безопасности ……………………………5
1. Качественный анализ
1.1. Основные понятия качественного анализа...…………………………….7
1.2. Практические задания по качественному анализу
1.2.1. Катионы I аналитической группы……………………………………….8
1.2.2. Катионы II аналитической группы…………………………………….9
1.2.3. Катионы III аналитической группы……………………………...........10
1.2.4. Катионы IV аналитической группы…………………………….............11
1.2.5. Катионы V аналитической группы…………………………………….12
1.2.6. Катионы VI аналитической группы……………………………………13
1.2.7. Анионы I аналитической группы………………………………..........14
1.2.8. Анионы II аналитической группы……………………………………..16
1.2.9. Анионы III аналитической группы…………………………………….17
1.2.10. Анализ неизвестного вещества……………………………………..18
2. Количественный анализ
2.1. Основные понятия количественного анализа…………………………20
2.2. Практические задания по количественному анализу
2.2.1. Методы кислотно-основного титрования…………………………….28
2.2.2. Методы окислительно-восстановительного титрования…………….30
2.2.3. Осадительное титрование. Аргентометрия……………………………31
2.2.4. Комплексонометрия. Трилонометрия…………………………………33
2.2.5. Физико - химические методы анализа. Определение процентной концентрации однокомпонентных веществ в растворе методом рефрактометрии…………………………………………………………34
Приложение 1. Схема оформления дневника практических работ……………..39
Приложение 2. Классификация катионов……………………………………......40 Приложение 3. Классификация анионов………………………….........................41
Приложение 4. Величины показателей преломления и факторы водных растворов веществ………………………………………………………………….42
Приложение 5. Таблица растворимости кислот, солей, оснований ………….44
Приложение 6. Периодическая система элементов Д.И. Менделеева………….45
Приложение 7. Методы титриметрического анализа………………………….46
Список литературы…………………………………………………………….....47
ВВЕДЕНИЕ
Данные методические указания к практическим занятиям по аналитической химии предназначены для студентов колледжа, получающих второе профессиональное образование по специальности Фармация.
Методические указания по аналитической химии созданы в помощь студентам для самоподготовки и выполнения практических работ и включают в себя следующие разделы:
- Введение.
- Инструкцию по охране труда и по технике безопасности.
- Основные понятия качественного анализа.
- Задания к практическим работам по качественному анализу.
- Основные понятия количественного анализа.
- Задания к практическим работам по количественному анализу.
- Приложения.
- Список литературы.
Приобретенные на занятиях общие и профессиональные компетенции в области химического анализа, способствуют формированию профессиональных компетенций в области контроля качества лекарственных веществ.
Для выполнения практической работы студент обязан подготовиться теоретически, чтобы на занятиях овладеть техникой выполнения качественного и количественного анализа, решать ситуационные задачи. Студент должен:
- уметь организовать рабочее место;
- соблюдать правила техники безопасности;
- овладеть техникой качественного и количественного анализа;
- грамотно пользоваться химической посудой и оборудованием химической лаборатории;
- работать с учебно-наглядными и методическими пособиями;
- решать ситуационные задачи.
По окончании занятия студент должен оформить дневник практических работ для закрепления полученных компетенций. Дневник необходимо оформить по определённой схеме (приложение №1).
Каждое практическое занятие оценивается преподавателем с учетом теоретической и практической подготовки студента.
Дата: 2019-02-19, просмотров: 438.