Цель: Овладеть навыками титриметрического анализа методом комплексонометрии
Коплексонометрическое титрование (или комплексонометрия) основано на образовании прочных комплексных соединений хелатного типа ионов металлов с Трилоном Б. В качестве индикатора используют кислотный хром тёмно-синий. Титрование проводят в аммиачно-буферной среде. Определяют количественное содержание солей двухвалентных металлов (кальция, магния, цинка и др.)
11. Задание: Определение массовой доли цинка сульфата в растворе.
Методика: В колбу для титрования поместить 1 мл раствора ZnSO4, 5 мл воды, 2 мл аммиачного буферного раствора и несколько крупинок индикатора кислотного хрома темно-синего, титровать 0,1 М раствором Трилона Б до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании:
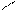 СН2-СООNа
СН2-СООNа
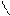 СН2 - N
СН2 - N
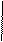 СН2-СООН + ZnSO4=
СН2-СООН + ZnSO4=
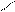 СН2- СООН
СН2- СООН
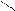 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчеты: определить титр и массовую долю цинка сульфата в растворе.
12. Задание: Определение массовой доли кальция хлорида в растворе.
Методика: В колбу для титрования поместить 1 мл раствора кальция хлорида, 1 мл аммиачного буферного раствора, несколько крупинок индикатора кислотного хрома темно-синего, титровать до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании:
 СН2-СООNа
СН2-СООNа
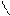 СН2 - N
СН2 - N
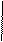 СН2-СООН + СаСl2 =
СН2-СООН + СаСl2 =
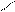 СН2- СООН
СН2- СООН
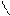 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчет: определить титр и массовую долю кальция хлорида в растворе.
Задание: Определение массовой доли магния сульфата в растворе.
Методика: В колбу для титрования поместить 1 мл раствора магния сульфата, 1 мл аммиачного буферного раствора, несколько крупинок индикатора кислотного хрома темно-синего, титровать до перехода окраски из красной-фиолетовой в сине-фиолетовую. Титровать до трех сходящихся результатов.
1. Дописать уравнение реакции происходящей при титровании.
 СН2-СООNа
СН2-СООNа
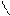 СН2 - N
СН2 - N
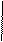 СН2-СООН + MgSO4 =
СН2-СООН + MgSO4 =
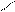 СН2- СООН
СН2- СООН
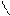 СН2 - N
СН2 - N
СН2-СООNа
2. Выполнить расчет: определить титр и массовую долю магния сульфата в растворе.
2.2.5. Тема: Физико - химические методы анализа. Определение процентной концентрации однокомпонентных веществ в растворе методом рефрактометрии.
Цель: Овладеть навыками работы с рефрактометром и определения концентрации веществ методом рефрактометрии
Дата: 2019-02-19, просмотров: 368.