Перед самым началом Второй мировой войны были обнаружены родоначальники очень представительной группы антимикробных лекарственных веществ, содержащих пара-аминосульфаниламидный фармакофор. Свойства поражать стрептококковые бактерии наблюдали прежде всего у красного азакрасителя (13), который назвали "красным стрептоцидом". Позднее было установлено,

что это вещество не являлось лекарством, а было пролекарством, так как действующим началом оказался его метаболит (14) - сульфамоилфениламинометилсульфонат натрия, представляющий собой водорастворимую форму «белого» (т.е., не имеющего окраску) стрептоцида (15).
Производят стрептоцид 15 из анилина. Сначала в анилине защищают
аминогруппу, переводя ее в карбаматную (соединение 16). Затем действием хлорсульфоновой кислоты получают сульфонилхлорид (17), который обрабатывают

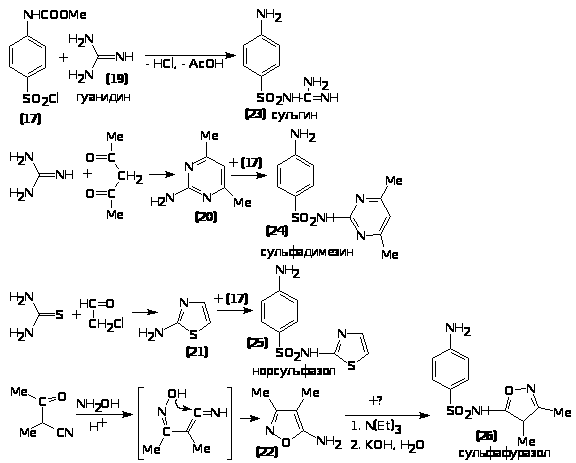
аммиаком. В полученном таким образом сульфонамиде (18) гидролизом регенерируют для свободную аминогруппу. Было синтезировано несколько десятков тысяч производных стрептоцида 15, из которых в практику внедрено более 30 лекарственных веществ. Модификации структуры проводились главным образом по двум аминогруппам и приводили к заметным изменениям фармакологической картины биодействия получаемых производных, что позволяло конкретизировать пути их применения (при инфекциях желудочно-кишечного тракта, мочевых путей, глазных и др. болезнях),улучшить их проникание в биожидкости, ткани, через клеточные мембраны, а также пролонгировать действие лекарственных веществ. Следует отметить, что перемещение в фармакофоре аминогруппы из положения 4 в положение 2 или 3, а также ее замена на любой безазотистый заместитель ведет к исчезновению биоактивности. Введение заместителей в сульфамоильную группу изменяет токсичность лекарственного вещества. Ниже представлена схема синтеза четырех лекарстенных веществ сульфаниламидной серии - сульгина (23), сульфадимезина (24), норсульфазола (25) и сульфафуразола (26), получаемых типичной конденсацией ароматического сульфонилхлорида 17 с различными аминными компонентами (19-22).
Механизм антибактериального действия сульфаниламидов хорошо изучен. Известно, что микроорганизмы в своем развитии синтезируют фолиевую кислоту (27, витамин ВС), которая контролирует биосинтез аминокислот, пуриновых и пиримидиновых оснований. Структура нормальной фолиевой кислоты содержит

фрагмент пара-аминобензойной кислоты. Однако фермент, осуществляющий синтез этого витамина в присутствии лекарственного вещества, вместо аминобензойной кислоты использует ее имитатор - антагонистический сульфаниламидный фрагмент. В результате микроорганизм синтезирует псевдофолиевую кислоту (28), что блокирует образование дигидро- и тетрагидрофолиевых кислот - нормальных метаболитов. В целом нарушается синтез нуклеиновых кислот и клеточных белков, что и лежит в основе бактериостатического и бактерицидного действия лекарственного вещества. Эти препараты не действуют подобным образом на клетки человека, т.к. его организм не вырабатывает витамины, а получает их с пищей.
Изучение побочных эффектов сульфаниламидных антибиотиков и синтез их многочисленных структурных аналогов привели к открытию среди них диуретиков и антидиабетических средств. Так, нуклеофильным замещением одного из двух атомов хлора в кислоте (29) первичным амином (30) (региоселективность этой реакции диктуется, по-видимому, стерическими затруднениями, создаваемыми сульфамоильным заместителем) получен фуросемид (31), обладающий

диуретическими и антигипертензивными свойствами. Аналогичным биодействием обладает ряд дисульфамидов (например, 35 и 36), в которых вторая сульфамидная группа формирует тиадиазиновое ядро. Их синтезируют введением двух сульфамоильных групп действием хлорсульфоновой кислоты на мета-хлоранилин (32). Дисульфаниламид (33) затем нагревают в муравьиной кислоте, что приводит к N-формиланилину (34), который циклизуют при нагревании в бензо-1,2,4-тиадиазин (хлортиазид, 35). При его гидрировании над катализатором или с помощью натрийборогидрида в водно-щелочной среде получают другой диуретик - гидрохлортиазид (36). Установлено, что обязательным для диуретиков этого типа

является наличие сульфамидной группы при С-7 (в пара-положении к аминной группе, что роднит их структурно с антимикробными сульфаниламидами), а также присутствие хлора (или нитрогруппы, или трифторметильной группы) при С-6. Введение в положение С-3 циклоалкильного радикала заметно усиливает полезный биоэффект, а наличие заместителей при N-4 или С-8 полностью дез-
активирует молекулу. Следует отметить, что сульфамиды 31, 35 и 36 нашли широкое применение в медицине.
В середине 50-х годов найдены аналоги сульфаниламидов, проявляющие гипогликемические (антидиабетические, сахароснижающие) свойства. К настоящему времени созданы и испытаны многие десятки тысяч подобных соединений и показана решающая роль арилсульфуреидного фармакофора для проявления указанного лечебного действия. Препараты (37-40) получают из алкил- и пиперидилалкилов (17а) через изоцианаты (37б). Например, карбутамид 37 синтезируют нагреванием н-бутилизоцианата с метилкарбанилатом фенилсульфонамида 18, а в случае синтеза толбутамида 38 - с тозилатом натрия. Аналогичным путем получают толазамид 39 и хлорпропамид 40.

Оксопроизводные нафталина. Витамин К1. Оксолин.
К классу алкилированных производных 1,4-нафтохинона принадлежит витамин К1 (2-метил-3-фитил-1,4-нафтохинон) (16). Он обладает коагуляционным и антигеморрагическим действием и применяется при лечении кровотечений, вызванных плохой свертываемостью крови, заболеваниями печени и желудочно-кишечного тракта. В большом количестве находится в зеленых листьях шпината и цветной капусты. В природном витамине содержится только транс-изомер, а в синтетическом - он преобладает. Синтез его осуществляют в 20 стадий. Ключевой ароматический фрагмент (4) готовят окислением 2-метилнафта-лина (1) до нафтохинона (2) (также проявляющим витаминные свойства, витамин К3), который восстанавливают до диола и ацилируют последний в диацетат (3).

Частичным гидролизом диацетат 3 превращают в моно-ацетилпроизводное 4, которое затем алкилируют ненасыщенным спиртом - изофитолом (14) (схема его синтеза приведена отдельно). Полученное таким образом соединение (15) на последних двух стадиях синтеза витамина 16 гидролизуют (для снятия ацильной защиты) и окисляют гидроксигруппы в кетонные 16.
Терпеновый спирт изофитол 14 получают в промышленности по нижеприведенной схеме на основе превращений ацетилена, ацетона, дикетена, метилизопропенилового эфира и их производных. При этом в основном используют

типичные реакции, рассмотренные ранее при синтезе витамина А.
Среди синтетических производных нафталина широкую известность приобрел оксолин (20) как профилактическое средство борьбы с гриппом и для лечении вирусных заболеваний глаз и кожи. Его получают, окисляя гидрохлорид 1-аминонафтола-2 (17) в присутствии FeClз до 1,2-нафтохинона (18), который далее окисляют гипохлоритом натрия в 3,4-дигидроксинафтохинон (19). На последней стадии окислителем служит хлор, с помощью которого дегидрируют субстрат 19 до оксолина 20.

К полиядерным конденсированным производным нафталина можно условно отнести антибиотики группы тетрациклина (21-24). Они обладают широким спектром действия на грамположительные и грамотрицательные бактерии, спирохеты, крупные вирусы. Назначают их при бронхитах, пневмонии, тифе и др. заболеваниях. Некоторые антибактериальные лекарственные вещества, содержащие антрахиноновый фрагмент (например, антрациклины 23 и 24), обладают

способностью алкилировать ДНК, встраиваться в них или разрывать ДНК, прерывая их биосинтез. Рубомицин 23 и адриамицин 24 используют при лейкозах, саркомах, раке матки, молочной и щитовидной желез, мочевого пузыря. Производят тетрациклиновые и антрациклиновые антибиотики биотехнологическим методом на культурах плесневых грибков или химическим модифицированием природных соединений.
Дата: 2019-02-25, просмотров: 486.