CaNa3ДТПА Na2CaЭДТА

46.Окислительно-восстановительные (редокс) реакции. Окислители и восстановители. Сопряженные окислительно- восстановительные пары. (редокс- системы). Механизм возникновения электродного потенциала. Уравнение Нернста, его анализ. Стандартный электродный потенциал.
Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода:Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота(инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение(Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:Aox + n·e− → Ared,
Окислительно-восстановительный потенциал. Основными процессами, обеспечивающими жизнедеятельность любого организма, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза
(жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессов жизнедеятельности организма соответственно в настоящем и будущем.
Электродные потенциалы и механизмы их возникновения. Для определения направления и полноты протекания окислительно-восстановительных реакций между окислительно-восстановительными системами в водных растворах используются значения электродных потенциалов этих систем. Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией. Сочетая электрод, представляющий исследуемую окислительно-восстановительную систему, со стандартным водородным электродом, определяют электродный потенциал Е данной системы. Для того, чтобы можно было сравнивать окислительно-восстановительные свойства различных систем по их электродным потенциалам, необходимо, чтобы последние также были измерены при стандартных условиях. Таковыми обычно являются концентрация ионов, равная 1 моль/л, давление газообразных веществ 101,325 кПа и температура 298,15 К. Потенциалы, измеренные в таких условиях, носят название стандартных электродных потенциалов и обозначаются Ео. Они часто называются также окислительно-восстановительными или редокс-потенциалами, представляя собой разность между редокс-потенциалом системы при стандартных условиях и потенциалом стандартного водородного электрода.. Стандартный электродный потенциал – это потенциал данного электродного процесса при концентрациях всех участвующих в нем веществ, равных единице. Стандартные электродные потенциалы окислительно-восстановительных систем приводятся в справочной литературе. Эти системы записаны в форме уравнений полуреакций восстановления, в левой части которых находятся атомы, ионы или молекулы, принимающие электроны (окисленная форма) Электрохимический ряд напряжений характеризует свойства металлов в водных растворах: чем меньше электродный потенциал металла, тем легче он окисляется и труднее восстанавливается из своих ионов; металлы, имеющие отрицательные электродные потенциалы, т.е. стоящие в ряду напряжений левее водорода, способны вытеснять его из разбавленных растворов кислот; каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые имеют более высокий электродный потенциал. При условиях, отличающихся от стандартных, численное значение равновесного электродного потенциала для окислительно-восстановительной системы, записанной в форме , определяется по уравнению Нернста: 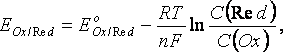 где
где 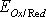 и
и 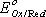 - соответственно электродный и стандартный потенциалы системы; R – универсальная газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея; n – число электронов, участвующих в окислительно-восстановительном процессе.С(Red) и C(Ox) – молярные концентрации соответственно восстановленной и окисленной форм соединения. Например, для окислительно-восстановительной системы
- соответственно электродный и стандартный потенциалы системы; R – универсальная газовая постоянная; Т – абсолютная температура; F – постоянная Фарадея; n – число электронов, участвующих в окислительно-восстановительном процессе.С(Red) и C(Ox) – молярные концентрации соответственно восстановленной и окисленной форм соединения. Например, для окислительно-восстановительной системы 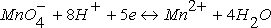 уравнение Нернста имеет вид
уравнение Нернста имеет вид 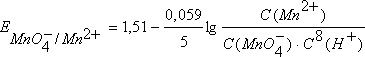
47.Механизм возникновения редокс-потенциала. Уравнения Нернста-Петерса, его анализ. Стандартный окислительно –восстановительный (редокс-) потенциал. Сравнительная сила окислителей и восстановителей. Прогнозирование направления редокс-процессов по величинам редокс-потенциалов. Константа окислительно – восстановительного процесса .
Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода:Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота(инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение(Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:Aox + n·e− → Ared,
Окислительно-восстановительный потенциал. Основными процессами, обеспечивающими жизнедеятельность любого организма, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза
(жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессов жизнедеятельности организма соответственно в настоящем и будущем.
При не стандартных условях значение восстановительного потенциала с учетом влияния природы окислительно-восстановительной пары, температуры, и активности компонентов в растворе вычисляют:

Стандартный ОВП Если потенциал исследуемой окислительно-восстановительной пары измерен в стандартизированных условиях – температура 25ᵒС (298 K), давление 1 атм (101,3 кПа) и активности окисленной и восстановленной форм равны единице (аок = авос = 1 моль/л), то его называют «стандартный окислительно-восстановительный потенциал» и обозначают: Е0ок/вос.
Чем больше окислительно-восстановительный потенциал Е0Ок/Вос, тем окисленная форма является более сильной, соответственно, восстановленная форма обладает более слабой функцией восстановления. И наоборот, чем меньше Е0Ок/Вос, тем сильнее восстановленная форма. Положительный знак потенциала указывает на самопроизвольное протекание реакции восстановления в паре со СВЭ, отрицательный – на самопроизвольное протекание реакции окисления. Потенциалы сильных окислителей будут всегда положительны, а сильных восстановителей – отрицательны.
Окислителями называются вещества или частицы, принимающие электроны от других веществ или частиц — восстановителей. Окисленную и восстановленную форму одного и того же вещества называют редокс-системой (редокс-парой). Для протекания окислительно-восстановительной реакции (редокс-реакции) необходимо наличие как минимум двух веществ, относящихся к разным редокс-системам. В ходе окислительно-восстановительной реакции окислитель (Ох1) превращается в сопряженный восстановитель (Red1), а восстановитель (Red2) - в сопряженный окислитель (Ох2).
КОНСТАНТА РАВНОВЕСИЯ.
Если возникает необходимость определения степени протекания реакции, то можно воспользоваться константой равновесия.
Например, для реакции
Zn + Cu2+ = Zn2+ + Cu
Применяя закон действующих масс, можно записать
K = CZn2+/CCu2+
Здесь константа равновесия К показывает равновесное соотношение концентраций ионов цинка и меди.
Значение константы равновесия можно вычислить, применив уравнение Нернста
E = E° + (0,059/n)lg(Cок/Cвос)
Подставим в уравнение значения стандартных потенциалов пар Zn/Zn2+ и Cu/Cu2+, находим
E0Zn/Zn2+ = -0,76 + (0,59/2)lgCZn/Zn2 и E0Cu/Cu2+ = +0,34 + (0,59/2)lgCCu/Cu2+
В состоянии равновесия E0Zn/Zn2+ = E0Cu/Cu2+, т.е.
-0,76 + (0,59/2)lgCZn2 = +0,34 + (0,59/2)lgCCu2+, откуда получаем
(0,59/2)( lgCZn2 — lgCCu2+) = 0,34 – (-0,76)
lgK = lg (CZn2+/CCu2+) = 2(0,34 – (-0,76))/0,059 = 37,7
K = 1037,7
Значение константы равновесия показывает, что реакция идет практически до конца, т.е. до того момента, пока концентрация ионов меди не станет в 1037,7 раз меньше, чем концентрация ионов цинка.
Константа равновесия и окислительно-восстановительный потенциал связаны общей формулой:
lgK = (E10 -E20 )n/0,059, где
K — константа равновесия
E10 и E20 – стандартные потенциалы окислителя и восстановителя соответственно
n – число электронов, отдаваемых восстановителем или принимаемых окислителем.
Если E10 > E20, то lgK > 0 и K > 1. Следовательно, реакция протекает в прямом направлении (слева направо) и если разность (E10 — E20) достаточно велика, то она идет практически до конца.
Напротив, если E10 < E20, то K будет очень мала. Реакция протекает в обратном направлении, т.к. равновесие сильно смещено влево. Если разность (E10 — E20) незначительна, то и K ≈ 1 и данная реакция не идет до конца, если не создать необходимых для этого условий.
Зная значение константы равновесия, не прибегая к опытным данным, можно судить о глубине протекания химической реакции. Следует иметь ввиду, что данные значений стандартных потенциалов не позволяют определить скорость установления равновесия реакции.
По данным таблиц окислительно-восстановительных потенциалов возможно найти значения констант равновесия примерно для 85000 реакций.
48.Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий. Общие представления о механизме действия редокс-буферных систем.
В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие, разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются три молекулы АТФ. Значительная часть свободной энергии, выделяющейся при переносе одной пары электронов, запасается в молекулах АТФ.
Чем больше величина редокс-потенциала, тем сильнее окислитель и слабее сопряженный ему восстановитель. Сильный окислитель вступает в реакции с большим числом восстановителей, чем слабый, и/или вызывает более глубокое окисление восстановителей.
49.Токсическое действие окислителей (нитраты, нитриты, оксиды азота). Обезвреживание кислорода, пероксида водорода и супероксид-иона. Применение редокс-реакций для детоксикации.
Токсическое действие оксидов азота связано с их высокой окислительно-восстановительной способностью.
Токсическое действие нитратов связано с восстановлением их до нитритов, аммиака, гидроксиламина под влиянием микрофлоры пищеварительного тракта и тканевых ферментов. Если в организм человека поступают высокие дозы нитратов, через 4–6 ч появляются тошнота, одышка, посинение кожных покровов, диарея.
В зависимости от дозы нитратов, поступающих в организм, отмечают патоморфологические изменения разной степени: некроз или зернистая дистрофия в сильной степени в печени, почках, миокарде.
Биологическое окисление протекает по сложным механизмам при участии большого числа ферментов. В митохондриях окисление происходит в результате переноса электронов от органических субстратов -интермедиатов на элементный кислород, который при этом восстанавливается до воды:
1/2O2 + 2H+ +2e - = H2O
ОБЕЗВРЕЖИВАНИЯ КИСЛОРОДА В ЭРИТРОЦИТАХ
Высокое содержание О2 в эритроцитах является причиной образования большого количества его активных форм. Постоянным источником активных форм кислорода в эритроцитах является неферментативное окисление гемоглобина в метгемоглобин: 1). Hb (Fe2+) ® MetHb (Fe3+) +e- 2). e- + O2→О∙2
Также СРО в эритроците стимулируют различные окислители - нитраты, сульфаниламиды, противомалярийное лекарство примахин.
Образующиеся активные формы кислорода запускают реакции СРО, которые приводят к разрушению липидов, белков, углеводов и др. органических молекул, являются причиной старения и гибели эритроцита.
Для сдерживания СРО в эритроците функционирует ферментативная антиоксидантная система. Для ее работы необходим глутатион и НАДФН2.
Супероксиддисмутаза (Cu2+ и Zn2+) превращает супероксидные анионы в перекись водорода: 2О∙2 + 2H+ → H2O2+ O2
Каталаза - геминовый фермент, разрушает перекись водорода до воды и кислорода: 2Н2О2 → H2O+ O2
Глутатионпероксидаза (селен) при окислении глутатиона разрушает перекись водорода и гидроперекиси липидов до воды:
Н2О2 + 2 GSH → 2 Н2О + G-S-S-G.
Глутатионредуктаза восстанавливает окисленный глутатион с участием НАДФН2:
GS-SG + НАДФН2→ 2 GSH + НАДФ+.
Недостаток в эритроцитах восстановленного глутатиона и НАДФН2 приводит к снижению АОА, активации ПОЛ и может стать причиной гемолитической анемии. Различные окислители - нитраты, сульфаниламиды, противомалярийное лекарство примахин, усиливают гемолиз эритроцитов.
Дефицит восстановленногоглутатиона может быть обусловлен действием токсических веществ, например ионами тяжелых металлов или наследственным недостатком глутатионредуктазы.
Дефицит НАДФН2 возникает при наследственной недостаточности (аутосомно-рецессивный тип) первого фермента ПФШ глюкозо–6–фосфатдегидрогеназы. Не менее 100 млн человек являются носителями около 3000 генетических дефектов глюкозо-6-фосфатдегидрогеназы.
Для оценки эффективности работы антиоксидантных систем определяют перекисную резистентность эритроцитов.
50.Адсорбционные равновесия и процессы на подвижных границах раздела фаз. Поверхностная энергия Гиббса и поверхностное натяжение. Механизм возникновения свободной поверхностной энергии Гиббса на границе раздела фаз жидкость-газ. Сорбция и ее виды.

Адсорбция - поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты кусочек угля, то произойдёт А. — количество кислоты в растворе уменьшится, молекулы кислоты сконцентрируются на поверхности угля.
Адсорбция и абсорбция — поглощение в объёме тела, объединяются общим термином сорбция. Явление А. тесно связано с особыми свойствами вещества в поверхностном слое. Например, молекулы, лежащие на поверхности раздела фаз жидкость — пар, втягиваются внутрь жидкости, т. к. испытывают большее притяжение со стороны молекул, находящихся в объёме жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше концентрации жидкости. Это внутреннее притяжение заставляет поверхность сокращаться и количественно характеризуется поверхностным натяжением. По той же причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности, притянутся к ней и произойдёт А. После А. внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя и поверхностное натяжение уменьшается.
Изотерма адсорбции - зависимость адсорбции от равновесной концентрации растворенного вещества при  постоянной температуре.
постоянной температуре.
Поверхностно-неактивные вещ-ва (адсорбирующие отрицательно) либо не изменяют коэффициент поверхностного натяжения водной фазы, либо незначительно его увеличивают.(большинство неорганический вещ-в: кислоты, щелочи, соли) Мера адсорбции-Г(гамма)ед. изм.-моль\м2.
Уравнение Гиббса: Г=-Сср/RT Х ср. ро/ср. С
При малых концентрациях пав углеводородные радикалы лежат на поверхности полярной жидкости, а полярные группировки погружены в нее. С увеличением конц. Пав в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит в пределе к образованию на граничной поверхности насыщенного мономолекулярного адсорбционного слоя, а котором молекулы пав предельно ориентированы.-это слой Ленгмюра.
51.Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. Поверхностная активность, положительная и отрицательная адсорбция
Адсорбция - поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела.
Уравнение Гиббса: Г=-Сср/RT Х ср. ро/ср. С
Гиббс вывел формулу, связывающую значение А. с изменением поверхностного натяжения. Те вещества, А. которых сильно уменьшает поверхностное натяжение, принято называть поверхностно-активными (дифильные и ассиметричные, одноатомные спирты, одноосновные карбоновые кислоты, амины, эфиры). Адсорбция может быть положительной или отрицательной. При внесении в какой-либо раствор адсорбента будут поглощаться растворитель и растворенное вещество. Если поглотится больше растворителя, чем растворенного вещества, т. е. если повысится концентрация раствора, то адсорбция будет отрицательной. Если, наоборот, поглотится больше растворенного вещества, то адсорбция будет положительной. Отрицательной адсорбцией обладают, например, сахара и многие неорганические соли при сравнительно высоких концентрациях. Такие же свойства присущи всем органическим соединениям, содержащим много гидроксильных ионов (ОН). Но веществ, обладающих отрицательной адсорбцией, значительно меньше, чем веществ с положительной адсорбцией. К последним относятся некоторые краски, алкалоиды, органические кислоты, простейшие спирты. В природе есть вещества поверхностно-неактивные. Так, поваренная соль, растворенная в воде, почти не изменяет поверхностного натяжения. Поэтому она плохо адсорбируется коллоидами. Явления адсорбции в почвенных процессах имеют большое значение. Например, состав воздуха почвы несколько иной, чем атмосферы. Он различен и в обособленных порах почвы. Поэтому корни растений могут найти нужную для них концентрацию и состав воздуха, а микробы — лучшие условия для существования. В минеральных солях, прошедших через почву, изменится соотношение катионов и анионов, что дает возможность регулировать их содержание. Явление адсорбции может играть в жизни растений не только положительную, но и отрицательную роль, например при адсорбции ядов.
51.Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. Поверхностная активность, положительная и отрицательная адсорбция.

Адсорбция может быть положительной или отрицательной. При внесении в какой-либо раствор адсорбента будут поглощаться растворитель и растворенное вещество. Если поглотится больше растворителя, чем растворенного вещества, т. е. если повысится концентрация раствора, то адсорбция будет отрицательной. Если, наоборот, поглотится больше растворенного вещества, то адсорбция будет положительной.
Отрицательной адсорбцией обладают, например, сахара и многие неорганические соли при сравнительно высоких концентрациях.
52.Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Изотерма адсорбции. Ориентация молекул в поверхностном слое и структура биомембран.
ПАВ –поверхностно активные вещества, понижают поверхностное натяжение растворителя. Молекула ПАВ это вещество дифильной (двоякой) природы имеющие гидрофильную (полярную) головку (-COOH; -OH; -NH2), и гидрофобный (неполярный) хвост (углеводородный радикал.
Виды ПАВ: органические соединения: спирты, кислоты алифатического ряда и их соли (мыла, сложные эфиры, амины, белки, фосфолипиды )
1. Анионактивные ПАВ, полярная группа –кислотная (соли высших карбоновых кислот)
2. Катионактивные ПАВ, полярная группа – катион (соли тетраалкиламмония)
3. Неионогенные ПАВ (полиоксиэтиленовые производные спиртов, кислот, фенолов)
ПНВ-поверхностно-неактивные вещества, не изменяют поверхностное натяжение. Например, сахароза.
Поверхностно-неактивные вещества обладают следующими характерными особенностями: а) обладают большим по сравнению с растворителем поверхностным натяжением; б) имеют более высокую растворимость.
Правило Дюкло-Траубе:
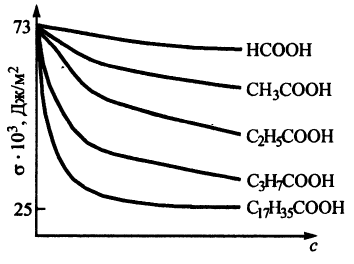
Поверхностная активность ПАВ одного и того же гомологического ряда в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в 3-3,5 раза при увеличении углеводородной цепи на группу СН2.
Пример: изотермы поверхностного натяжения для водных растворов карбоновых кислот.
Из рисунка видно: чем длинней углеводородная цепь, тем эффективней снижается
поверхностное натяжение водного раствора с ростом концентрации ПАВ
. 
Изотерма адсорбции – функциональная зависимость количества адсорбированного поверхностью вещества от давления или концентрации этого вещества в другой фазе Г=f(p)T=const, Г=f(с)T=const .При монослойной локализованной адсорбции на однородной поверхности Г=f(p) описывается изотермой Ленгмюра.
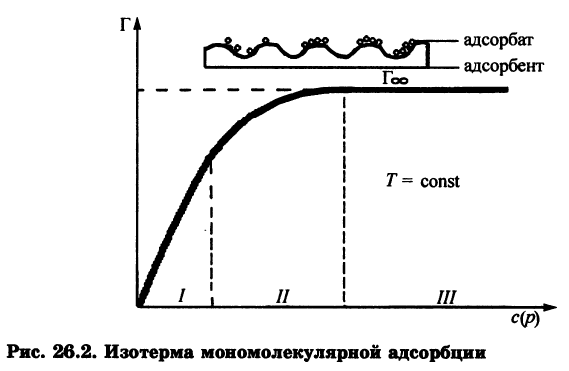
Ориентация молекул в поверхностном слое и структура биомембран.
Поскольку только полярная головка ПАВ растворима в воде, а гидрофобный хвост нет, то такие молекулы выталкиваются на поверхность, где и накапливаются - это пример положительной адсорбции. Пределом такой адсорбции служит полное насыщение поверхностного слоя адсорбируемыми веществами. Если вещество увеличивает поверхностное натяжение, то оно втягивается во внутренние слои жидкости. Это отрицательная адсорбция, поскольку поверхностные слои обедняются растворенным веществом. Лэнгмюр выдвинул предположение, что при максимальных величинах сорбции поверхность раствора покрыта слоем толщиной в одну молекулу ПАВ (мономолекулярным слоем), гидрофобные хвосты молекул ПАВ направлены перпендикулярно поверхности, образуя подобие частокола. При вертикальной ориентации длина цепи молекулы не влияет на площадь, занятую молекулой в поверхностном слое.
53.Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твердых телах , факторы, влияющие на этот процесс. Уравнение Ленгмюра, его анализ.
Вещество, на поверхности которого происходит Адсорбция, называется адсорбентом, а поглощаемое из объёмной фазы — адсорбатом. В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы между физикой А. и хемосорбцией.
Адсорбированные молекулы рано или поздно покидают поверхность молекулы — десорбируются. Время, в течение которого молекула находится на поверхности, называется временем Адсорбции Времена А. могут колебаться в очень широких пределах. Скоростью А. (соответственно скоростью десорбции) называется количество молекул, адсорбирующихся (или десорбирующихся) за единицу времени, оба значения величин относят к единице поверхности или массы адсорбента. Скорость хемосорбции, как и скорость любого химического процесса, чаще всего увеличивается с повышением температуры. Если скорости А. и десорбции равны друг другу, то говорят, что установилось адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остаётся постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.).
Уравнение Ленгмюра :
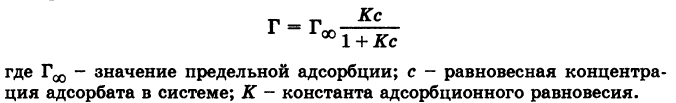
Теория адсорбции Ленгмюра:
1. Частицы вещества располагаются только на активных центрах адсорбента.
2. Каждая частица адсорбата занимает 1 активный центр адсорбента.
3. Адсорбция заканчивается образованием мономолекулярного слоя.
4. Процесс адсорбции обратимый
5. Через некоторое время адсорбированные молекулы покидают активные центры и их место занимают активные молекулы.
6. Допускается, что взаимодействие между адсорбированными молекулами отсутствует.
Адсорбция газов на твердом адсорбенте зависит от следующих факторов:
1. природы и площади поверхности адсорбента
2. природы поглощаемого газа или пара
3. концентрации или давления газа или пара
4. температуры
54. Адсорбция из растворов .Правило выравнивания полярностей. Избирательная адсорбция. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов
Молекулярная адсорбция заключается в конкуренции между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента.
При молекулярной адсорбции природа растворителя должна сильно отличаться от природы растворенного вещества природы адсорбента. Другими словами: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
Также при повышении температуры адсорбция веществ из растворов обычно уменьшается.
Влияние природы поглощаемого вещества определяется несколькими правилами:
Во-первых правилом "подобное взаимодействует с подобным".
Во-вторых, правилом Шилова: чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
Правило Ребиндера: на поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает.
Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны: включают гидрофильную (полярную) головку и гидрофобный (неполярный) хвост. При наличии в растворе вещества, молекулы которого дифильны, будет происходить их эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент всегда обращен к полярной фазе, а неполярный фрагмент- к неполярной фазе.
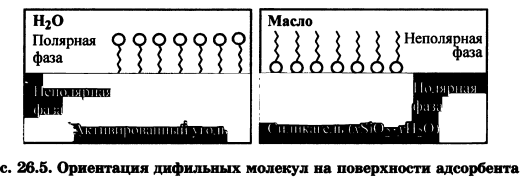
Ионная адсорбция заключается в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т.е. на полярных адсорбентах.
При ионной адсорбции на поверхности адсорбента вследствие адсорбции ионов, называемых потенциалопределяющими, возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы - противоионы; в результате на границе раздела фаз возникает двойной электрический слой. Скорость ионной адсорбции меньше скорости молекулярной адсорбции, так как скорость диффузии сольватированных ионов меньше скорости диффузии молекул и, кроме того, адсорбции ионов предшествует более медленный, чем у молекул, процесс десольватации.
Ионная адсорбция не всегда обратима, так как она может сопровождаться хемосорбцией, приводящей, например, к образованию малорастворимого вещества.
Ионная адсорбция зависит от следующих факторов:
1. Радиуса иона: чем больше радиус, тем лучше ион адсорбируется.
2. От заряда иона: чем больше заряд, тем лучше адсорбируется.
3. От степени ионизации и гидратации.
4. От Рн среды
В животных организмах явления адсорбции также играют очень большую роль в их жизнедеятельности. Роль адсорбции обусловлена наличием в организме огромного количества самых разнообразных поверхностей раздела - стенок сосудов, поверхности клеток, клеточных ядер и вакуолей, коллоидных частиц протоплазмы и, наконец, поверхности раздела между организмом и средой. Особенно важную функцию выполняет поверхность раздела между организмом и средой для низших организмов и организмов, живущих в воде, так как ей принадлежит существенная роль в процессах питания и обмена веществ. Исследования последних лет показали, что пищевые вещества, как правило, являются поверхностно-активными веществами, и потому первым этапом их усвоения является адсорбция, а процесс их химического превращения уже вторичен.
Исследования показали, что эритроциты являются переносчиками различных веществ, в том числе аминокислот, которые они разносят и передают клеткам и различным тканям организма. Количество эритроцитов в крови взрослого человека примерно 5 000 000 в 1 нм3. У здорового мужчины в среднем на 1 кг массы приходится 450 миллиардов эритроцитов, 27 триллионов на весь организм. Учитывая, что диаметр эритроцита 7—8 мкм, можно легко подсчитать, что общая поверхность эритроцитов всей крови человека составит примерно 3200 м2.
Большинство реакций, протекающих в организме, совершается при непосредственном участии ферментов-катализаторов. Исследования показали, что первые стадии действия любого фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие.
Гемосорбция - метод лечения, направленный на удаление из крови различных токсичных продуктов и регуляцию гомеостаза путем контакта крови с сорбентом вне организма.
При контакте крови с гемосорбентом наблюдается конкуренция за активные центры между веществами, подлежащими удалению, и веществами, наличие которых обеспечивает жизненно необходимые функции. Использование неспецифических сорбентов делает процедуру гемосорбции практически неуправляемой, так как при этом удаляются и токсиканты, и вещества, находящиеся в плазме в норме. Эффективность этого метода лечения в настоящее время связана с созданием высокоспецифичных сорбентов конкретных метаболитов, ионов, токсинов.
Важной проблемой гемосорбции является создание сорбентов, совместимых с кровью (гемосовместимых сорбентов). Разработана методика гемосорбции с наложенным электрическим потенциалом, что обеспечивает ускорение процесса.
55. Дисперсные системы. Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Природа коллоидного состояния.
По размеру:
Грубодисперсные - суспензии, эмульсии,пены,аэрозоли. Мутные. Не проходят через
бумажный фильт. 10-6
-10-4
Коллоидно-дисперсные: коллоидные растворы. Прозрачные, опалесцируют при боковом
освещении. Проходят через бумажный фильтр, но не проходят через животные и
растительные мембраны. 10-9
-10-6
Молекулярно-дисперсные: истинные растворы низкомолекулярных веществ. Прозрачные. Проходят через животные и растительные мембраны. 10-9 - 10-10
По агрегатному сост.:

Коллоидная химия, традиционное название физической химии дисперсных систем и поверхностных явлений . Термин «коллоиды» — синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз. К. х. изучает своеобразные процессы и явления, обусловленные особенностями высокодисперсного состояния тел. К ним относятся, например, самопроизвольное укрупнение частиц твёрдой дисперсной фазы или капель жидкости (коагуляция и коалесценция) как проявление термодинамической (агрегативной) неустойчивости дисперсных систем; застудневание жидких дисперсных систем с образованием гелей и возникновение пространственных дисперсных структур ; взаимодействие соприкасающихся тел (трение, адгезия) и изменение этого взаимодействия под влиянием веществ, адсорбирующихся на поверхностях соприкосновения; явления в тонких жидких и твёрдых плёнках; самопроизвольное диспергирование жидкостей и твёрдых тел.
56. Методы получения и очистки коллоидных растворов. Получение эмульсий, суспензий, эмульсий, коллоидных растворов. Диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки .
Методы диспергирования ( физические) :
1. Механическое дробление, которое осуществляется в шаровых и коллоидных мельницах.
2. Действием ультразвука (обрабатывают водные суспензии липодов для получения лизосом)
3. Электрическое распыление в вольтовой дуге (фуллирен получают из графита, полости которого заполняют лекарственными препаратами )
(Химические):
1. Метод пептизации – дробление к свежеприготовленному осадку добавляем пептизатор и получаем, переводим в более мелкие частицы. Механизм пептизации: ионы пептизатора адсорбируются на поверхности частиц рыхлого свежее образованного осадка, придают им определенный заряд. Благодаря этому частицы взаимно отталкиваются и наблюдается распад более крупных частиц осадка на мелкие.
Конденсационный метод ( физические) :
1.Замена растворителя . Вещество, ранее необходимое в растворенном состоянии выделяют из раствора.
(химически):
1)Метод восстановления
2)Обменный метод
3)Метод гидролиза
4)Метод окисления
Методы очистки коллоидных растворов:
Ультрафильтрация- отделение дисперсной фазы от дисперсной среды через специальный фильтр. Фильтрацию проводят под давлением. В осноке метода лежит «продавливание» разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы нмв.
Дата: 2019-02-19, просмотров: 475.