Для проведения коррекции кислотно-основного состояния необходимо выявить, какое звено в его регулировке нарушено. Для этого необходимо определить значения рН биологических жидкостей и содержание буферных оснований.
В основе фармакологических действий лежит реакция нейтрализации.
Например, в качестве экстренной меры при ацидозе применяется внутривенное вливание раствора гидрокарбоната натрия 4,5%, а в острых случаях – 8,4%. Второе эффективное средство – трисамин 3,66%, который связывает избыточные протоны. Он эффективен только при внутривенном введении. Также в качестве средства, коррегирующего ацидоз, используют лактат натрия 11% раствор.
Для устранения явления алкалоза в некоторых случаях используют раствор аскорбиновой кислоты 5%. В гастроэнтерологии применяют средства, нормализующие секреторную функцию желудка. При пониженной кислотности желудочного сока назначают разбавленную соляную кислоту, при повышенной кислотности – различные антацидные препараты: оксид магния, основной карбонат магния, карбонат кальция, гидрокарбонат натрия
38. Гетерогенные реакции в растворах электролитов. Константа растворимости. Конкуренция за катион или анион: изолированное и совмещенное гетерогенные равновесия в растворах электролитов. Общая константа совмещенного гетерогенного равновесия. Условия образования и растворения осадков
Многие биологические процессы связаны с растворением или образованием малорастворимых ионных соединений, преимущественно солей. Формирование неорганического вещества костной ткани, образование почечных камней, регуляция концентрации ионов кальция в плазме и многие другие процессы объясняются теорией гетерогенных равновесий в растворах электролитов.
*Произведение растворимости
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянных температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для AgCl это равновесие можно записать в виде:
AgCl  Ag++Cl-
Ag++Cl-
Константа этого равновесия рассчитывается по уравнению:
Кs(AgCl)=[Ag+]•[Cl-]/[AgCl]
*Конкуренция за катион или анион.
1) изолированное гетерогенное равновесие – образование в системе одного малорастворимого электролита: В растворе присутствуют в равных концентрациях ионы натрия Na+ и серебра Ag+. При введении хлорид-ионов Cl- образуется хлорид серебра. В реальных системах встречается редко.
2) совмещенное гетерогенное равновесие – образование в системе нескольких мало растворимых электролитов, в первую очередь образуется менее растворимое соединение (с меньшим значением KS), затем более растворимое (с бóльшим значением KS). Происходит дробное осаждение.
39.Реакции, лежащие в основе образования неорганического вещества костной ткани гидроксидфосфата кальция. Механизм функционирования кальций-фосфатного буфера.
Коллоидный CaHPO4 , окруженный белками и гидратной оболочкой , вместе с током крови направляется в сторону костной ткани , где в остеобластах происходит конечный этап образования костной ткани -минерализация . Способствующие факторы ph=8 , повышенная концентрация фосфат-ионов , образующихся при гидролизе сложных эфиров фосфорной кислоты , углеводов , аморфного фосфата кальция .
Формирование костной ткани – результат протекания процессов осаждения-минерализации и растворения – деминерализации. Около 30%  костной ткани составляют органические соединения, в основном коллагеновые волокна, 70 % - неорганические вещества (дентин содержит около 75% неорганического вещества и имеет очень большую плотность). Основным минеральным компонентом костной и зубной ткани является основная соль- гидроксифосфат кальция Ca5(PO4)3OH (точнее Ca10(PO4)6(OH)2 - гидроксиапатит).
костной ткани составляют органические соединения, в основном коллагеновые волокна, 70 % - неорганические вещества (дентин содержит около 75% неорганического вещества и имеет очень большую плотность). Основным минеральным компонентом костной и зубной ткани является основная соль- гидроксифосфат кальция Ca5(PO4)3OH (точнее Ca10(PO4)6(OH)2 - гидроксиапатит).
Образование костной ткани начинается с плазмы крови и включает несколько стадий: При физиологическом значении рН крови (7,4) в системе сосуществуют ионы 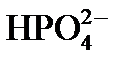 (30%) и
(30%) и 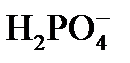 .(70%).
.(70%).
Однако, в первую очередь в присутствии ионов Ca2+ образуется менее растворимый CaHPO4 (конкуренция анионов за катион):
1-я садия: Ca 2+ + 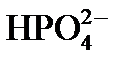 ⇄ CaHPO 4
⇄ CaHPO 4 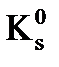 (СаНPO4) = 2,7×10–7
(СаНPO4) = 2,7×10–7
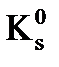 Ca(Н2PO4)2= 1×10–3
Ca(Н2PO4)2= 1×10–3
Коллоидный CaHPO4 , окруженный белками и гидратной оболочкой, вместе с током крови направляется в сторону костной ткани, где в остеобластах происходит конечный этап образования костной ткани - минерализация. Способствующие факторы: рН=8, повышенная концентрация фосфат- ионов, образующихся при гидролизе сложных эфиров фосфорной кислоты, углеводов, аморфного фосфата кальция.
2- ястадия : 3CaHPO4 + 2OH– + Ca2+ ⇄ Ca4 Н (PO4)3 + 2H2O
Са3(РО4)2 × СаНРО4
3-я стадия: Ca 4 H ( PO 4 )3 + 2 OH – + Ca 2+ ⇄ Ca 5 ( PO 4 )3ОН + Н2О
Растворимость электролитов в ряду
CaHPO 4 ® Ca 4 H ( PO 4 )3 ® Ca 5 ( PO 4 )3 OH
постоянно понижается, что способствует образованию термодинамически устойчивой в условиях организма формы фосфата кальция:
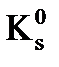 Са3(РО4)2 = 2×10–29,
Са3(РО4)2 = 2×10–29, 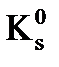 Са5(РО4)3ОН = 1,6×10–58
Са5(РО4)3ОН = 1,6×10–58
В поверхностных слоях кости содержится небольшое количество аморфного Са3(РО4)2, который придает гибкость костной ткани и является лабильным резервом кальция и фосфатов в организме. По мере взросления и старения организма его содержание уменьшается.
Костная ткань выполняет роль своеобразного минерального депо. содержащего катионы практически всех металлов, присутствующих в организме.
Часть ионов Ca2+ в костной ткани замещена ионами Mg2+. Незначительная часть ионов OH– замещена ионами фтора. Это приводит к уплотнению кристаллической решетки, а следовательно, к увеличению твердости и повышению устойчивости соединения к действию кислот ( фторид-ион - менее сильное основание Бренстеда по сравнению с гидроксид-ионом).Явление замещения ионов в узлах кристаллической решетки другими ионами, имеющими сходные кристаллохимические характеристики, называется изоморфизмом.
Таким образом, помимо гидроксиапатита в состав костной ткани входят и другие неорганические минералы:
CaНPO4  2H2O- гидрофосфат кальция (брушит)
2H2O- гидрофосфат кальция (брушит)
Ca5(PO4)3F- фторапатит (в составе зубной эмали)
Ca10(PO4)6СO3 – карбонапатит
Ca8H2 (PO4)6∙ 5H2O- октакальция фосфат
Mg10(PO4)6(OH)2
Ca3(PO4)2 – аморфный фосфат кальция
. Механизм функционирования кальций-фосфатного буфера.
В стоматологической практике как компонент биокерамики и в качестве имплантата костной ткани используют поликристаллический синтетический гидроксиаппатит, благодаря его уникальной биосовместимости чрезвычайно низкой растворимости .
Обмен ионами кальция в организме составляет до 800мг/сут . Концентрация ионов кальция в плазме крови постоянна и составляет 0,0025М, а фосфатов – 0,001М. Только половина кальция находится в ионизированном состоянии, другая половина связана с белками плазмы. Поддержание концентрации ионов кальция на постоянном уровне обеспечивает костная ткань и плазма крови; эту систему можно рассматривать как кальциевый буфер. Плазма крови представляет собой почти насыщенный раствор гидрофосфата кальция (CaHPO4), находящийся в динамическом равновесии с неорганическими составными частями костной ткани, поэтому костная ткань не растворяется. Полная перестройка костной ткани происходит каждые 10 лет.
При увеличении концентрации ионов Са2+ в плазме крови согласно принципу Ле- Шателье наблюдается сдвиг равновесия, приводящий к отложению кальция в костной ткани. Наоборот, снижение концентрации ионов Са2+ в плазме крови приводит к смещению равновесия в сторону растворения минеральных компонентов костной ткани, ее обызвествлению. Например, при рахите из-за недостаточности всасывания ионов Са2+ из желудочно-кишечного тракта, при беременности концентрация ионов Са2+ в плазме крови поддерживается постоянной за счет мобилизации (высвобождения) ионов Са2+ из неорганических компонентов костей. Растворение костной ткани происходит в специальных клетках- остеокластах, чему способствуют: уменьшение рН, увеличение концентрации лактатов, цитратов, белков, комплексно связывающих ионы кальция, отсутствие в пище витамина Д, . являющегося проводником кальция в составе растворимого комплекса через стенки кишечника в плазму.
40.Явление изоморфизма: замещение в гидроксидфосфате кальция гидроксид-ионов на ионы фтора, ионов кальция на ионы стронция. Остеотропность металлов. Реакции, лежащие в основе образования конкрементов: уратов, оксалатов, карбонатов. Применение хлорида кальция и сульфата магния в качестве антидотов.
Изоморфизм-явление возникшее в результате замещения частиц одного компонента в узлах кристаллической решетки частицами другого компонента .
Оксалаты :CaC2O4+2HCL=CaCL2+H2C2O4 реагирует с сильными кислотами .
Кальциноз сосудов -отложение карбоната кальция на стенках сосудов . Ca+CO3=CaCO3
В организме человека помимо фосфатов , ионы Са могут образовываться и другие малорастворимые соединения -патологические кокременты . Локально повышение концентраций некоторых ионов может наблюдаться при различных нарушениях обмена веществ .
Мочекаменная болезнь .
1) Образование уратов кальция (солей мочевой кислоты ) при рн <7
2) Образование фосфатов кальция при рн>7Ca+PO4=Ca3(PO4)2
Увеличение концентрации ионов лития приводит к уменьшению концентрации ионов натрия, что необходимо для поддержания значений ионной силы плазмы и осмотического давления. Уменьшение концентрации ионов натрия приводит к частичному растворению уратов натрия (соответственно принципу Ле Шателье).
Для формирования костной ткани необходимы строгая ориентация коллагеновых волокон, гормональная регуляция, ряд других факторов. Клетки костной ткани вследствие локальных изменений рН, концентрации ионов кальция и фосфатов, активности ферментов могут легко ускорять процессы минерализации или деминерализации, проходящей уже в остеокластах. Растворение костной ткани происходит из-за повышения кислотности среды. Вначале отдаются катионы кальция, а затем происходит полный распад. Костную ткань можно рассматривать как кальциевый буфер.
Регуляторами данного обмена кальцием и фосфатами в организме являются: витамин D(процесс всасывания ионов кальция и фосфатов из кишечника), гормоны паратирин, кальцитонин(подавляет активность остеокластов и ингибирует освобождение ионов Ca2+ из костной ткани), йодсодержащие гормоны щитовидной железы - тироксин (Т4) и трийодтиронин (Т3) обеспечивают оптимальный рост костной ткани, лактоферрин выполняет роль фактора роста кости и её здоровья. Благодаря им поддерживается постоянная концентрация этих ионов в сыворотке крови, межклеточной жидкости и тканях.
41. Комплексные соединения. Их строение на основе координационной теории А. Вернера. Комплексный ион, его заряд. Катионные, анионные, нейтральные комплексы. Номенклатура, примеры.
Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцепторному механизму
По координационной теории Вернера в комплексном соединении различают внутреннюю и внешнюю сферы. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса. Все остальное в комплексном соединении составляет внешнюю сферу и пишется за квадратными скобками. Между центральным атомом и лигандами действуют силы притяжения (образуется ковалентная связь по обменному и (или) донорно-акцепторному механизму),
между лигандами - силы отталкивания.
Комплексообразователь – атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении
Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число
Значение координационного числа комплексообразователя равно удвоенному заряду иона комплексообразователя
Катионные:
[Cu(NH3)4]2+
Анионные:
[Fe(CN)6]3-
Нейтральные: [Fe(CO)5]0
42.Реакции замещения лигандов. Константа нестойкости комплексного иона, константа устойчивости.
Лиганды - ионы или молекулы, которые непосредственно связаны с комплексообразователем и являются донорами электронных пар. Эти электроноизбыточные системы, имеющие свободные и подвижные электронные пары, могут быть донорами электронов, например: Соединения р-элементов проявляют комплексообразующие свойства и выступают в комплексном соединении в качестве лигандов. Лигандами могут быть атомы и молекулы
(белка, аминокислот, нуклеиновых кислот, углеводов). Эффективность и прочность донорно-акцкпторного взаимодействия лиганда и комплексообразователя определяется их поляризуемостью-способностью частицы трансформировать свои электронные оболочки под внешним воздействием.
Константа нестойкости:
Кнест=[Ag+][NH3]2/[Ag(NH3)2+]
К уст=1/Кнест
Реакции замещения лигандов
Одна из важнейших стадий в металлокомплексном катализе – взаимодействие субстрата Yс комплексом – происходит по трем механизмам:
а) Замещение лиганда растворителем. Обычно такую стадию изображают как диссоциацию комплекса
 (4)
(4)
Суть процесса в большинстве случаев – замещение лиганда LрастворителемS, который далее легко замещается молекулой субстратаY
 (5)
(5)
б) Присоединение нового лиганда по свободной координате с образованием ассоциата с последующей диссоциацией замещаемого лиганда
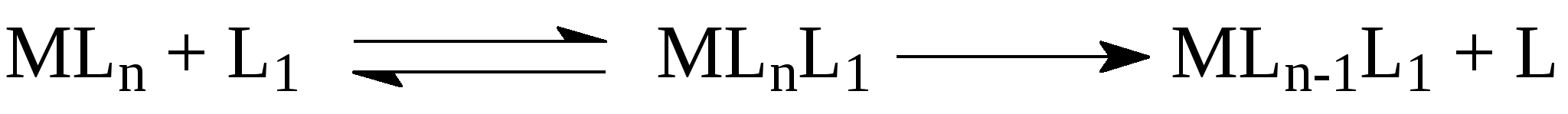 (6)
(6)
в) Синхронное замещение (типа SN2) без образования интермедиата
 (7)
(7)
44. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Физико-химические принципы транспорта кислорода гемоглобином.
Дата: 2019-02-19, просмотров: 363.