1)условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твердым растворителем. Это будет достигаться только при более низких температурах, чем температура замерзания растворителя.
2) жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если вещество нелетучее, то давление должно быть равным парциальному давлению растворителя.
2. Понижение температуры замерзания растворов
Раствор, в отличие от чистой жидкости, не отвердевает целиком при постоянной температуре; при некоторой температуре, называемой
температурой начала кристаллизации, начинают выделяться кристаллы растворителя и по мере кристаллизации температура раствора понижается (поэтому под температурой
замерзания раствора всегда понимают именно температуру начала кристаллизации).
Замерзание растворов можно охарактеризовать величиной понижения температуры замерзания ∆Tзам равной разности между температурой замерзания чистого растворителя T0зам и температурой начала кристаллизации раствора Tзам:
∆Tзам = T0зам – Tзам
Рассмотрим p – T диаграмму состояния растворителя и растворов различной концентрации (рисунок 1), на которой кривая OF – есть зависимость давления пара над твердым
растворителем, а кривые OA, BC, DE – зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями, соответственно.
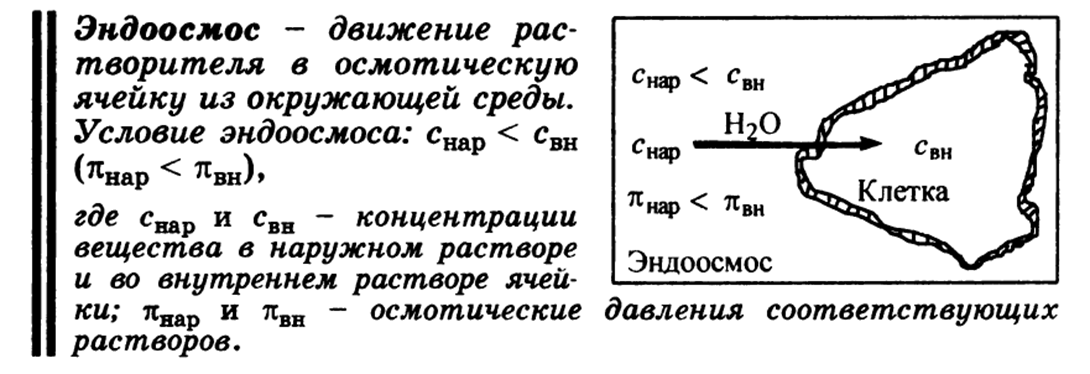
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково.Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура,
отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя.
При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношениемчисла частиц растворителяи растворенного вещества. Показано, что понижение температуры замерзания раствора ΔTзам,
прямо пропорционально моляльной концентрации раствора:
ΔTзам , = Kзам · Cm,
где Kзам – криоскопическая постоянная растворителя – определяется природой растворителя.
Связь криоскопической константы с теплотой плавления растворителя Криоскопическая константа Kзам представляет собой понижение температуры замерзания раствора при растворении 1 моль нелетучего неэлектролита в 1000 г растворителя. Константа Kзам связана с температурой замерзания растворителя Т и его теплотой плавления ΔНпл уравнением:
Kзам =(RT2зам/ ΔHпл) · (M1/1000),
где M1 – молярная масса растворителя, ΔHпл - энтальпия плавления растворителя, Т зам –температура замерзания растворителя .Для данного растворителя криоскопическая постоянная не зависит от природырастворенного вещества.
Kзам = (RT2зам / ΔHпл) · (M1 / 1000)
Метод исследования, основанный на измерении понижения температуры затвердевания растворов называют криоскопическим методом. Зная массу растворителя (g1) и массу растворенного вещества (g2) можно по измеренной ΔTзам , пользуясь уравнением ΔTзам = Kзам·Cm , определить молярную массу растворенного вещества (М2):
M2 = Kзам · (1000·g2)/(ΔTзам·g1)
3. Повышение температуры кипения растворов Температура кипения растворов нелетучего вещества всегда выше, чем температура кипения чистого растворителя при том же давлении.
Любая жидкость – растворитель или раствор – кипит при той температуре, при которой
давление насыщенного пара становится равным внешнему давлению. Соответственно, температуры, при которых изобара p = 1 атм пересечёт кривые, представляющие зависимости давления пара над чистым растворителем и растворами с возрастающими концентрациями, соответственно, будут температурами кипения этих жидкостей.
Повышение температуры кипения растворов нелетучих веществ ΔTкип = Tкип – T0 кип пропорционально понижению давления насыщенного пара и, следовательно, прямо пропорционально моляльной концентрации раствора: ΔTкип = Kкип · Сm Коэффициент пропорциональности Kкип – есть эбулиоскопическая постоянная растворителя, не зависящая от природырастворенного вещества: Эбулиоскопическая константа имеет физический смысл повышения температуры кипения растворов с моляльной концентрацией, равной 1 моль/кг.
Таким образом, второй закон Рауля можно в наиболее общем виде сформулировать следующим образом: «Понижение температуры замерзания и повышение температуры кипения разбавленного раствора нелетучего неэлектролита прямо пропорционально моляльной концентрации раствора и не зависит от природы растворенного вещества».
Связь эбулиоскопической константы с теплотой испарения растворителя
Kкип = (RT2 кип/ ΔHисп) · (M1/1000) Для данного растворителя эбулиоскопическая постоянная не зависит от природы растворенного вещества.
Метод исследования, основанный на измерении повышения температуры кипения
растворов, называют эбулиоскопическим методом. Зная массу растворителя (g1) и массу
растворенного вещества (g2) можно по измеренной ΔTкип , пользуясь уравнением
ΔTкип = Kкип·Cm , определить молекулярную массу растворенного вещества (М2):
M2 = Kкип · (1000·g2)/(ΔTкип·g1)
22. Осмос. Осмотическое давление: закон Вант-Гоффа. Осмотическое давление в растворах
неэлектролитов и электролитов. Изотонический коэффициент.
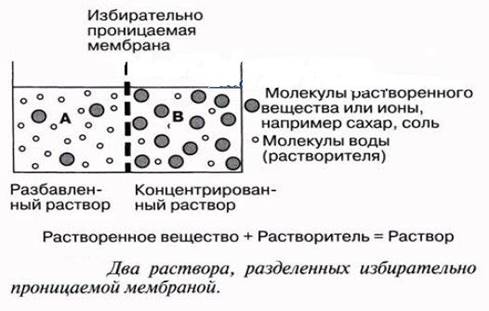
Осмос - самопроизвольная диффузия молекул растворителя сквозь мембрану с избирательной проницаемостью. Не зависит от природы растворенного вещества, а только от числа частиц в растворе и от температуры.
Осмотическое давление - избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
Для учета межмолекулярных взаимодействий в реальных растворах было предложено использовать изотонический коэффициент, который для растворов неэлектролитовi=1, а для растворов электролитов i> 1(максимальное значение равно числу ионов в его молекуле)
В. Пфеффер и Я Вант-Гофф, изучая колличественную зависимость осмотического давления от внешних факторов, установили, что оно подчиняется объединенному газовому закону Менделеева-Клайперока.
Закон Вант-Гоффа гласит: "Осмотическое давление разбавленного раствора равно давлению, которое проявляло бы растворенное вещество, если бы оно было газообразным и занимало объем, равный объему раствора".
Уравнение для описания осмотического давления для растворов неэлектролитов можно записать так:
р = ( m / MV )* RT = C * RT . , где
р - осмотическое давление, кПа:
С - молярная концентрация, моль/ л;
R - универсальная газовая постоянная, равная 8,31 (кПа-л)(моль-К);
Т - абсолютная температура. К.
Концентрация кинетически самостоятельных частиц в растворах электролитов всегда больше, чем это следует из аналитической концентрации.
С тем, чтобы свойства растворов электролитов удовлетворительно описывались уравнениями, выражающими следствие из закона Рауля, Вант-Гоффом был введен поправочный эмпирический коэффициент, называемый сейчас изотоническим или коэффициентом Вант-Гоффа (i)
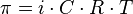
i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R — универсальная газовая постоянная; T — термодинамическая температура раствора.
.
23.Коллигативные свойства разбавленных растворов электролитов. Элементы теории растворов сильных электролитов Дебая- Хюккеля. Ионная сила, ее математическое выражение. Понятие об активности. Коэффициент активности.
Коллигативные свойства – не зависящие от природы частиц свойства, а зависящие только от концентрации частиц в растворе.
Такими свойствами являются: диффузия, осмотическое давление, понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора.
Теория Дебая – Хюккеля.
· В растворах сильных электролитов каждый нон окружен со всех сторон ионами противоположенного знака, вследствие чет движение ионов ограничено.
· Ионы сильного электролита в растворе взаимодействуют между собой благодаря наличию значительных электростатических сил, в результате чего ноны одного знака образуют вокруг нона другого знака так называемую ионную атмосферу. Необходимо также учитывать сольватацию ионов,
· Ионная атмосфера и сольватная оболочка замедляют движение ионов в растворе и являются причиной кажущейся неполной ионизации.
· Кроме того, в растворах сильных электролитов при высоких концентрациях может происходить ассоциация ионов.
· Для учета этих влиянии состав растворов электролитов следует характеризовать не аналитической, а эффективной концентрацией, называемой активностью (Льюис, 1907),
Основная ее идея - вследствие электростатического притяжения между положительными и отрицательными ионами вблизи каждого иона находятся главным образом ионы противоположного знака, т.е. ион как бы окружен ионной атмосферой. Суммарный заряд этой атмосферы по абсолютной величине равен заряду центрального иона, но противоположен ему по знаку. Тормозящее действие ионной атмосферы на передвижение ионов проявляется таким образом, что все свойства, зависящие от концентрации ионов (такие, как электрическая проводимость, осмотическое давление и т.д.), отвечают заниженной степени диссоциации – кажущейся степени диссоциации.
Для оценки состояния ионов в растворе пользуются понятием активности иона – его условной концентрации, соответственно которой он действует при химических реакциях:
a = f*C, где a – активность иона, C – его концентрация, f – коэффициент активности. Значение f < 1 указывает на связывающее взаимодействие ионов; если f близок к единице, это говорит о слабом межионном взаимодействии. В очень разбавленных растворах действие межионных сил почти не проявляется.
Ионная сила раствора (I) - величина, характеризующая интенсивность электростатического ноля всех ионов в растворе, которая равна полу-сумме произведений молярной концентрации (с) каждого иона на квадрат его заряда (z):
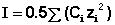
Активность электролита – эффективная концентрация в соответствии с которой он участвует в различных процессах
В разбавленных растворах сильных электролитов с одинаковой ионной силой коэффициенты активности катионов и анионов одинаковой зарядности равны независимо от их химической природы.
24. Электролиты в организме.Осмоляльность и осмолярность биологических жидкостей и перфузионных растворов .Понятия изо-, гипо-, гипертонический раствор. Понятие об изоосмии.Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Цитолиз.
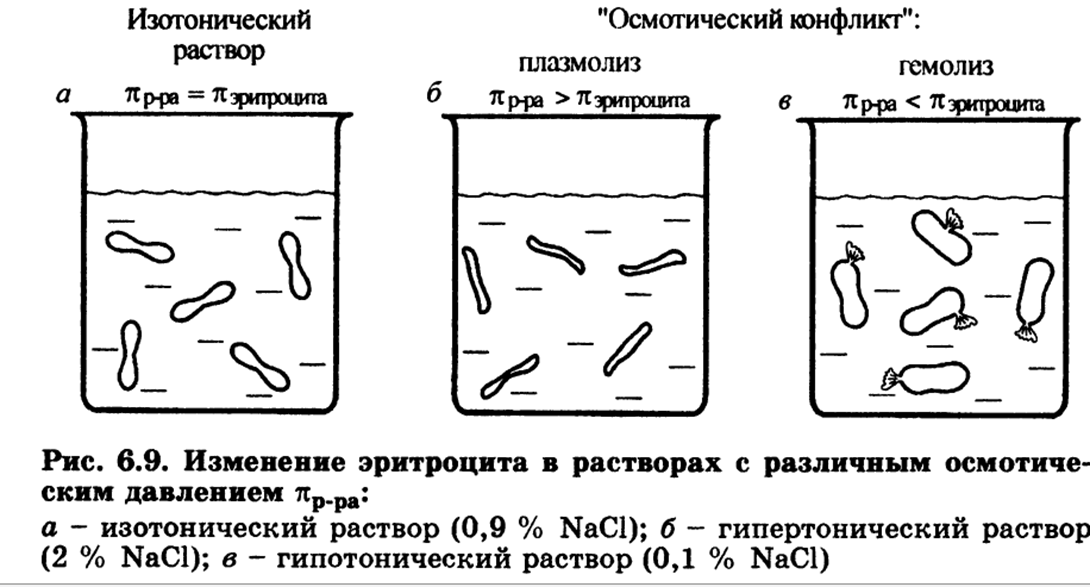
В биологических системах широко распространены межионные взаимодействия, которые сильно зависят от ионной силы растворов, что прежде всего сказывается на значениях констант диссоциации ионогенных групп биологических субстратов, так как они определяются активностями ионов, а не их концентрациями. Незначительное увеличение ионной силы раствора вызываем изменение степени ионизованности белков или нуклеиновых кислот, вследствие чего меняется их конформация. а следовательно, и биологические функции. Поэтому при использовании растворов электролитов в биологических экспериментах крайне необходимо, чтобы их ионная сила была равна ионной силе соответствующей биологической системы. Так, ионная сила плазмы крови человека равна 0,15 М, поэтому физиологический раствор -простейший заменитель плазмы крови - должен иметь соответствующую концентрацию NaCI (0,15 М, или 0,9 %).
Электролиты являются составной частью жидкостей и тканей живых организмов. Для нормального протекания физиологических и биохимических процессов необходимы катионы натрия, калия, кальция, магния, водорода, анионы хлора, сульфат-ионы, гидрокарбонат-ионы, гидроксид-ионы и др. Концентрации этих ионов в организме человека различны. Так, например, концентрации ионов натрия и хлора весьма значительны и ежедневно пополняются. Концентрации ионов водорода и гидроксид-ионов очень малы, но играют большую роль в жизненных процессах, способствуя нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д.
Изоосмия, изотония – это относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентрации содержащихся в них веществ.
В растворах, содержащих смесь электролитов, расчет числа кинетически самостоятельных частиц затруднен. В связи с этим в прикладных областях химии, в частности в медицине, в последнее время широко применяются понятия осмолярность и осмолялыюсть.
Под осмолярностыо (осмоляльностью) понимают активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембрану. Единицы измерения в системе СИ: осмолярности - моль/л, осмоляльностн - моль /кг. Для разбавленных растворов численные значения осмоляльностниосмолярности совпадают. Последнее время чаще применяется такая единица измерения, как осмоль.
Учет этих величин особенно важен в тех случаях, когда применение лекарственных средств сопряжено с протеканием процессов, связанных с осмотическим давлением. Так.при введении лекарственных растворов в кровь, необходимо, чтобы осмолярная концентрация раствора для инъекции совпадала с осмолярной концентрацией плазмы крови (0.3 осмоль/л). Это значит, что растворы изотоничны. Часто под изоосмией понимают способность организма поддерживать постоянство осмолярности биологических жидкостей. Осмоляльность крови в значительной степени зависит от концентрации ионов Na и CL , в меньшей от глюкозы и мочевины.
Гипертонические растворы - растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях. В зависимости от функциональной, видовой и экологической специфики клеток осмотическое давление в них различно, и раствор, гипертоничный для одних клеток, может оказаться изотоничным или даже гипотоничным для др. При погружении растительных клеток в гипертонический раствор он отсасывает воду из клеток, которые уменьшаются в объёме, а затем дальнейшее сжатие прекращается и протоплазма отстаёт от клеточных стенок (плазмолиз). Эритроциты крови человека и животных в гипертонических растворах также теряют воду и уменьшаются в объёме. Гипертонические растворы в сочетании с гипотоническими растворами и изотоническими растворами применяют для измерения осмотического давления в живых клетках и тканях.
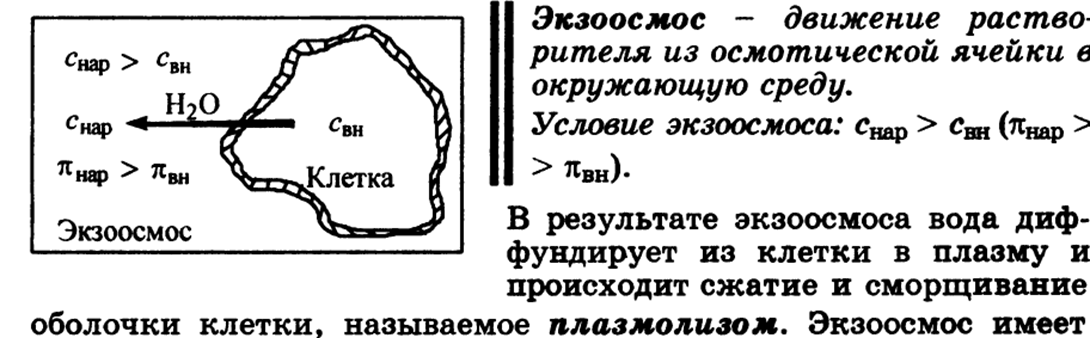
Гипотонические растворы - различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей. В гипотонических растворах клетки насасывают воду, увеличиваясь в объёме, и теряют часть осмотически активных веществ (органических и минеральных). Эритроциты крови животных и человека в гипотонических растворах разбухают до такой степени, что их оболочки лопаются и они разрушаются. Это явление называют гемолизом.
25 Основные положения теории кислот и оснований Бренстеда- Лоури: молекулярные и ионные кислоты и основания, сопряженная протолитическая пара. Амфолиты.
Сила кислоты определяется ее способностью отдавать протон, т.е сильная кислота - активный донор протона.
Сила основания определяется его способностью принимать протон, т.е сильное основание - активный акцептор протона.
Для удобства оценки характера водной среды используют водородный показатель pH. Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода. pH=-lg[H+] Иногда используют гидроксильный показатель pOH. В нейтральной среде водородный показатель =7, в кислой он меньше 7 а в щелочной – больше. Для определения кислотности среды используют индикаторный или ионометрический метод.
Некоторые вещества в одних реакциях способны вступать в роли донора протона, а в других - в роли акцептора протона. Такие вещества называют амфолитами.
Типичным амфолитом является вода:
Вода взаимодействует и с кислотами, выступая в роли основания, и с основаниями, выступая в роли кислот:
Амфолитами являются также гидроксиды некоторых металлов и гидроанионы некоторых многоосновных кислот:
Амфолитами также являются соединения, молекулы которых две различные кислотно-основные группы:
26. Ионное произведение воды. Водородный показатель среды растворов. Математическое выражение рН, его значение в кислой, щелочной, нейтральной средах. Биологическая роль водородного показателя.
В водных растворах кислот и оснований рН среды зависит от природы и концентрации растворенного вещества.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ.
Вода является очень слабым электролитом.
Ее диссоциация выглядит так:
Константа последнего равновесия равна:
Отсюда:
Постоянство ионного произведения воды означает, что в любом водном растворе-нейтральном, кисломилищелочном-имеются и водородные ионы, и гидроксид-ионы.
27.Основные положения теории кислот и оснований Льюиса. Понятие о жестких и мягких кислотах и основаниях (теория ЖМКО).
Кислота Льюиса – любое хим.соединение , молекула ,ион , являющийся акцептором электронной пары и таким образом способное принимать пару электронов соединения донора (основания Льюиса ) на незаполненную орбиталь с образованием соединения аддукта .
Основание Льюиса – основанием считается любая частица (атом , молекула или анион ) способная отдавать электронную пару для образования ковалентной связи . Т.е по Льюису кислота является акцептором пары электронов , а основание -донором .
В теории Льюиса (1923 г.) на основе электронных представлений было ещё более расширено понятие кислоты и основания.
Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны приниматьэлектронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода,спирты, галогены.
Примеры химических реакций между кислотами и основаниями Льюиса:
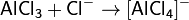
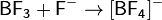
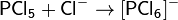
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Молекулярная орбиталь, на которую переходит электронная пара, у жёстких кислот имеет низкую энергию. Соответственно, жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Их орбиталь, с которой отдаётся электронная пара, также имеет низкую энергию.
Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Как у мягких кислот, так и у мягких оснований энергия орбиталей, участвующих в реакции высока. Поскольку такие свойства как заряд, электроотрицательность и поляризуемость изменяются плавно, существует ряд кислот и оснований Льюиса, которые занимают промежуточное положение между жёсткими и мягкими.
Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера.
28. Ионизация слабых кислот и оснований. Константа кислотности и основности. Связь между константой кислотности и константой основности в сопряженной протолитической паре. Амфолиты. Изоэлектрическая точка .

29.Протолитические реакции. Типы протолитических реакции (нейтрализации, гидролиза, ионизации). Примеры. Конкуренция за протон: изолированное и совмещенное протолитические равновесия. Общая константа совмещенного протолитического равновесия.
. Реакции нейтрализации: H 2 CO 3+ H 2 O = HCO 3+ H 3 O кислота +основание = с.о +с.к
1)между слабыми электролитами NH3+CH3COOH=NH4+ +CH3COO-
2) слабыми и сильнымиNH3+H3O+(кислота) = NH4+ + H2O(основание)
3)сильнымиH3O(кислота)+OH=H2O+H2O
Реакции ионизации:
CH3COOH + H2O(основание) ↔ H3O+(кислота) + CH3COO-
30.Буферное действие - основной механизм протолитического гомеостаза организма.Буферные системы, буферные растворы, их состав. Классификация буферных систем.
Механизм действия буферных систем (на примере гидрокарбонатного буфера).
Буферная система – протолитическая равновесная система, способная сохранять практически постоянное значение рН при добавлении небольшого количества кислоты или основания.
Согласно протолитической теории кислоты и основания могут быть трех типов: нейтральные, анионные и катионные.Анионные основания и кислоты представляют собой отрицательно заряженные ионы, например: HSO4-, HPO42-, HS- (кислоты); OH-, Cl-, NO3- (основания).
В роли катионных оснований и кислот выступают положительно заряженные ионы, например: NH4+, H3O+ (кислоты); H2N-NH3+, H2N-(CH2)2-NH3+ (основания).
В живых организмов характерно поддержание кислотно-основного гомеостаза на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии протолитов. В процессе метаболизма в организме постоянно происходит синтез, распад и взаимодействие огромного количества химических соединений. Все эти процессы осуществляются при помощи ферментов, активность которых связана с определённым значением рН.
Обеспечение постоянства рН крови и других органов и тканей является одним из важнейших условий нормального существования организма. Это обеспечение достигается наличием в организме многочисленных регулирующих систем, важнейшими из которых являются буферные системы. Последние играют основную роль в поддержании КОР в организме как в условиях физиологии, так и патологии.
Кроме того, материал данной темы необходим для изучения последующих тем предмета (потенциометрия, свойства растворов ВМС и т.д.) и таких дисциплин как биохимия, микробиология, гистология, гигиена, физиология, в практической деятельности врача при оценке типа и тяжести нарушений КОР.
Буферные растворы
Одним из основных свойств живых организмов является поддержание кислотно-основного гомеостаза на определенном уровне. Протолитический гомеостаз – постоянство рН биологических жидкостей, тканей и органов. Это находит выражение в достаточно постоянных значениях рН биологических сред (крови, слюны, желудочного сока и т.д.) и способности организма восстанавливать нормальные значения рН при воздействии протолитов. Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсацию), но и физико-химические: буферное действие, ионный обмен и диффузию.
Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания. Протолитические буферные растворы представляют смеси электролитов, содержащие одноимённые ионы.
Различают в основном протолитические буферные растворы двух типов:
• Кислотные т.е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa - ацетатный буфер
СН3СООН + Н2О ↔ Н3О+ + СН3СОО- избыток сопряженного
кислота
основания
СН3СООNa → Na+ + CH3COO-
• Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер.
NH3 + H2O ↔ OH- + NH4+ избыток
Основание
сопряженной
NH4Cl → Cl- + NH4+ кислоты
Уравнение буферной системы рассчитывается по формуле Гендерсона-Гассельбаха:
рН = рК + ℓg  , pOH = pK + ℓg
, pOH = pK + ℓg  ,
,
где рК = -ℓg КД.
С – молярная или эквивалентная концентрация электролита (C = V N)
Механизм действия буферных растворов
Рассмотрим его на примере ацетатного буфера: СН3СООН + СН3СООNa
Высокая концентрация ацетат-ионов обусловлена полной диссоциацией сильного электролита – ацетата натрия, а уксусная кислота в присутствии одноименного аниона существует в растворе практически в неионизированном виде.
1. При добавлении небольшого количества хлороводородной кислоты, ионы Н+ связываются с имеющимся в растворе сопряженным основанием СН3СОО- в слабый электролит СН3СООН.
CH3COO ‾ +H + ↔ CH3COOH (1)
Из уравнения (1) видно, что сильная кислота НС1 заменяется эквивалентным количеством слабой кислоты СН3СООН. Количество СН3СООН увеличивается и по закону разбавления В. Оствальда степень диссоциации уменьшается. В результате этого концентрация ионов Н+ в буфере увеличивается, но очень незначительно. рН сохраняется постоянным.
При добавлении кислоты к буферу рН определяется по формуле:
рН = рК + ℓg 
2. При добавлении к буферу небольшого количества щелочи протекает реакция её с СН3СООН. Молекулы уксусной кислоты будут реагировать с гидроксид-ионами с образованием Н2О и СН3СОО ‾:
CH3COOН + OH ‾ ↔ CH3COO ‾ + H2O (2)
В результате этого щелочь заменяется эквивалентным количеством слабоосновной соли CH3COONa. Количество СН3СООН убывает и по закону разбавления В.Оствальда степень диссоциации увеличивается за счет потенциальной кислотности оставшихся недиссоциированных молекул СН3СООН. Следовательно, концентрация ионов Н+ практически не изменяется. рН остаётся постоянным.
При добавлении щелочи рН определяется по формуле:
рН = рК + ℓg 
3. При разбавлении буфера рН также не меняется, т.к. константа диссоциации и соотношение компонентов при этом остаются неизменными.
Таким образом, рН буфера зависит от: константы диссоциации и соотношения концентрации компонентов. Чем эти величины больше, тем больше рН буфера. рН буфера будет наибольшим при соотношении компонентов равным единице.
Для количественной характеристики буфера вводится понятие буферной ёмкости.
31.Количественные характеристики буферных систем: зона буферного действия и буферная емкость. Факторы влияющие на буферную емкость. Распределение буферных систем в цельной крови и сыворотке по буферной емкости.
Зона буферного действия – это интервал значений рН, в пределах которого сохраняется буферное действие. рН=рКа -+ 1. Буферная система будет сохранять буферное действие при соблюдении соотношения: 0,1 < [ акцептор Н+] / [донор Н+] < 10
Буферная ёмкость
Буферные емкость – количество вещества эквивалента кислоты или щелочи, которых нужно добавить к буферному раствору, чтобы изменить величину рН на единицу.
О противодействии изменению рН крови свидетельствуют следующие данные. Чтобы сдвинуть рН крови на единицу в щелочную область, нужно прибавить в кровь в 70 раз больше количества NaOH, чем в такой же объём чистой воды. Для изменения рН на единицу в кислую область, следует в кровь добавить в 320 раз больше количества соляной кислоты, чем к такому же объёму чистой воды.
Буферная ёмкость зависит от концентрации электролитов и соотношения компонентов буфера. Наибольшей буферной ёмкостью обладают растворы с большей концентрацией компонентов и соотношением компонентов, равным единице.
Буферная ёмкость артериальной крови 25,3 ммоль/л, венозной – 24,3 ммоль/л, слюна обладает буферной ёмкостью и определяется бикарбонатной, фосфатной и белковой системами. Буферная ёмкость слюны изменяется под влиянием ряда факторов: углеводистая диета снижает буферную ёмкость слюны, высокобелковая диета – повышает её. Поражаемость зубов кариесом меньше у лиц с высокой буферной ёмкостью.
В организме человека действуют белковый, гемоглобиновый, фосфатный и бикарбонатный буферы.
Буферные системы организма.
Бикарбонатный буфер.
Он составляет 53 % буферной ёмкости и представлен:
Н2СО3
NaHCO3 Соотношение 1 : 20
Бикарбонатный буфер представляет собой основную буферную систему плазмы крови; он является системой быстрого реагирования, так как продукт его взаимодействия с кислотами СО2 – быстро выводится через легкие. Помимо плазмы, эта буферная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Механизм действия.
1. В случае накопления кислот в крови уменьшается количество НСО3- и происходит реакция: НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2↑. Избыток удаляется лёгкими. Однако значение рН крови остаётся постоянным, так как увеличивается объём лёгочной вентиляции, что приводит к уменьшению объёма СО2
2. При увеличении щелочности крови концентрация НСО3- увеличивается: Н2СО3 + ОН- ↔ НСО3- + Н2О.
Это приводит к замедлению вентиляции лёгких, поэтому СО2 накапливается в организме и буферное соотношение остаётся неизменным.
Гемоглобиновый буфер
Составляет 35 % буферной ёмкости.
Главная буферная система эритроцитов, на долю которой приходится около 75% всей буферной ёмкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и СО2. Гемоглобиновая буферная система крови играет значительную роль сразу в нескольких физиологических процессах: дыхании, транспорте кислорода в ткани и в поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови.
Она представлена двумя слабыми кислотами – гемоглобином и оксигемоглобином и сопряженными им основаниями – соответственно гемоглобинат- и оксигемоглобинат-ионами:
HHb ↔ H+ + Hb-
HHbO2 ↔ H+ HbO2-
Оксигемоглобин – более сильная кислота (рКа = 6,95), чем гемоглобин (рКа = 8,2). При рН = 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин – на 10%, поэтому присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается.
Буферные свойства ННb прежде всего обусловлены возможностью взаимодействия кислореагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb + Н2СО3 ↔ КНСО3 + ННb.
Образующийся гидрокарбонат (КНСО3) уравновешивает количество поступающей Н2СО3, рН сохраняется, так как происходит диссоциация потенциальных молекул Н2СО3 и образовавшихся гемоглобиновых кислот.
Именно таким образом поддерживается рН крови в пределах нормы, несмотря на поступление в венозную кровь огромного количества СО2 и других кислореагирующих продуктов обмена.
В капиллярах лёгких гемоглобин (ННb) поглощает кислород и превращается в HHbO2, что приводит к некоторому подкислению крови, вытеснению некоторого количества Н2СО3 из бикарбонатов и понижению щелочного резерва крови, а в тканях отдает его и поглощает СО2.
В лёгких: ННb + O2 ↔ HHbO2;
HHbO2 + HCO3- ↔ HbO2 + H2O + CO2 ↑
В тканях: HbO2 ↔ Hb- + O2; Hb- + Н2СО3 ↔ ННb + HCO3-
Кроме того, гемоглобиновый буфер является сложным белком и действует как белковый буфер.
Фосфатный буфер
Составляет 5 % буферной ёмкости. Содержится как в крови, так и в клеточной жидкости других тканей, особенно почек. В клетках он представлен солями К2НРО4 и КН2РО4, а в плазме крови и в межклеточной жидкости Na2HPO4 и NaH2PO4. Функционирует в основном в плазме и включает: дигидрофосфат ион Н2РО4- и гидрофосфат ион НРО42-.
Отношение [HPO4 2- ]/[H2PO4-] в плазме крови (при рН = 7,4) равно 4 : 1. Следовательно, эта система имеет буферную ёмкость по кислоте больше, чем по основанию.
Например, при увеличении концентрации катионов Н+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами НРО4 2- :
Н + + НРО4 2- ↔ Н2РО4 1-
Образующийся избыточный дигидрофосфат выводится почками, что приводит к снижению величины рН мочи.
При увеличении концентрации оснований в организме, например при употреблении растительной пищи, они нейтрализуются ионами Н2РО4 1-:
ОН ‾ + Н2РО4 1- ↔ НРО4 2- + Н2О
Образующийся избыточный гидрофосфат выводится почками, при этом рН мочи повышается.
Выведение тех или иных компонентов фосфатной буферной системы с мочой, в зависимости от перерабатываемой пищи, объясняет широкий интервал значений рН мочи – от 4,8 до 7,5. Фосфатная буферная система крови характеризуется меньшей буферной ёмкостью, чем гидрокарбонатная, из-за малой концентрации компонентов крови. Однако эта система играет решающую роль не только в моче, но и в других биологических средах – в клетке, в соках пищеварительных желез, в моче.
Белковый буфер
Составляет 5 % буферной ёмкости. Он состоит из белка-кислоты и его соли, образованной сильным основанием.
Pt – COOH - белок-кислота
Pt – COONa – белок-соль
1. При образовании в организме сильных кислот они взаимодействуют с солью белка. При этом получается эквивалентное количество белок-кислоты: НС1 + Pt-COONa ↔ Pt-COOH + NaCl. По закону разбавления В.Оствальда увеличение концентрации слабого электролита уменьшает его диссоциацию, рН практически не меняется.
2. При увеличении щелочных продуктов они взаимодействуют с
Pt-СООН: NaOH + Pt-COOH ↔ Pt-COONa + H2O
Количество кислоты уменьшается. Однако концентрация ионов Н+ увеличивается за счет потенциальной кислотности белок-кислоты. поэтому практически рН не меняется.
Белок – это амфотерный электролит и поэтому проявляет собственное буферное действие.
Рассмотрим взаимодействие буферных систем в организме по стадиям:
1. В процессе газообмена в легких кислород поступает в эритроциты, где протекает реакция:
ННb + O2 ↔ HHbO2 ↔ Н+ + HbO2-
2. По мере перемещения крови в периферические отделы кровеносной системы происходит отдача кислорода ионизированной формой HbO2-
HbO2-↔ Нb- + О2
Кровь при этом из артериальной становится венозной. Отдаваемый в тканях кислород расходуется на окисление различных субстратов, в результате чего образуется СО2, большая часть которого поступает в эритроциты.
3. В эритроцитах в присутствии карбоангидразы со значительной скоростью протекает следующая реакция:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-
4. Образующийся избыток протонов связывается с гемоглобинат-ионами:
Н+ + Нb- → HHb
Связывание протонов смещает равновесие реакции стадии (3) вправо, вследствие чего концентрация гидрокарбонат ионов возрастает и они диффундируют через мембрану в плазму. В результате встречной диффузии ионов, отличающихся кислотно-основными свойствами (хлорид-ион протолитически неактивен; гидрокарбонат ион в условиях организма является основанием), возникает гидрокарбонатно-хлоридный сдвиг. Этим объясняется более кислая реакция среды в эритроцитах (рН = 7,25) по сравнению с плазмой (рН = 7,4).
5. Поступающие в плазму гидрокарбонат-ионы нейтрализуют накапливающийся там избыток протонов, возникающий в результате метаболических процессов:
НСО3- + Н+ ↔ Н2СО3 ↔ Н2О + СО2
6. Образовавшийся СО2 взаимодействует с компонентами белковой буферной системы:
СО2 + Рt-NH2 ↔ Pt-NHCOOH ↔ H+ + Pt-NHCOO-
7. Избыток протонов нейтрализуется фосфатным буфером:
Н+ + НРО4- ↔ Н2РО4-
8. После того как кровь вновь попадает в легкие, в ней увеличивается концентрация оксигемоглобина (стадия 1), который реагирует с гидрокарбонат-ионами, не диффундировавшими в плазму:
НСО3- + ННbО2 ↔ НbО2- + СО2 + Н2О
Образующийся СО2 выводится через легкие. В результате уменьшения концентрации НСО3- ионов в этой части кровеносного русла наблюдаются их диффузия в эритроциты и диффузия хлорид-ионов в обратном направлении.
9. В почках также накапливается избыток протонов в результате реакции:
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3-,
который нейтрализуется гидрофофат-ионами и аммиаком (аммиачный буфер): H+ + NH3 ↔ NH4+
Таким образом, гемоглобиновая система участвует в двух процессах:
• Связывание протонов, накапливающихся в результате метаболических процессов;
• Протонирование гидрокарбонат-ионов с последующим выделением СО2
Гемоглобиновую буферную систему можно рассматривать как одно из важнейших звеньев в транспорте СО2 из тканей в легкие.
Следует отметить, что на поддержание постоянства рН различных жидких систем организма оказывают влияние не столько буферные системы, сколько функционирование ряда органов и систем: легких, почек, кишечника, кожи и др.
32.Расчет рН протолитических систем. Вывод уравнения Гендерсона- Гассельбаха и его анализ. Зона буферного действия.
Установим на примере ацетатного буфера факторы, влияющие на величину активной кислотности.
В растворе данной буферной системы происходят следующие реакции электролитической диссоциации:
CH3COOH D CH3COO– + H+
CH3COONa → CH3COO– + Na+
Гидролиз соли, т.е. взаимодействие ацетат-ионов с Н2О
CH3COO– + HOH D CH3COOH + OH–
учитывать не будем.)
Таким образом, ионы Н+ образуются только за счет диссоциации некоторого числа молекул уксусной кислоты. Этот процесс является обратимым и количественно характеризуется константой кислотности Kа:

где  (или
(или  ),
),  и
и  равновесные молярные концентрации ионов Н+, СН3СОО– и непродиссоциированных молекул кислоты.
равновесные молярные концентрации ионов Н+, СН3СОО– и непродиссоциированных молекул кислоты.
Из данного уравнения можно выразить  (активную кислотность буферной системы):
(активную кислотность буферной системы):

Кроме уксусной кислоты, в растворе присутствует ее соль CH3COONa. Она является сильным электролитом и полностью распадается на ионы. В результате этого концентрация анионов СН3СОО– резко возрастает, и согласно принципу Ле-Шателье, равновесие реакции диссоциации уксусной кислоты смещается влево, т.е. в сторону образования ее молекул. Причем диссоциация уксусной кислоты в присутствии собственной соли может быть настолько подавленной, что равновесную концентрацию ее нераспавшихся молекул в растворе можно считать равной концентрации СН3СООН, а равновесную концентрацию ацетат-ионов – исходной концентрации соли. В связи с этим выражение, по которому рассчитывается концентрация ионов Н+, можно записать иначе:

где Скислоты и Ссоли – исходные концентрации компонентов буферной системы.
Прологорифмируем полученное уравнение (с учетом того, что логарифм произведения равен сумме логарифмов сомножителей):

и умножим обе его части на –1:

Как было показано нами ранее


В связи с этим запишем уравнение для расчета концентрации ионов Н+ в окончательном виде:

Данное выражение называется иначе уравнением Гендерсона-Гассельбаха. Его можно использовать для вычисления рН любой кислотной буферной системы. Например, для фосфатного буфера уравнение Гендерсона-Гассельбаха запишется следующим образом:
 (в данной системе роль слабой кислоты играет анион Н2РО4–, то
(в данной системе роль слабой кислоты играет анион Н2РО4–, то  .
.
В водных растворах рН и рОН являются сопряженными величинами. Их сумма всегда равна 14, т.е.:
рН + рОН = 14 Зная концентрацию ионов Н+ или рН, можно вычислить концентрацию гидроксильных ионов или рОН.

Уравнения Гендерсона-Гассельбаха для расчета рОН и рН в оснóвных буферных системах выглядят следующим образом:


где pKb = –lg Kb (основания), Соснования и Ссоли – исходные молярные концентрации компонентов данных буферных систем, т.е. слабого основания и его соли с сильной кислотой.


34.Буферные системы крови: фосфатная буферная система. Состав, механизм действия, биологическая роль.
35.Буферные системы крови: гемоглобиновая буферная система. Состав, механизм действия, биологическая роль
36. Буферные системы крови: протеиновая буферная система. Состав, механизм действия, биологическая роль.

37. Понятие о кислотно-основном состоянии организма.Ацидоз. Алкалоз. Щелочной резерв крови. Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.).
Кислотно-основное равновесие
Кислотно-основное состояние – неотъемлемая составная часть протолитического гомеостаза внутренней среды организма, который обеспечивает оптимальные условия правильного течения обмена веществ.
Соотношение определённой концентрации ионов Н+ и ОН- в органах, тканях, жидкостях организма называется кислотно-основным равновесием (КОР). Кислотно – основное равновесие имеет первостепенное значение, так как:
• Ионы Н+ являются катализаторами многих биохимических превращений;
• Ферменты и гормоны проявляют биологическую активность при строго определённых значениях рН;
• Наибольшие изменения концентрации ионов Н+ крови и межтканевой жидкости влияют на величину их осмотического давления.
Отклонение рН крови (7,4) на 0,3 ед. может привести к коматозному состоянию, отклонение на 0,4 ед. может повлечь смертельный исход. рН слюны равное 5 ед. приводит к развитию кариеса.
Основные показатели КОР.
• В норме рН крови равно 7,4. смещение рН в сторону увеличения называется алкалозом, а в сторону уменьшения – ацидозом. Различают респираторный и метаболический ацидоз и алкалоз.
• Парциальное давление СО2 в норме составляет 40 мм рт.ст. Снижение этого показателя наблюдается при дыхательном алкалозе и метаболическом ацидозе. Повышение давления СО2 отмечается при дыхательном ацидозе и метаболическом алкалозе.
• Щелочной резерв крови. Это количество мл СО2, находящегося в крови, в расчете на 100 мл сыворотки крови. Норма – 55 %. Уменьшение резервной щелочности свидетельствует об уменьшении содержания бикарбонатов в организме, а увеличение её – об увеличении их.
Дата: 2019-02-19, просмотров: 620.