Идеальными называются растворы, образование которых не сопровождается ни тепловыми, ни объемными изменениями системы (DH = 0, DV = 0). Свойства идеальных растворов не зависят от природы растворителя и растворенного вещества, а зависят только от количества частиц. При этом не имеют места какие-либо взаимодействия между частицами растворенного вещества и растворителя.
Реальные растворы не являются идеальными и в своем поведении могут лишь приближаться к модели идеального раствора, например, разбавленные растворы неэлектролитов.
При растворении дифильных веществ происходит изменение структуры воды как результат взаимодействия с гидрофобными группами сводится к минимуму. Гидрофобные группы, ассоциируясь, выталкивают молекулы воды из области своего расположения.
Термодинамика процесса растворения ΔG = (ΔH – TΔS) < 0.
ΔH – энтальпийный фактор, TΔS – энтропийный фактор. При растворении жидких и твёрдых веществ энтропия системы обычно возрастает (ΔS>0), т. к. растворяемые вещества из более упорядоченного переходят в менее упорядоченное.
Вклад энтропийного фактора, особенно заметен при повышенных Т, т. к. произведение TΔS – велико, в результате возрастает убыль ΔG. При растворении газов ΔS<0, т. к. вещество из менее упорядоченного переходит в более упорядоченное, а снижение T способствует растворению газов.
20. Элементы теории растворов электролитов. Сильные и слабые электролиты. Константы ионизации слабого электролита. Закон разбавления Оствальда.
Электролиты– это вещества с ионными или сильнополярными ковалентными связями в водных растворах, подвергающиеся электролитической диссоциации, в результат чего образуются катионы и анионы.
Сильные электролиты– вещества, способные диссоциировать нацело. К ним относится большинство солей, а так же некоторые вещества молекулярного строения (HCl).
Слабые электролиты- диссоциируют в незначительно степени, и преобладающей формой их является молекулярная (H2S, органические кислоты).
Степенью электролитической диссоциации называется отношение количества электролита, распавшегося на ионы, к общему количеству растворенного электролита.
Количественно способность молекулярного электролита к диссоциации определяется степенью ионизации(она зависит от концентрации электролита):
α= 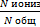 ,
,
где Nобщ – общее число молекул в растворе;Nиониз – число молекул, распавшихся на ионы.
Константа ионизации:
Kd= 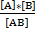 ,
,
Где [A],[B] – распавшиеся ионы
[AB] – не распавшееся на ионы вещество.
Закон разбавления Оствальда:
K= α2c/1- α ,
Где α – степень ионизации
С – молярная концентрация
21 .Коллигативные свойства разбавленных растворов неэлектролитов. Закон Рауля и следствия из него: понижение температуры замерзания раствора, повышение температуры кипения раствора.
Коллигативными свойствами называются свойства разбавленных растворов, зависящие только от количества нелетучего растворенного вещества, но не от природы растворенного вещества. Нелетучими считают такие вещества, давление пара которых ничтожно мало по сравнению с давлением пара растворителя. К коллигативным свойствам относятся:
· понижение давления пара над раствором;
· повышение температуры кипения раствора по сравнению с чистым растворителем;
· Понижение температуры замерзания растворов по сравнению с чистым растворителем;
· осмотическое давление.
· Диффузия
Первый закон Рауля
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением или упругостью насыщенного пара чистого растворителя.
Франсуа Мари Рауль:
"Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе:
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
1. Понижение давления пара над раствором Это свойство мы уже рассмотрели для случая, когда растворенное вещество является летучим (закон Рауля). При растворении нелетучего вещества давлением пара растворенного вещества можно пренебречь и учитывать лишь давление пара растворителя Р0. Давление пара растворителя над раствором нелетучего вещества может быть выражено уравнением: Р = Р0 · N1 ,
где N1 - мольная доля растворителя. «Давление насыщенного пара растворителя над разбавленным раствором Р равно произведению Р0 на мольную долю растворителя».
Таким образом, давление насыщенного пара над раствором ниже, чем над чистым растворителем, и снижается с ростом концентрации растворенного вещества.
Вместо N1 введем мольную долю растворенного вещества N2 . Учитывая, что N1+ N2 = 1, получим Р = Р0 · (1- N2).
Решив уравнение относительно N2, найдем, что (Р0- Р)/Р0 = ∆Р/Р0 = N2,
где ∆Р/Р0 – относительное понижение давления пара растворителя над раствором. «Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества». Таким образом, относительное понижение давления пара не зависит от свойств растворенного вещества. Закон Рауля точно соблюдается только для идеальных растворов и приближённо – для разбавленных.
Второй закон Рауля:
Повышение температуры кипения или понижение температуры замерзания идеальных растворов нелетучих веществ прямо пропорционально моляльной концентрации раствора:
Δ Т кип = К кип * С m
Δ Ткр = К кр * С m
Здесь Cm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиосконическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя.
Растворение нелетучего вещества в растворителе приводит к расширению температурного диапазона существования жилкой фазы: раствор замерзает при более низкой температуре, а кипит при более высокой температуре по сравнению с растворителем, т.к. моляльная концентрация раствора повышается.
Экспериментально определенное понижение температуры замерзания плазмы крови человека равно 0,56 °С, что отвечает моляльной в молярной концентрациям частиц 0,303 моль/кг или 0,303 моль/л и совпадает с величиной, полученной при измерении осмотических показателей крови. Все коллигативные свойства растворов находятся в тесной взаимосвязи.
Анализ коллигативных свойств водных растворов убедительно свидетельствует о том, что растворенные вещества сильно влияют на свойства воды как растворителя, а раствор является системой, свойства которой резко отличаются от свойств исходных компонентов.
Это очень важно понимать при изучении особенностей биожидкостей организма, которые содержат воду, электролиты, белки, углеводы и вещества в коллоидном состоянии. В то же время физико-химические свойства таких систем, а особенно биологические и физиологические функции, определяются не только качественным и количественным составом, но и структурой систем, которая динамична и еще недостаточно изучена.
Дата: 2019-02-19, просмотров: 570.