При титровании раствора смеси 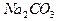 и
и 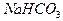 по фенолфталеину фиксируется момент титрования, когда
по фенолфталеину фиксируется момент титрования, когда 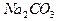 оттитрован до
оттитрован до 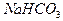 ,— расход титранта V1, а при титровании по метиловому оранжевому, когда оба компонента оттитрованы до угольной кислоты,— расход титранта V2, причем V1 < V2. Объем титранта V1 эквивалентен содержанию
,— расход титранта V1, а при титровании по метиловому оранжевому, когда оба компонента оттитрованы до угольной кислоты,— расход титранта V2, причем V1 < V2. Объем титранта V1 эквивалентен содержанию 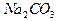 — ¦экв
— ¦экв 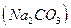 = 1/1, a V2—V1 эквивалентен содержанию
= 1/1, a V2—V1 эквивалентен содержанию 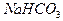 . Схема титрования раствора смеси
. Схема титрования раствора смеси 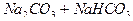 приведена на рис. 4.2.
приведена на рис. 4.2.
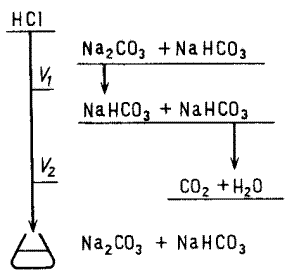
Рис. 4.2. Схема титрования раствора смеси 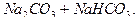
Ход работы:
1. Титрование смеси по фенолфталеину и метиловому оранжевому проводят по п. 4.2.2.
2. Содержание компонентов смеси рассчитывают по следующим формулам:
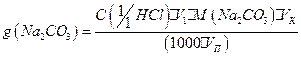
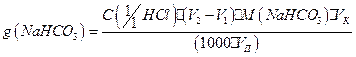
4.3. Вопросы для самоподготовки.
1. Какова роль кривых титрования?
2. В каких координатах строят кривые в разных методах титрования?
3. Обязательно ли совпадение точки эквивалентности и конечной точки титрования?
4. Назовите факторы, влияющие на вид кривой титрования (величина скачка, положение точки эквивалентности, наклон ветвей).
5. Можно ли оттитровать в водном растворе прямым способом борную кислоту. Соли аммония, ацетат-ион?
6. Сколько скачков на кривых титрования щавелевой, серной, этилендиаминтетрауксусной, угольной и фосфорной кислот гидроксидом натрия; карбоната натрия, фосфата натрия и гидрозина соляной кислоты?
7. Почему скачок титрования борной кислоты увеличивается в присутствии глицерина?
8. Укажите на кривых титрования области буферного действия, а также точку с максимальной буферной ёмкостью.
9. Как оттитровать угольную кислоту по второй ступени, фосфорную кислоту по третьей ступени?
10. Какие приёмы используют для титрования кислот и оснований с константами менее 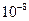 ?
?
11. Какие приёмы используют для титрования смеси электролитов с близкими константами?
12. Рассчитайте эквивалентную массу карбоната натрия, бикарбоната натрия, тетрабората натрия, карбоната кальция, оксалата натрия, иодата калия, оксида ртути, щавелевой кислоты, янтарной кислоты, бензойной кислоты, бифталата калия, бииодата калия.
13. Назовите вторичные стандартные растворы, применяемые в методе кислотно-основного титрования.
14. Почему раствор щёлочи не должен содержать карбонат-ион? Перечислите несколько способов приготовления раствора щёлочи, не содержащего карбонат-ион.
15. Как меняется вид кривой (величина скачка, положение точки эквивалентности) при изменении: а) концентрации растворов; б) констант диссоциации кислот и оснований; в) температуры?
16. Каковы предельные значения концентрации кислот и оснований, а также константы диссоциации кислот и оснований, при которых наблюдается скачок титрования?
17. Можно ли прямым методом титровать борную кислоту, соли аммония, соли уксусной муравьиной, щавелевой кислот, угольную кислоту по второй ступени и фосфорную кислоту по третьей ступени?
18. При каком условии возможно реальное титрование смеси кислот (или многоосновных кислот по ступеням)? Можно ли оттитровать по ступеням щавелевую, серную кислоту?
19. Изложите сущность ионной, хромофорной и ионно-хромофорной теорий индикаторов.
Перманганатометрия.
Цель и задачи работы.
Закрепление знаний теории окислительно-восстановительных равновесий и титриметрического анализа с применением окислительно-восстановительных реакций. Получение навыков титрования и проведения расчетов результатов анализа и их обработка. Освоение способов прямого, заместительного титрования и титрования по остатку. Контрольная задача — определение восстановителей в растворах неизвестной концентрации.
Программа работы
Определение железа (II).
Оборудование и реактивы:
1. Бюретка вместимостью 25 см3;
2. Мерные колбы вместимостью 100, 250 и 500 см3 ;
3. Колбы для титрования вместимостью 250 см3 ;
4. Пипетки Мора на 5, 10, 15, 25 см3;
5. Аналитические весы с разновесами;
6. Набор ареометров;
7. Щавелевая кислота 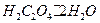 , х.ч. или ч.д.а.;
, х.ч. или ч.д.а.;
8. Перманганат калия 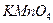 , х.ч. или ч.д.а.;
, х.ч. или ч.д.а.;
9. Серная кислота, раствор 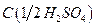 = 2 моль/дм3;
= 2 моль/дм3;
10. Фосфорная кислота, раствор 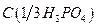 = 6 моль/дм3;
= 6 моль/дм3;
11. Соль Мора, раствор 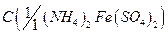 = 0,5 моль/дм3;
= 0,5 моль/дм3;
12. Хлороводородная кислота, раствор 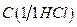 = 1
= 1 
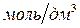 ;
;
13. Оксалат аммония, раствор 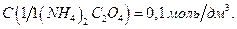 ;
;
14. Индикатор метиловый оранжевый, раствор 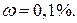 ;
;
15. Нитрат серебра, водный раствор, w = 1%;
16. Азотная кислота, 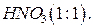 ;
;
17. Хлорид кальция, раствор 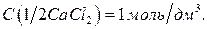
5.2.1.1. Приготовление первичного стандарта щавелевой кислоты 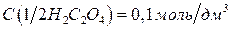
Выполняют по п.4.2.1.1. из реактива 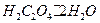 квалификации х.ч. учитывая, что
квалификации х.ч. учитывая, что 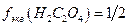 . Раствор следует готовить примерно такой же концентрации, как раствор
. Раствор следует готовить примерно такой же концентрации, как раствор 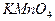 .
.
5.2.1.2. Приготовление и стандартизация рабочего раствора перманганата калия (вторичного стандарта) 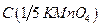 =0,1 моль/дм3
=0,1 моль/дм3
Применяемый для приготовления растворов титранта твердый перманганат калия всегда в какой-то степени загрязнён диоксидом марганца, катализирующим процесс разложения перманганата в растворе. Удаление диоксида марганца фильтрованием заметно повышает устойчивость растворов перманганата. Фильтрование следует проводить спустя некоторое время после приготовления раствора, чтобы произошло полное окисление примесей в воде, для ускорения реакции окисления раствор можно прокипятить. Для фильтрования нельзя применять бумажный фильтр, так как целлюлоза реагирует с перманганатом, образуя диоксид марганца.
Разложение раствора 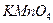 ускоряется на свету, при нагревании, под действием кислот, оснований, ионов
ускоряется на свету, при нагревании, под действием кислот, оснований, ионов 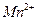 и диоксида марганца:
и диоксида марганца:
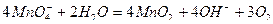
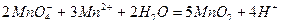
Стандартные растворы 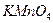 хранят в темном месте в темных склянках со стеклянными пробками.
хранят в темном месте в темных склянках со стеклянными пробками.
Для установки характеристик раствора перманганата обычно используют свежеперекристаллизованную щавелевую кислоту 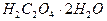 , оксалат натрия
, оксалат натрия 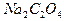 или оксалат аммония
или оксалат аммония 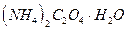 . Реакцию между перманганат- и оксалат-ионами в кислой среде можно записать:
. Реакцию между перманганат- и оксалат-ионами в кислой среде можно записать:
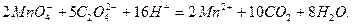
Ход работы:
1. Рассчитывают навеску, учитывая, что 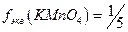 (кислая среда);
(кислая среда);
2. На технических весах в стеклянном бюксе взвешивают рассчитанную навеску исходного перманганата.
3. Количественно переносят навеску дистиллированной водой в мерную колбу, растворяют при перемешивании и доводят раствор до метки дистиллированной водой.
4. Свежеприготовленный раствор 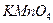 переносят в стакан, нагревают до кипения и поддерживают эту температуру приблизительно 1 ч. Затем раствор охлаждают и фильтруют через стеклянный, пористый фильтр. Можно перед фильтрованием оставить раствор при комнатной температуре на несколько дней.
переносят в стакан, нагревают до кипения и поддерживают эту температуру приблизительно 1 ч. Затем раствор охлаждают и фильтруют через стеклянный, пористый фильтр. Можно перед фильтрованием оставить раствор при комнатной температуре на несколько дней.
5. Аликвотную часть раствора щавелевой кислоты 10 см3 переносят пипеткой в коническую колбу для титрования, добавляют 10 см3 раствора 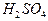 и нагревают на водяной бане примерно до 75-800С. В начале титрования следует приливать из бюретки раствор
и нагревают на водяной бане примерно до 75-800С. В начале титрования следует приливать из бюретки раствор 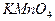 к горячему раствору оксалата по каплям. Каждую следующую каплю прибавляют после того, как исчезнет окраска от предыдущей. Титрование заканчивают, когда избыточная капля раствора
к горячему раствору оксалата по каплям. Каждую следующую каплю прибавляют после того, как исчезнет окраска от предыдущей. Титрование заканчивают, когда избыточная капля раствора 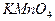 окрасит раствор в бледно-розовый цвет, не исчезающий 1 мин.
окрасит раствор в бледно-розовый цвет, не исчезающий 1 мин.
6. Проводят 3-5 титрований. Результаты заносят в таблицу 5.1:
Результаты стандартизации раствора перманганата калия.
Таблица 5.1
| № п/п | V(Н2С2О 4), см3 | С(!/2Н2С2О4 ), моль/дм3 | V(KMnO4), см3 | С(1/5KMnO4), моль/дм3 | Т(KMnO4), г/см3 |
Используя средний объем титранта, затраченного на титрование, рассчитывают характеристики раствора 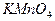 . При расчете учитывают, что в точке эквивалентности число молей эквивалента титруемого вещества и титранта равны:
. При расчете учитывают, что в точке эквивалентности число молей эквивалента титруемого вещества и титранта равны: 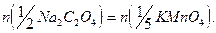
Дата: 2018-12-28, просмотров: 1079.