Анализ проводят в соответствии с п. 2.2.2. Результаты анализа раствора смеси катионов I и II аналитических групп и представляют в виде таблицы:
Таблица 2.2.
| № п/п |
Обнаруживаемый катион
Результат положительный или отрицательный
Вывод
2.3. Вопросы для самоподготовки
1. Чем отличается дробный метод анализа от систематического?
2. Какие реакции называются общими, специфическими, частными?
3. В чем преимущества систематического метода анализа смеси катионов?
4. Каковы преимущества дробного метода анализа, для решения каких задач его применяют?
5. На чем основано деление катионов на аналитические группы?
6. Какова связь деления катионов на аналитические группы с периодическим законом Менделеева?
7. Что называется внешним эффектом в качественном анализе?
8. Что такое маскировка иона и как она проводится?
9. Какие классификации ионов существуют в качественном анализе?
10. Какие требования предъявляются к реакциям в качественном анализе?
11. Что называется групповым реагентом?
12. Какие требования предъявляются к групповому реагенту?
13. Чем отличаются катионы I аналитической группы по сероводородному способу классификации катионов от других аналитических групп?
14. С чего начинается качественный систематический анализ?
15. Когда обнаруживают катионы I аналитической группы?
16. Почему в качестве группового реагента на катионы II группы применяют карбонат аммония, а не другие соединения (сульфат аммония, карбонат натрия, фосфат аммония)?
17. Чем обусловлено осаждение групповым реагентом катионов II группы при 800о С?
18. Как окрашены растворы солей катионов I и II групп?
19. Какую реакцию имеют водные растворы ацетатов катионов I и II групп?
20. Почему осаждение катионов II группы проводят при 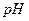 9?
9?
21. Почему осаждение катиона кальция проводят при 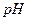 4-5?
4-5?
22. Когда и как проводится определение иона аммония?
23. Почему влажная лакмусовая бумага изменяет окраску при обнаружении иона аммония в газовой камере?
24. Почему при обнаружении иона бария дихроматом калия в осадок выпадает хромат бария, а не дихромат?
25. Почему при осаждении иона бария добавляют избыток ацетата натрия?
26. Почему обнаружение иона калия проводят в отсутствие иона аммония?
27. Как устанавливают полноту осаждения?
28. Почему карбонаты катионов II аналитической группы растворяют в уксусной кислоте, а не в соляной?
29. Можно ли обнаружить ион кальция действием оксалата аммония в присутствии иона бария?
30. Перед выполнением лабораторных работ студент должен изучить инструкции по безопасным методам работы и расписаться в журнале регистрации.
Гравиметрия (весовой анализ)
Цель и задачи работы
Усвоение принципов гравиметрического анализа, его теории и практики. Отработка навыков проведения определений элементов и веществ, технологии выполнения отдельных операций: осаждение, декантация, фильтрование, сушка, прокаливание, взвешивание и др. Изучение условий применения различных реагентов — осадителей. Выполнение контрольного определения (анализ раствора вещества неизвестной концентрации).
Программа работы
Приборы и реактивы.
1. Муфельная печь;
2. Технохимические весы;
3. Аналитические весы;
4. Водяная баня;
5. Эксикатор;
6. Стеклянные палочки;
7. Стеклянные воронки;
8. Фарфоровые тигли;
9. Стеклянные фильтры № 3-20;
10. Щипцы тигельные;
11. Термостат;
12. Химические стаканы вместимостью 100, 200 и 250 см3;
13. Мерный цилиндр вместимостью 100 см3;
14. Пипетки;
15. Колба Бунзена;
16. Водоструйный или вакуумный насос;
17. Беззольные фильтры «синяя лента», «красная лента»;
18. Хлорид бария, водный раствор, С = 3 моль/дм3;
19. Хлороводородная кислота, водный раствор, С = 6 моль/дм3 и С = 2 моль/дм3;
20. Гидроксид аммония, водный раствор, w = 10% (масс.) и С = 2 моль/дм3;
21. Нитрат аммония, водный раствор, w = 2% (масс);
22. Азотная кислота, концентрированная;
23. Диметилглиоксим динатриевая соль, водный раствор, w = 1% (масс);
24. Йод, водно-спиртовой раствор, С = 0.025 моль/дм3;
25. Карбонат натрия, водный раствор,С = 1 моль/дм3;
26. Уксусная кислота концентрированная и водный раствор, w = 20% (масс), w = 5% (масс);
27. Пероксид водорода, водный раствор, w = 30% (масс);
28. Гидроксид натрия, водный раствор, С = 2 моль/дм3;
29. Нитрон, раствор в 5%-ной уксусной кислоте, С = 0,1 моль/дм3;
30. a-Нитрозо-b-нафтола (свежеприготовленный раствор). Растворяют 8 г a-нитрозо-b-нафтола в 300 см3 концентрированной уксусной кислоты и разбавляют до 500 см3 дистиллированной водой.
Определение сульфатов
Основано на осаждении сульфат-ионов в виде кристаллического белого осадка 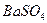 и получении гравиметрической формы
и получении гравиметрической формы 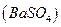 прокаливанием:
прокаливанием:
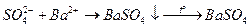
Данным методом определяют сульфатную серу, а также свободную, пиритную и сульфидную, предварительно окислив их до сульфатной.
Ход работы.
Навеску сульфата (или аликвотную часть анализируемого раствора) переносят в химический стакан вместимостью 200-250 см3 и приливают 100 см3 дистиллированной воды. К полученному раствору добавляют 2 см3 6 М раствора 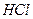 и нагревают почти до кипения на газовой горелке. В химический стакан вместимостью 100 см3 помещают 50 см3 дистиллированной воды и 6 см3 3 М раствора
и нагревают почти до кипения на газовой горелке. В химический стакан вместимостью 100 см3 помещают 50 см3 дистиллированной воды и 6 см3 3 М раствора 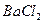 , нагревают почти до кипения на газовой горелке. Затем осторожно, по каплям, при постоянном перемешивании стеклянной палочкой, приливают нагретый раствор хлорида бария к горячему раствору сульфата, при этом палочка не должна касаться стенок стакана. Стакан с образовавшимся осадком ставят на кипящую водяную баню. Как только осадок осядет и жидкость над ним просветлеет, проводят проверку полноты осаждения сульфата бария. Для этого к раствору над осадком приливают 2-3 капли горячего раствора
, нагревают почти до кипения на газовой горелке. Затем осторожно, по каплям, при постоянном перемешивании стеклянной палочкой, приливают нагретый раствор хлорида бария к горячему раствору сульфата, при этом палочка не должна касаться стенок стакана. Стакан с образовавшимся осадком ставят на кипящую водяную баню. Как только осадок осядет и жидкость над ним просветлеет, проводят проверку полноты осаждения сульфата бария. Для этого к раствору над осадком приливают 2-3 капли горячего раствора 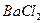 осторожно, не взмучивая осадка. Если при этом не наблюдается помутнения раствора, полнота осаждения достигнута, в противном случае приливают еще 1 см3
осторожно, не взмучивая осадка. Если при этом не наблюдается помутнения раствора, полнота осаждения достигнута, в противном случае приливают еще 1 см3 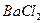 дают осадку осесть и снова проверяют полноту осаждения.
дают осадку осесть и снова проверяют полноту осаждения.
Затем стакан ставят на кипящую водяную баню на 2-3 часа для созревания осадка, после чего осадок фильтруют и промывают. Для фильтрования применяют бумажный беззольный фильтр «синяя лента». Промывная жидкость — дистиллированная вода, подкисленная 6 М раствором 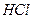 (8-10 капель на 100 см3 воды). Подсушивание, озоление фильтра и прокаливание осадка (600-800° С).
(8-10 капель на 100 см3 воды). Подсушивание, озоление фильтра и прокаливание осадка (600-800° С).
Осаждению сульфат-ионов в виде 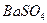 мешают анионы
мешают анионы 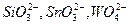 и другие, образующие осадки соответствующих кислот при подкислении раствора. Осаждению мешают также ионы
и другие, образующие осадки соответствующих кислот при подкислении раствора. Осаждению мешают также ионы 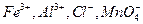 и другие, соосаждаемые с
и другие, соосаждаемые с 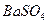 . Мешающие ионы должны быть предварительно удалены из анализируемого раствора.
. Мешающие ионы должны быть предварительно удалены из анализируемого раствора.
Массу сульфат-ионов в пробе рассчитывают по формуле
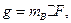
где 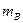 – масса гравиметрической (весовой) формы, г;
– масса гравиметрической (весовой) формы, г;
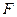 – гравиметрический фактор.
– гравиметрический фактор.
Содержание отделяемого вещества (г/дм3, моль/дм3, % масс и другие) устанавливают расчетом в соответствующей концентрации.
Результаты трех параллельных определений оформляют в таблицу 3.1 и делают их математическую обработку.
Результаты гравиметрического определения сульфатов.
Таблица 3.1.
| № опыта | Масса, г | Содержание (в соответствующих единицах) | |||
| Тигель или стеклянный фильтр | Гравиметрическая форма | Определяемое вещество | |||
| С гравиметрической формой | Пустой | ||||
Определение железа
Основано на осаждении железа (III) в виде аморфного, коричневого осадка 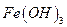 и получении гравиметрической формы
и получении гравиметрической формы 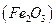 прокаливанием:
прокаливанием:
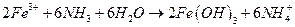
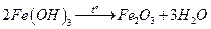 .
.
Ход работы.
Навеску образца, содержащего 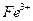 (или аликвотную часть анализируемого раствора), переносят в стакан вместимостью 100 см3, подкисляют 2-3 каплями концентрированной
(или аликвотную часть анализируемого раствора), переносят в стакан вместимостью 100 см3, подкисляют 2-3 каплями концентрированной 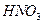 для окисления
для окисления 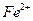 -ионов, возможно содержащихся в растворе, и для предотвращения гидролиза
-ионов, возможно содержащихся в растворе, и для предотвращения гидролиза 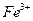 и нагревают на кипящей водяной бане до 70-800 С. К горячему раствору при постоянном перемешивании приливают 10%-й водный раствор аммиака до появления устойчивого запаха аммиака, после чего к раствору с осадком приливают 100 см3 горячей дистиллированной воды и ставят на кипящую водяную баню. После осаждения осадка, его фильтруют через бумажный беззольный фильтр «красная лента».
и нагревают на кипящей водяной бане до 70-800 С. К горячему раствору при постоянном перемешивании приливают 10%-й водный раствор аммиака до появления устойчивого запаха аммиака, после чего к раствору с осадком приливают 100 см3 горячей дистиллированной воды и ставят на кипящую водяную баню. После осаждения осадка, его фильтруют через бумажный беззольный фильтр «красная лента».
Осадок на фильтре промывают горячим 2%-м раствором нитрата аммония. Промывание заканчивают, когда проба на полноту промывания дает отрицательную реакцию на анион (например, при анализе хлорида железа (III) проба должна дать отрицательный результат на содержание 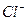 -ионов при добавлении к капле фильтрата капли
-ионов при добавлении к капле фильтрата капли 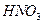 и капли
и капли 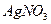 ). Промытый и подсушенный осадок озоляют и прокаливают в тигле при 1000—12000 С.
). Промытый и подсушенный осадок озоляют и прокаливают в тигле при 1000—12000 С.
Осаждению 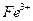 мешают катионы, осаждаемые водным раствором аммиака в виде гидроксидов
мешают катионы, осаждаемые водным раствором аммиака в виде гидроксидов 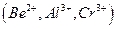 и др., а также анионы, которые в аммиачной среде образуют осадки с катионами, присутствующими в анализируемом растворе
и др., а также анионы, которые в аммиачной среде образуют осадки с катионами, присутствующими в анализируемом растворе 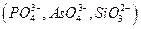 и др., осаждению мешают также катионы, соосаждаемые
и др., осаждению мешают также катионы, соосаждаемые 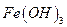 , и ионы, образующие комплексные соединения с
, и ионы, образующие комплексные соединения с 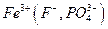 и др.. Все эти мешающие ионы перед проведением анализа должны быть удалены.
и др.. Все эти мешающие ионы перед проведением анализа должны быть удалены.
Расчет и оформление результатов анализа см. п. 3.2.1.
Определение никеля
Диметилглиоксим с ионами никеля (II) образует в аммиачной среде малорастворимый осадок диметилглиoксимата никеля ярко-розового цвета:
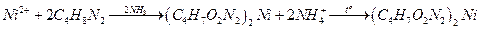
Ход работы.
Раствор, содержащий не более 30 мг никеля, разбавляют водой до 100 мл, подкисляют 2 М раствором 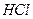 до слабокислой реакции, нагревают до 80°С и добавляют раствор реагента в небольшом избытке. Необходимо добавить 5 см3 реактива приблизительно на каждые 10 мг никеля, однако это соотношение должно быть увеличено, если в растворе присутствуют
до слабокислой реакции, нагревают до 80°С и добавляют раствор реагента в небольшом избытке. Необходимо добавить 5 см3 реактива приблизительно на каждые 10 мг никеля, однако это соотношение должно быть увеличено, если в растворе присутствуют 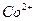 и
и 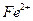 , образующие в этих условиях устойчивые хелаты. Затем добавляют 2 М раствор аммиака до появления запаха и продолжают нагревать на водяной бане не более 1 ч. Не следует проводить длительного нагревания при доступе воздуха, так как в этих условиях может образоваться нерастворимый хелат никеля. После проверки полноты осаждения, осадок пропускают через стеклянный фильтр и промывают теплой водой до исчезновения ионов
, образующие в этих условиях устойчивые хелаты. Затем добавляют 2 М раствор аммиака до появления запаха и продолжают нагревать на водяной бане не более 1 ч. Не следует проводить длительного нагревания при доступе воздуха, так как в этих условиях может образоваться нерастворимый хелат никеля. После проверки полноты осаждения, осадок пропускают через стеклянный фильтр и промывают теплой водой до исчезновения ионов 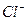 в промывных водах. Стеклянный фильтр с осадком сушат в термостате при 110-120° С до постоянной массы и взвешивают.
в промывных водах. Стеклянный фильтр с осадком сушат в термостате при 110-120° С до постоянной массы и взвешивают.
Расчет и оформление результатов анализа см. п. 3.2.1.
Определение кобальта
Определение основано на осаждении 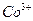 уксуснокислым раствором a-нитрозо-b-нафтола. Предварительно
уксуснокислым раствором a-нитрозо-b-нафтола. Предварительно 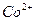 окисляют до
окисляют до 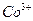 . Состав полученного осадка соответствует формуле:
. Состав полученного осадка соответствует формуле:
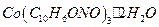
Раствор a-нитрозо- b-нафтола. Растворяют 8 г a - нитрозо - b - нафтола в 300 мл концентрированной уксусной кислоты и разбавляют до 500 см3 дистиллированной водой. Раствор готовят непосредственно перед употреблением.
Ход работы
К анализируемому раствору, содержащему не более 5 мг 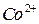 добавляют 20 капель 30%-ного раствора
добавляют 20 капель 30%-ного раствора 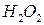 и 2 М раствор
и 2 М раствор 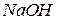 при перемешивании до начала образования черного осадка гидроксида
при перемешивании до начала образования черного осадка гидроксида 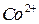 . Затем приливают 20 см3 концентрированной уксусной кислоты и, если осадок не растворился, раствор нагревают до его растворения. Разбавляют раствор до 100см3 раствора a-нитрозо-b-нафтола, доводят до кипения и продолжают нагревать на водяной бане 20-30 мин., при этом выпадает осадок красно-бурого цвета. Затем осадок фильтруют через стеклянный фильтр (№3-20 – 40 пор), промывают небольшими порциями горячего раствора уксусной кислоты и воды. Фильтр с осадком сушат при 130оС в сушильном шкафу до постоянной массы и взвешивают в виде
. Затем приливают 20 см3 концентрированной уксусной кислоты и, если осадок не растворился, раствор нагревают до его растворения. Разбавляют раствор до 100см3 раствора a-нитрозо-b-нафтола, доводят до кипения и продолжают нагревать на водяной бане 20-30 мин., при этом выпадает осадок красно-бурого цвета. Затем осадок фильтруют через стеклянный фильтр (№3-20 – 40 пор), промывают небольшими порциями горячего раствора уксусной кислоты и воды. Фильтр с осадком сушат при 130оС в сушильном шкафу до постоянной массы и взвешивают в виде 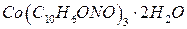 .
.
Расчет и оформление результатов анализа см. п. 3.2.1.
Определение перхлоратов
Нитрон с перхлорат-ионами в уксуснокислой среде образует малорастворимый осадок перхлората нитрония серовато-белого цвета:
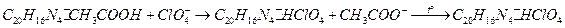
Ход работы.
Раствор, содержащий не более 100 мг перхлората, разбавляют водой до 50 см3, приливают 1 см3 ледяной уксусной кислоты, нагревают до 70° С и добавляют при перемешивании раствор нитрона в небольшом избытке. Необходимо добавить 1,5 см3 раствора на каждые 10 мг перхлората. Раствор охлаждают (охлаждение способствует полному выпадению осадка). Через 1 ч проверяют полноту осаждения. Осадок пропускают через стеклянный фильтр и промывают 2-3 раза 5% уксусной кислотой и 2 раза холодной дистиллированной водой. Тигель с осадком сушат при 100° С в термостате до постоянной массы и взвешивают.
Нитраты можно определять аналогично.
Расчет и оформление результатов анализа см. п. 3.2.1.
Дата: 2018-12-28, просмотров: 695.