Оборудование и реактивы.
1. Предметные стекла;
2. Микропробирки;
3. Пипетки;
4. Беззольные бумажные фильтры;
5. Универсальная индикаторная бумага;
6. Растворы индивидуальных катионов и анионов, 0,01 моль/дм3;
1.2.2.1. Обнаружение ионов 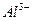
а) На ализариновую бумагу наносят каплю анализируемого раствора и выдерживают в парах аммиака до окрашивания пятна в фиолетовый цвет. При большом содержании алюминия красное окрашивание появляется сразу. Если содержание алюминия мало, то бумагу следует высушить в печи. Фиолетовая окраска ализарината алюминия исчезает, поскольку последний распадается на аммиак и желтый ализарин; при этом красный алюминиевый лак становится заметнее.
Предел обнаружения: 0,15 мкг.
Реагент: Ализариновая бумага. Беззольный фильтр погружают в насыщенный этанольный раствор ализарина, высушивают и хранят в закрытом сосуде.
Обнаружению алюминия мешают железо, уран, хром и марганец. Мешающее влияние этих элементов можно устранить осаждением гексацианоферратом (II) калия.
б) Анализируемый раствор подщелачивают до растворения первоначально выпавшего осадка. Каплю его переносят на фильтровальную бумагу и последовательно обрабатывают каплей раствора ализарина красного С и каплей уксусной кислоты. Образуется красно-фиолетовый алюминиевый лак.
Предел обнаружения: 0,67 мкг.
Реагент: Ализарин красный С (натриевая соль ализаринсульфокислоты), водный раствор w = 0,1 % (масс).
1.2.2.2. Обнаружение ионов 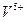
а) На предметном стекле смешивают каплю анализируемого раствора с каплей серной кислоты и через 1 минуту добавляют каплю раствора перекиси водорода. В зависимости от содержания ванадия раствор приобретает от бледной коричнево-розовой до кроваво-красной окраски.
Предел обнаружения: 2,5 мкг.
Реагенты: серная кислота, водный раствор w = 20% (масс), перекись водорода, водный раствор w = 1% (масс).
Для устранения мешающего влияния 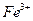 и
и 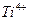 добавляют раствор
добавляют раствор 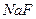 или
или 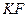 , связывающий эти катионы в комплексы
, связывающий эти катионы в комплексы 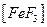 и
и 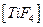 соответственно.
соответственно.
б) На фильтровальную бумагу наносят каплю анализируемого раствора и реагента. В присутствии 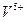 проявляется чистое голубое окрашивание.
проявляется чистое голубое окрашивание.
Предел обнаружения: 0,05 мкг.
Реагент: Сульфосалициловая кислота, раствор в 80% (масс) фосфорной кислоте, w = 2% (масс).
Обнаружению мешают 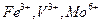 .
.
в) В микропробирке к анализируемому раствору добавляют каплю реагента. В присутствии 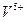 раствор окрашивается в глубокий синий цвет и флуоресцирует красным светом при УФ облучении.
раствор окрашивается в глубокий синий цвет и флуоресцирует красным светом при УФ облучении.
Предел обнаружения: 1 мкг.
Реагент: Резорцин, раствор в 80% (масс) фосфорной кислоте, w = 0,1% (масс).
В присутствии бихроматов раствор окрашивается в фиолетовый цвет, но не флуоресцирует.
1.2.2.3. Обнаружение ионов 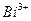
На предметном стекле смешивают каплю анализируемого раствора с каплей первого реагента а затем с каплей второго реагента. Коричневый или оранжевый осадок указывает на присутствие висмута.
Предел обнаружения: 0,05 мкг.
Реагенты: роданид аммония, водный раствор, w = 60% (масс); нитрат свинца, водный раствор, С = 0,2 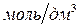 .
.
Должны отсутствовать сульфиды, иодиды, бромиды, сульфаты, хлориды. Мешают соли 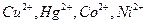 .
.
1.2.2.4. Обнаружение ионов 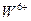
а) Одну-две капли анализируемого раствора смешивают на предметном стекле с тремя-пятью каплями реагента. В присутствии вольфрама раствор окрашивается в синий цвет или образуется синий осадок.
Предел обнаружения: 5 мкг.
Реагент: хлорид олова (II), раствор в концентрированной хлороводородной кислоте, w = 25 % (масс).
б) (В присутствии молибдена). На фильтровальную бумагу наносят каплю соляной кислоты (1:10) и затем в центр влажного пятна помещают каплю анализируемого раствора. Появляется ярко-желтое пятно трехокиси вольфрама. Если теперь пятно обработать последовательно реагентами I и II то образуется синее пятно оксидов вольфрама низших степеней окисления, окруженное красным кольцом 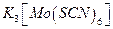 . Последнее можно обесцветить концентрированной хлороводородной кислотой.
. Последнее можно обесцветить концентрированной хлороводородной кислотой.
Предел обнаружения: 4 мкг.
Реагенты: роданид калия, водный раствор, w = 10% (масс); хлорид олова (II), раствор в 2М хлороводородной кислоте, w = 5% (масс).
1.2.2.5. Обнаружение ионов 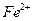
К капле анализируемого раствора (предварительно восстановленного, если это необходимо, аскорбиновой кислотой) добавляют кристаллик винной кислоты, затем каплю реагента и немного аммиака (можно выдерживать в парах). В зависимости от содержания железа появляется более или менее интенсивное красное окрашивание. При стоянии на воздухе окраска исчезает вследствие окисления комплекса железа (II).
Предел обнаружения: 0,4 мкг.
Реагент: диметилглиоксим, раствор в этаноле, w = 1% масс.
Обнаружению мешают ионы никеля.
1.2.2.6. Обнаружение ионов 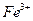
а) Реакцию можно выполнить как на фильтровальной бумаге, так и на предметном стекле при смешивании капли анализируемого раствора и реагента.
Предел обнаружения: 0,1 мкг (на бумаге), 0,05 мкг (на стекле).
Реагент: гексацианоферрат (II) калия, водный раствор, w = 5% (масс).
Обнаружению мешают большое число ионов металлов, которые дают окрашенные осадки с реагентом, и анионы, образующие комплексы с ионами железа (III) (фторид-, оксалат- и др. ионы).
б) На предметном стекле смешивают каплю кислого анализируемого раствора с каплей реагента. В присутствии железа (III) появляется более или менее глубокое красное окрашивание.
Предел обнаружения: 0,25 мкг.
Реагент: роданид калия, водный раствор, w = 1% (масс).
Соли кобальта, никеля, хрома, меди и соединения, образующие комплексы с железом (III) (фосфаты, арсенаты, оксалаты, тартраты, фториды и др.) понижают предел обнаружения.
1.2.2.7. Обнаружение ионов 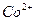
На предметном стекле к нескольким сотым грамма кристаллического тиосульфата натрия приливают каплю анализируемого раствора. В зависимости от количества присутствующего кобальта сразу или через несколько минут появляется более или менее интенсивное голубое окрашивание. Реакция ускоряется при добавлении капли этанола.
Предел обнаружения: 8 мкг.
1.2.2.8. Обнаружение ионов 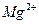
Анализируемый раствор предварительно упаривают с серной кислотой для удаления летучих кислот и аммиака. Каплю (0,005 см3) водного раствора остатка и каплю аммиака помещают на фенолфталеиновую бумагу и высушивают. При смачивании водой бумага становится розовой в месте нанесения анализируемого раствора.
Предел обнаружения: 6 мкг.
Реагент: фенолфталеиновая бумага (беззольный фильтр пропитывают 10%-ным (масс) раствором фенолфталеина в этаноле и высушивают).
1.2.2.9. Обнаружение ионов 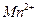
а) На фильтровальную бумагу наносят каплю реагента и затем каплю анализируемого раствора. В присутствии марганца появляется темное пятно, которое при последующем нагревании становится более отчетливым. Если присутствуют малые количества марганца, необходимо выполнение холостого опыта.
Предел обнаружения: 0,05 мкг.
Реагент: аммиачный раствор серебра. К насыщенному раствору нитрата серебра добавляют концентрированный аммиак до растворения первоначально образовавшегося осадка. Затем добавляют равный объём аммиака.
Обнаружению не мешают ионы 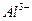 ,
, 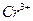 ,
, 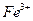 ,
, 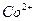 ,
, 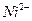 ,
, 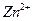 ,
, 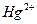 ,
, 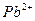 ,
, 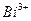 .
.
б) Анализируемый раствор упаривают с 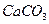 Каплю остатка наносят на фильтровальную бумагу, высушивают и облучают УФ-светом с длиной волны 365,7 нм. Желтое люминесцентное свечение указывает на присутствие
Каплю остатка наносят на фильтровальную бумагу, высушивают и облучают УФ-светом с длиной волны 365,7 нм. Желтое люминесцентное свечение указывает на присутствие 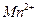 .
.
Предел обнаружения: 0,0001 мкг.
Обнаружению мешают ионы 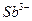 и
и 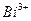
Рубиново-красная люминесценция наблюдается при высушивании раствора 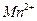 с гидрофосфатом натрия.
с гидрофосфатом натрия.
Предел обнаружения: 5 мкг.
1.2.2.10. Обнаружение ионов 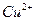
а) На фильтровальную бумагу последовательно наносят реагенты 1 и 2, высушивают, затем наносят каплю анализируемого раствора. В присутствии 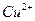 появляется коричневое пятно.
появляется коричневое пятно.
Предел обнаружения: 0,05 мкг.
Реагенты: гексацианоферрат (II) калия, водный раствор, w = 5% (масс); сульфат цинка, водный раствор, w = 10% (масс).
Определению мешают ионы 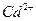 и
и 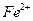 .
.
б) На фильтровальную бумагу последовательно наносят реагент, каплю 2 М раствора щелочи и каплю анализируемого раствора. В присутствии ионов 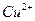 появляется коричневое пятно.
появляется коричневое пятно.
Предел обнаружения: 0,005 мкг.
Реагент: резорцин, водный раствор, w = 1% (масс).
Обнаружению мешают ионы серебра.
1.2.2.11. Обнаружение ионов 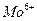 (в присутствии вольфрама)
(в присутствии вольфрама)
На фильтровальную бумагу наносят каплю соляной кислоты (1:10) и затем в центр влажного пятна помещают каплю анализируемого раствора. Появляется ярко-желтое пятно триоксида вольфрама.
Если теперь пятно обработать последовательно реагентами (роданидом калия и хлоридом олова (II)), то образуется синее пятно оксидов вольфрама низших степеней окисления, окруженное красным кольцом 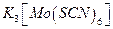 . Последнее можно обесцветить концентрированной хлороводородной кислотой.
. Последнее можно обесцветить концентрированной хлороводородной кислотой.
Предел обнаружения: 4 мкг.
Реагенты: роданид калия, водный раствор, w = 10% (масс); хлорид олова (II), раствор в 2М хлороводородной кислоте, w = 5% (масс).
1.2.2.12. Обнаружение ионов 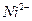
а) В присутствии солей 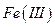 . На предметное стекло наносят последовательно каплю анализируемого раствора, каплю первого реагента, две капли второго реагента, каплю третьего реагента. Образование красного осадка на поверхности и по краям жидкости указывает на присутствие никеля.
. На предметное стекло наносят последовательно каплю анализируемого раствора, каплю первого реагента, две капли второго реагента, каплю третьего реагента. Образование красного осадка на поверхности и по краям жидкости указывает на присутствие никеля.
Предел обнаружения: 0,5 мкг. при 100-кратном избытке ионов 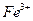 .
.
Реагенты: тартрат натрия, насыщенный раствор; карбонат натрия, насыщенный раствор; диметилглиоксим, этанольный раствор, w = 1% (масс).
б) В присутствии солей кобальта (II) и марганца (II). На фильтровальную бумагу, пропитанную раствором диметилглиоксима, наносят каплю анализируемого раствора. Затем ее погружают в разбавленный аммиак, где осторожно приводят в движение. Окрашенные диметилглиоксиматы сопутствующих металлов растворяются и на бумаге остается красное пятно диметилглиоксимата никеля.
Предел обнаружения: 0,8 мкг при 1250-кратном избытке 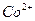 . 1,7 мкг при 590-кратном избытке
. 1,7 мкг при 590-кратном избытке 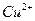 .
.
1.2.2.13. Обнаружение ионов 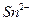
На предметное стекло наносят каплю анализируемого раствора и каплю 1% (масс) раствора хлорида железа (III). Далее по методике п. 1.2.2.5.
Предел обнаружения: 0,4 мкг.
1.2.2.14. Обнаружение ионов 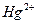
На фильтровальную бумагу наносят каплю анализируемого раствора, добавляют каплю реагента и каплю анилина. Черное или коричневое окрашивание указывает на присутствие ртути.
Предел обнаружения: 1 мкг.
Реагент: хлорид олова (II), свежеприготовленный водный раствор, w = 2-5%(масс).
1.2.2.15. Обнаружение ионов 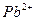
На фильтровальную бумагу наносят каплю анализируемого раствора и последовательно обрабатывают 2 М раствором щелочи и бромной водой. Когда последняя капля полностью поглотится бумагой, добавляют две капли раствора аммиака (1:1), дают ему возможность пропитать бумагу, а избыток аммиака удаляют помахиванием бумаги над слабым пламенем. Затем добавляют второй реагент, и в соответствии с количеством свинца, которое присутствует, образуется пятно, имеющее окраску от светло- до глубоко-синей.
Предел обнаружения: 1 мкг.
Реагенты: насыщенная бромная вода (насыщенный водный раствор брома); бензидин, 5% (масс) раствор в 25% (масс) уксусной кислоте.
Обнаружению мешают соли церия, марганца, висмута, кобальта, никеля, серебра и таллия. Для устранения мешающего влияния реакцию на свинец следует выполнять в щелочной вытяжке.
1.2.2.16. Обнаружение ионов 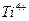
а) К капле соляно- или сернокислого анализируемого раствора на предметном стекле добавляют каплю 3% масс раствора перекиси водорода. В зависимости от концентрации титана раствор окрашивается в более или менее интенсивный желтый цвет.
Предел обнаружения: 2 мкг. Используя катионообменную смолу предел обнаружения можно снизить до 0,25 мкг.
Обнаружению мешают хроматы, ванадаты, молибдаты. Ионы железа можно маскировать фосфорной кислотой или фтор идами.
б) Каплю анализируемого раствора в микропробирке обрабатывают реагентом и добавляют к раствору кусочек металлического цинка. В присутствии титана раствор изменяет окраску с желтой на зеленую.
Предел обнаружения: 0,5 мкг.
Реагент: ализарин красный С, 0,1 %(масс) раствор.
Определению не мешают соли железа, хрома, марганца.
1.2.2.17. Обнаружение ионов 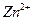
На предметном стекле смешивают каплю анализируемого раствора с каплей аммиака и каплей реагента. В присутствии цинка раствор окрашивается в голубой цвет.
Предел обнаружения: 2 мкг.
Реагент: резорцин, этанольный раствор, w = 1% (масс).
Дата: 2018-12-28, просмотров: 869.