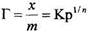Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями могут протекать по различным механизмам и носят общее название сорбции. Вещества-поглотители называют сорбентами, поглощаемые газы или растворенные вещества - сорбатами или сорбтивами.
Различают четыре основных сорбционных процесса: абсорбцию, адсорбцию, капиллярную конденсацию, хемосорбцию.
Абсорбцией называют поглощение газа или пара всем объемом твердого вещества или жидкости. Примером абсорбции служит поглощение почвенным раствором углекислого газа, поглощение твердой фазой почвы паров воды.
Адсорбция - самопроизвольное концентрирование на твердой или жидкой поверхности раздела фаз вещества с меньшим поверхностным натяжением. Адсорбируемое вещество носит название адсорбата или адсорбтива, адсорбирующее - адсорбента. Адсорбция является поверхностным процессом, который заключается во взаимодействии молекул или ионов адсорбата (газа или растворенного вещества) с поверхностью адсорбента за счет сил Ван-дер-Ваальса, водородных связей, электростатических сил. Как правило, скорость адсорбции высока.
Капиллярная конденсация представляет собой процесс сжижения пара в порах твердого сорбента. Конденсация зависит от температуры, упругости пара, диаметра капилляров, смачиваемости поверхности твердого сорбента адсорбатом в жидком состоянии. Чем уже капилляры и чем лучше жидкость смачивает их стенки, тем при прочих равных условиях скорее происходит насыщение паров и их конденсация.
Хемосорбция - наиболее глубокое взаимодействие сорбента и адсорбата с образованием нового химического соединения и представляет собой химическую адсорбцию. Другие виды адсорбции относятся к физической адсорбции. Химическая адсорбция является специфичным процессом, часто необратима, с повышением температуры возрастает, подчиняясь законам химической кинетики и равновесия гетерогенных реакций. Физическая адсорбция не носит специфического избирательного характера, является обратимым экзотермическим процессом. При повышении температуры физическая адсорбция уменьшается, десорбция увеличивается.
Изотермы сорбции,
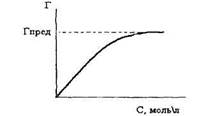
Важнейшей характеристикой сорбционного процесса является графическая зависимость количества сорбированного вещества Г от равновесной концентрации или давления при T=const, называемая изотермой сорбции (рисунок 2).
|
|
Рисунок 2. Изотерма сорбции
Для газов, растворов неэлектролитов и слабых электролитов, адсорбируемых твердыми адсорбентами, ход такой кривой для средних давлений и концентраций выражается эмпирическим уравнением Фрейндлиха
|
|
|
|
где Г - величина адсорбции на единицу массы адсорбента; р -равновесное давление газа над адсорбентом; С - равновесная концентрация раствора; К и 1/п - константы адсорбции, характерные для данного процесса адсорбции в определенных пределах, значение которых можно найти из опытных данных.
Изотерма адсорбции имеет характер кривой насыщения. При некоторой концентрации адсорбата достигается предельная адсорбция Гпред и дальнейшее увеличение концентрации адсорбата к росту величины адсорбции не приводит. Значение Гпред может быть найдено графически или математически. Дифференцирование интегральной изотермы адсорбции позволяет нам найти величину Гпред и определить концентрацию адсорбата, при которой она достигается.
Изотермы адсорбции широко используются в почвенных исследованиях при изучении процессов поглощения почвенными коллоидами различных веществ, находящихся как в газообразном, так и в жидком состоянии. Величина Гпред позволяет количественно оценить способность почвы поглощать ионы. Почвенные коллоиды имеют преимущественно отрицательный заряд, поэтому наиболее интенсивно происходит адсорбция катионов почвенным поглощающим комплексом. В последнее время доказано, что возможна и анионная адсорбция почвенными коллоидами. Важным вопросом является изучение поглощения почвой радионуклидов, ядохимикатов и продуктов их метаболизма.
Дата: 2019-02-02, просмотров: 357.