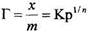ТЕМА 1. ХАРАКТЕРИСТИКА ПОЧВЫ КАК ОБЪЕКТА ИССЛЕДОВАНИЙ
1. Особенности химических процессов, протекающих в почве
2. Элементный состав почвы
3. Фазовый состав почвы
Особенности химических процессов, протекающих в почве.
Почвообразование осуществляется в результате протекания следующих процессов:
- трансформация органических и минеральных компонентов почвы;
- перенос вещества;
-специфические сложные процессы формирования отдельных почвенных горизонтов или почвенного профиля.
Практически все процессы имеют сложный комплексный характер. Почва как природное тело характеризуется рядом особенностей, связанных с данными химическими процессами.
Полихимизм. Почва содержит большой набор химических элементов и веществ. Один элемент представлен, как правило, несколькими соединениями (часто в разных степенях окисления). Одно и то же вещество может находиться в различных аллотропных модификациях, в кристаллическом или аморфном состояниях.
Гетерогенность и полидисперсность. Почва является многофазной системой с развитыми и неоднородными поверхностями раздела, на которых протекают процессы сорбции и десорбции (включая хемосорбцию) органических и минеральных компонентов.
Органо-минеральные взаимодействия. В почвах формируются не только простые и комплексные соединения, но и сложные адсорбционные комплексы, состоящие из минералов и органических веществ.
Динамичность почвенных процессов. В почве наблюдается суточная, сезонная, годовая и вековая динамика органических и неорганических компонентов. Изменения непрерывны, что заставляет трансформировать классические химические представления и понятия, например, буферность почв.
Пространственная неоднородность. Почвенное свойство, обусловленное исходной пространственной неоднородностью факторов почвообразования (первичная неоднородность). Она может нарастать по мере развития почвообразовательного процесса (вторичная неоднородность).
Неравновесность состояний и термодинамическая необратимость процессов. Почва является открытой термодинамической системой, через которую непрерывно протекает поток энергии и вещества, не позволяющий достичь равновесных состояний. Это усугубляется своеобразной кинетикой почвенно-химических процессов, в которых сочетаются быстрые и медленные реакции.
Основой понимания происходящих в почвах процессов является знание химического состава почв и его изменений при почвообразовании и использовании почвенного покрова. В целом химический состав почв характеризуется двумя показателями: элементным и фазовым (вещественным) составом.
Элементный состав почвы.
Элементный состав почвы - первая и необходимая характеристика почв, на которой базируется понимание их свойств, генезиса и плодородия.
Элементным составом почвы называют набор и количественное соотношение химических элементов в почвенной массе. Часто вместо понятия «элементный» используют понятие «валовой», однако этот термин менее точен, его использование является не совсем корректным.
Элементный состав используется при решении многих задач:
- оценка направленности и итогов почвообразовательного
процесса (разные горизонты содержат разное количество элементов, например, перегнойно-аккумулятивные горизонты содержат повышенное количество углерода, фосфора, азота, иллювиальные накапливают железо, алюминий и ряд других элементов);
- оценка потенциального плодородия почвы (высокое содержание углерода и азота - признак плодородной почвы, повышенное содержание хлора неблагоприятно для роста и развития растений);
- разработка и выбор методов анализа (многие элементы взаимно мешают при определении, необходимо использовать методы разделения и концентрирования.
Основные особенности элементного состава почвы:
- большой набор элементов;
- сочетание высокого содержания углерода и кремния, отражающее одновременное влияние двух факторов почвообразования: растительного и животного мира с одной стороны и почвообразующих пород - с другой;
- большой диапазон концентраций, охватывающий четыре-
пять порядков и достигающий девяти-десяти порядков.
Для количественной оценки элементного состава широко используется способ вычисления результатов в % высших оксидов элементов, входящих в состав почвы. Данный подход в основном используют для макроэлементов. При полном валовом анализе почвы учитывают: SiO2, AI2O3, Fe2O3, TiO2, Na2O, K2O, MnO, CaO, MgO, SO3, P2O5. Достоинство этого способа заключается в возможности быстрой проверки правильности выполнения анализа. В первом приближении в расчете на прокаленную навеску почвы сумма высших оксидов близка к 100%. Допустимы отклонения до 1,0-1,5%. Такая проверка условна, так как не во всех почвах и не всегда валентное состояние элементов отвечает их высшим оксидам, не все элементы в почвах представлены кислородными соединениями. Недостатком данного подхода является необходимость все расчеты проводить на высшие оксиды. Элементы могут быть представлены и бескислородными соединениями.
Более правильным является подход, когда содержание элемента оценивается в моль на определенную массу или объем почвы. Допустимо использовать мольные доли и мольные проценты. Расчеты проводятся по-разному:
- на воздушно-сухую массу (навеску) почвы;
- на абсолютно сухую (высушенную при 105 °С) навеску;
- на прокаленную почву;
- на безгумусную массу почвы;
- на бескарбонатную почву;
- на определенный объем почвы.
Например, процент азота в органической части почвы важен при характеристике гумусного состояния. Пересчеты на безгу-мусную, бескарбонатную и прокаленную почву необходимы для суждения о перераспределении элементов в профиле почв под воздействием почвообразовательного процесса.
Расчет мольных отношений элементов позволяет получить принципиально важную и новую информацию о свойствах почв и протекающих в них процессах. Наиболее информативны и часто используются соотношения С:Н, C:N, C:O, SiO:Al2O3.
Соотношение С:Н характеризует тип строения органического вещества, C:N - обогащенность гумуса азотом, SiO:Al2O3 - дополнительный диагностический признак при определении минералогического состава. Расчет соотношений проводится по данным процентного содержания элементов и их атомных масс, например:
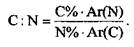 (1)
(1)
Фазовый состав почвы.
Элементный состав почвы становится сравнительно малоинформационным, когда приходится решать вопрос о механизмах почвенных процессов и законах, которым эти процессы подчиняются. Понимание этих процессов опирается на вещественный состав почвы. Понятие вещественного состава тесно связано с понятием фазового состава почвы. Одно вещество может быть представлено несколькими фазами. Например, кальцит СаСО3 может образовать три фазы: кальцит, арагонит, люблинит. С другой стороны, несколько веществ могут входить в состав одной фазы.
Характерной чертой любой почвы является ее многофазность. Молекулы одного типа могут входить в состав разных фаз, поэтому в неодинаковой степени участвуют в химических реакциях.
Фазой называется совокупность гомогенных частей гетерогенной системы, обладающих одинаковым составом и одинаковыми термодинамическими свойствами независимо от массы.
Общее число фаз в почве велико. Все они могут быть подразделены на три части: твердую, жидкую и газообразную.
Почва является термодинамически открытой системой, которая испытывает постоянное воздействие магнитного поля и поля тяготения Земли. Однородность почвенного раствора нарушается за счет движения воды, что приводит к миграции компонентов почвы.
ТЕМА 2. МЕТОДЫ ОПРЕДЕЛЕНИЯ ЭЛЕМЕНТНОГО СОСТАВА ПОЧВ
1. Подготовка почвенных образцов к анализу
2. Способы разложения почвы
3. Методы определения кремния
4. Методы определения валового содержания макрокомпонентов
5. Методы определения микрокомпонентов
6. Общая характеристика методов, не требующих разрушения почвы
Одной из важнейших характеристик почвы является ее элементный состав, качество определения которого во многом определяется соблюдением требований стандарта при проведении отбора и подготовки проб к анализу. Результаты элементного анализа используются при изучении биогеохимических циклов химических элементов в почвообразовательных процессах, что позволит выявить закономерности биологической продуктивности почв в разных природных зонах.
В условиях интенсивного земледелия почвенные исследования, направленные на оценку содержания макро- и микроэлементов в питании растений актуальны. Они позволяют, с одной стороны, оценить пригодность почвы для сельскохозяйственного производства, с другой стороны, изучить влияние средств химизации на процессы почвообразования. На современном этапе развития аналитической химии наряду с классическими методами (гравиметрические и титриметрические методы анализа) широко используются современные физико-химические и физические методы, характеризующиеся простотой и экспрессностью выполнения и важные для проведения серийных анализов.
Подготовка почвенных образцов к анализу.
Отобранные почвенные образцы высушивают в хорошо проветриваемом помещении или в сушильных шкафах при температуре не более 40С. Исключение составляют пробы, анализ которых необходимо проводить при естественной влажности (содержание нитратов, двухвалентного железа и т.д.). Воздушно-сухой образец массой 400-1000 г распределяют тонким слоем на листе бумаги в виде квадрата, раздавливают крупные комки и отбирают крупные корни, включения и новообразования. Затем методом квартования сокращают пробу. Часть пробы оставляют на хранение в нерастертом состоянии с этикетками внутри коробки. Другую часть анализируемой пробы оставляют для определения органического углерода и азота. В этой пробе аккуратно выбирают корни и другие органические остатки (спорный вопрос). Оставшуюся пробу почвы измельчают на мельнице или в фарфоровой ступке и просеивают через сито с отверстиями в 1 мм. При наличии скелета (частиц крупнее 1 мм) его отмывают на сите от мелкозема, просеивают через колонку сит с отверстиями 10, 5, 3 и 1 мм и вычисляют содержание каждой фракции. Мелкозем (< 1 мм) помещают в картонные или пластиковые коробки и используют для большинства анализов.
Способы разложения почвы.
Процесс разложения почвы состоит в разрушении минералов, входящих в ее состав, и последующем растворении как продуктов разложения минералов, так и других компонентов почв. В элементном анализе почв используют методы кислотного разложения, сплавление и спекание. Выявлена связь между способностью минералов к разложению и их составом: 1) минералы тем легче разлагаются кислотами, чем меньшая доля в составе минерала приходится на S1O2 или чем меньше отношение оксида кремния к сумме оксидов металлов; 2) минералы разлагаются тем легче, чем более основный характер имеет металл, входящий в состав силиката (силикат натрия растворяется в воде, силикат кальция легко разлагается кислотами, на силикат алюминия кислоты практически не действуют).
Рассмотрим каждый из указанных способов разложения.
Разложение кислотами
Для разложения почв могут быть использованы различные минеральные кислоты HF, HC1, HNO3, HC1O4, H2SO4. Серная кислота применяется редко из-за трудной растворимости некоторых сульфатов — щелочно-земельных металлов, свинца. Обычно для разложения используют смеси серной кислоты с другими кислотами. Хлорная кислота - хороший растворитель, но при концентрировании она может взорваться в присутствии следов органического вещества. Это делает неудобным ее использование. Разложение некоторых минералов и частичное разложение почв часто проводят соляной кислотой. Применение ее удобно, так как большинство хлоридов растворимо. Соляная кислота летуча, ее избыток можно легко удалить. Необходимо учитывать, что некоторые хлориды являются летучими соединениями (хлорид ртути (II), хлорид мышьяка (III) и др.).
В практике анализа почв (например, для определения некоторых микроэлементов) используют смесь соляной, азотной и серной кислот. Это позволяет добиться большей полноты и скорости разложения анализируемого материала. Чаще всего для определения общего содержания микроэлементов и в тех случаях, когда нет необходимости в точном определении кремния, разложение почв проводят плавиковой кислотой. Впервые для разложения плавиковую кислоту применил Берцелиус в 1823 г. Действие ее на силикаты своеобразно: при взаимодействии с кремнием образуется летучее соединение четырехфтористого кремния: SiO2 + 6HF = H2SiF6 + 2Н2О
H2SiF6 = SiF4t+2HF SiO2 + 4HF = SiF4t + 2H2O
В результате разложения почвы плавиковой кислотой кремний полностью удаляется в форме S1F4, металлы переводятся в форму сульфатов, так как обработка проводится в присутствии серной кислоты. Некоторые минералы плавиковой кислотой не разлагаются (топаз, силлиманит, некоторые турмалины). Перед разложением плавиковой кислотой почву прокаливают, чтобы разрушить органическое вещество, иначе оно будет дальнейшему определению других элементов.
Сплавление
При сплавлении происходит обогащение почвы щелочными металлами, силикаты почвы переходят в состояние, разлагаемое водой или кислотами. Реакцию почвы с соединениями щелочных металлов проводят при высокой температуре в расплавленном состоянии, что способствует эффективному разложению минералов. Для сплавления используют различные по составу плавни. Выбор плавня определяется составом почв, набором элементов, которые требуется определить, и методами анализа. Может быть проведено щелочное сплавление (карбонаты натрия или калия, гидроксиды натрия или калия), кислое сплавление (с гидросульфатом или пиросульфатом калия или натрия), окислительное сплавление (с перекисью натрия) и восстановительное сплавление.
В анализе почв наиболее широко используется щелочное сплавление со смесью карбонатов натрия и калия. Сплавление проводят при температуре 1000°С в платиновых тиглях. Примером реакции, протекающей при сплавлении, может служить взаимодействие с плавнем ортоклаза, первичного минерала, входящего в состав почв:
KAlSi3O8 + 3Na2CO3 = KA1O2 + 3Na2SiO3 + 3CO21
Карбонатные плавни способствуют окислению некоторых элементов (например, серы, марганца, хрома) и тем самым облегчают разложение почв. Например, реакция плавня с ионами Мп (II) и ионами Мп (IV)
MnSiO3 + 2Na2CO3 + О2=Na2Mn04 + Na2Si03 + 2CO2 T 2МпО2 + 2Na2CO3 + О2 = 2Na2Mn02 + 2CO21
Сплавление - универсальный способ разложения почв и пород. Присутствие примесей в плавнях, большое количество калия и натрия оказывает влияние на результаты анализа, что ограничивает применение данного метода. В процессе сплавления происходит коррозия платиновых тиглей, возможен обмен элементами между плавом и стенками тигля.
Спекание
При спекании могут быть использованы приемы, позволяющие платиновые тигли заменить на фарфоровые.
Реакцию спекания относят к реакциям в твердой фазе, то есть к таким реакциям, в которых как исходные вещества, так и конечные продукты твердые. Эти процессы в большинстве случаев сложны и до сих пор мало изучены.
При спекании почвы непродолжительное время нагревают с небольшим количеством плавня. В результате образуется пористая масса-спек, которая легко разлагается кислотами. В процессе спекания происходит разрыхление кристаллической решетки и диффузия ионов щелочных металлов в глубь решетки кристаллов. Диффузия ионов натрия идет быстрее, чем диффузия ионов калия. Используется разложение почв спеканием с карбонатом натрия.
3. Методы определения кремния.
Кремний в почвах встречается в форме диоксида кремния, его гидратов и солей кремневых и алюмокремниевых кислот - силикатов и алюмосиликатов. Эти соединения труднорастворимы в воде, кислотах и щелочах.
Общее содержание кремния в почвах определяют гравиметрическим методом, водорастворимый кремний - фотометрическим.
Растворы кремниевой кислоты, которые получают при растворении плава соляной кислотой, неустойчивы. Молекулы кремниевой кислоты склонные к поликонденсации, причем могут образовываться не только линейные полимеры, но и разветвленные и сетчатые пространственные структуры. Кремниевые кислоты различной степени полимеризованности обладают следующими свойствами:
- неполимеризованные моно- и дикремниевые кислоты можно
определить фотометрическим методом, так как они образуют ок
рашенное в синий цвет соединение при взаимодействии с молиб-
датом-ионами. Полимеризованная кислота окраску не дает;
- полимеризованные кремниевые кислоты легко коагулируют
и выпадают в осадок, особенно при добавлении желатина. Непо-
лимеризованная кремниевая кислота желатином не осаждается.
Рассмотрим подробнее методы определения кремния.
Гравиметрический метод определения кремния достаточно стар, обладает хорошей воспроизводимостью и позволяет получать правильные результаты. Метод основан на осаждении поли-меризованной кремниевой кислоты, дегидратации осадка высушиванием и прокаливанием и взвешивании безводного диоксида кремния. В процессе анализа кремниевую кислоту полимеризу-ют, дегидратируют и коагулируют. В практике анализа почв используют два метода выделения кремниевой кислоты в осадок: соляной кислотой и желатиновый. Растворимость образующегося геля достаточно высока, поэтому его не следует выдерживать с раствором продолжительное время: фильтрование и промывание осадка необходимо проводить как можно быстрее. Гравиметрической формой кремниевой кислоты является диоксид кремния.
Чтобы избежать образование карбида кремния вместо оксида кремния, озоление фильтра ведут медленно при доступе кислорода воздуха. В присутствии карбида кремния осадок оксида кремния имеет сероватый оттенок. Полная дегидратация оксида кремния достигается при температуре 358°С. Однако оксид кремния, полученный прокаливанием при низкой температуре, обладает высокой гигроскопичностью, что делает невозможным получение правильных результатов. Прокаливание при температуре 1000-1200°С уменьшает поверхность осадка и понижает его гигроскопичность. Расчет содержания кремния в почве ведут по массе полученного осадка.
Фотометрические методы определения кремния в почвах применяются редко. Определение основано на реакции образования гетерополикислоты при взаимодействии силикат-ионов с молибдатом аммония.
4. Методы определения валового содержания макрокомпонентов.
Фосфор. В аналитической химии фосфора наибольшее значение имеет ортофосфорная кислота. В форме ортофосфатов фосфор встречается в составе минеральных компонентов почв, в форме фосфат-иона присутствует в растворах, получаемых при разложении почв.
При определении в почве общего содержания фосфора необходимо провести минерализацию органической части. Это можно сделать, например, разложением смесью серной и хлорной кислот, азотной и хлорной кислот. Разложение проводится в колбах Кьельдаля путем кипячения. Затем в полученной смеси осаждают железо добавлением K4[Fe(CN)6] и нейтрализуют раствор.
Разработаны и ранее широко применялись гравиметрические методы. Наиболее точным, но трудоемким является метод двойного осаждения, заключающийся в осаждении фосфора молибда-том аммония и последующем взвешивании осадка. В настоящее время данный метод имеет лишь историческое значение.
Валовое содержание фосфора и подвижные формы соединений фосфора в почвах определяют фотометрическим методом по реакции образования гетерополикислоты с молибдатом аммония. Поликислоты - это особый тип комплексных соединений, образование которых связано с заменой кислорода кислородсодержащих кислот на анион той же кислоты (изополикислоты) или на анион другой кислоты (гетерополикислоты). При замене кислорода ортофосфорной кислоты анионом молибденовой кислоты образуется фосфорномолибденовая гетерополикислота H3[P(Mo3О10)4]∙xH2О. Фосфорномолибденовая гетерополикислота обладает слабой желтой окраской (λ=300 - 315 нм, є=2,5∙104). Более широко для фотометрического определения используют восстановленную форму фосфорномолибденовой гетерополикислоты, окрашенную в синий цвет. При введении в раствор восстановителей (например, аскорбиновая кислота, хлорид олова (II)) молибден (VI) восстанавливается до молибдена (V).
Калий. Содержание калия в почве определяется в основном минералогическим составом. Меньшее количество калия содержится в почвенном растворе, больше его в обменной форме (0,5-3,0% от валового содержания), еще больше калия находится в почве в необменной форме (до 5% от валового содержания), 90-95% калия сосредоточено в составе почвенного скелета. Выделяют методы определения обменного калия, необменного калия, калийного потенциала. Обменный калий извлекается из почвы действием растворов кислот:
0,2 н раствором соляной кислоты (метод Кирсанова рекомендован для подзолистых, дерново-подзолистых, серых лесных почв);
0,5 н раствор уксусной кислоты (метод Чирикова рекомендован для некарбонатных черноземов, серых лесных почв).
Определение необменного калия основано на различной растворимости первичных калийсодержащих минералов в кислотах: легче растворяются слюды (биотит, мусковит), труднее - гидрослюды, нефелин и труднорастворимые полевые шпаты. Наибольшее распространение получила горячая вытяжка 10%-й соляной кислоты, предложенная К.К. Гедройцем. В эту вытяжку переходит необменный калий почвенных коллоидов и фиксированный почвой из удобрений. Количественно калий определяют методом пламенной фотометрии.
Азот. Общий запас азота в почве является важнейшим показателем ее потенциального плодородия. Наиболее распространенным методом определения общего азота является озоление в кипящей кислоте. Метод предложен Кьельдалем в 1883 г.
Для отгонки аммиака образовавшуюся в результате сжигания суспензию переносят в отгонную колбу и, нейтрализуя кислоту щелочью, отгоняют аммиак в приемник, где он поглощается кислотой:
(NH4)2SO4 + 2NaOH = 2NH3↑+ Na2SO4 + 2H2O
2NH3 + H2SO4 = (NН4)2SO4
Избыток серной кислоты титруется раствором щелочи
H2SO4 + 2NaOH = Na2SO4 + Н2О
По количеству оставшейся свободной серной кислоты рассчитывается количество поглощенного аммиака. В качестве поглотителя вместо серной кислоты часто используют борную
Н3ВОз + 3NH4OH = (NH4)3BO3 + ЗН2О
Борат аммония оттитровывается серной кислотой в присутствии индикатора Гроака (переход окраски из зеленой в фиолетово-красную):
(NH4)3BO3 + H2SO4 = 2Н3ВО3 + 3(NH4)2SO4
В результате учитывается органический азот и азот в аммиачной форме. Поскольку содержание нитратного и нитритного азота в почвах мало, его можно не учитывать. Образовавшийся аммиак либо отгоняют, либо определяют фотометрически. Если необходимо учесть содержание нитратного и нитритного азота, то используют модифицированные методы Кьельдаля. Например, озоление может быть проведено фенолсерной кислотой (метод Кьельдаля-Иодльбауера).
Методы фотометрического определения общего азота высоко чувствительны. В основе определения лежит образование желтого комплекса аммиака с реактивом Несслера или реакция с фенолом в присутствии окислителя гипохлорита натрия в щелочной среде с образованием индофенола, имеющего синюю окраску.
Железо. В валовом анализе почвы определяют общее содержание всех форм железа. Определение железа проводят в вытяжке сразу после определения кремния. Используют фотометрические и титриметрические методы анализа. Арбитражным является атомно-абсорбционный метод определения железа.
Фотометрическое определение проводят с сульфосалициловой кислотой. В кислой среде ионы железа (III) образуют с сульфосалициловой кислотой комплекс красного цвета. Ионы железа (II) в реакцию не вступают. В щелочной среде желтый комплекс образуют ионы железа (III) и ионы железа (II). Коэффициент светопоглощения выше в последнем случае, поэтому суммарное количество железа (III) и железа (II) определяют по реакции образования желтого комплекса в щелочной среде.
Комплекснометрическое определение основано на образовании комплекса железа с ЭДТА (этилендиаминтетрауксусной кислотой). Комплекс Fe3+ : ЭДТА устойчивее комплекса Fe2+ : ЭДТА в 1010,8 раз. Титрование проводят в кислой среде при нагревании. В качестве индикатора используют сульфосалициловую кислоту. Fe2+ предварительно окисляют до Fe3+ действием например концентрированной азотной кислоты.
Алюминий. Для определения общего содержания алюминия в почве используют гравиметрические, фотометрические и титриметрические методы анализа. Алюминий из раствора осаждают в виде гидроксида алюминия аммиаком, добавляя последний до изменения окраски метилового красного (рН 4,4-6,2). Совместно с алюминием выпадают оксиды титана, алюминия, хрома. Выпавший осадок отфильтровывают, промывают раствором нитрата аммония и прокаливают при 900-1000С. Основную долю в составе прокаленного осадка составляют оксид алюминия и железа (полуторные оксиды). Содержание алюминия находят по разности, определяя прямыми методами железо, титан и фосфор. Алюминий может быть определен гравиметрически в форме внутрикомплексного соединения с оксихинолином. Фотометрические методы основаны исключительно на реакциях с окрашенными органическими реагентами, так как ионы алюминия не обладают хромофорными свойствами. Для фотометрического определения алюминия используют трифенилметановые красители, алюминон, ксиленоловый оранжевый. Реакции данных веществ с алюминием неспецифичны, поэтому требуется предварительное маскирование мешающих ионов. Возможно комплексонометрическое определение алюминия. Комплекс алюминия с ЭДТА малоустойчив, поэтому проводят обратное титрование в кислой среде при нагревании. Избыток ЭДТА оттитровывают чаще всего солями цинка, в качестве индикатора используют дитизон.
5. Методы определения микрокомпонентов.
Бор. Для определения бора предложен ряд методов. Наиболее широко используются фотометрические. В их основе лежат два типа процессов:
- образование окрашенных комплексов бора с производными «-оксиантрахинона, хинализарином, кармином, в которых ОН-группа сопряжена с хинонной группировкой в концентрированной серной кислоте;
- образование окрашенных комплексов с куркумином, азоме-тиновыми соединениями в слабокислой и щелочной средах.
При подготовке необходимо учитывать, что соединения бора летучи. Определять бор необходимо при низких температурах, выпаривать можно только щелочные растворы. Возможно загрязнение бором из химической посуды или реактивов. Для определения бора необходимо использовать платиновую, кварцевую или пластмассовую посуду, безборное стекло, не хранить пробы в бумажных пакетах.
Марганец в почвах представлен в основном двумя формами: Мn2+, Мn4+. При разложении почвы сплавлением с карбонатом натрия в плаве марганец присутствует в виде манганат-ионов МnО42-. При последующем растворении плава в соляной кислоте восстанавливается до Мn2+. Для количественного определения марганца используют спектроскопические, электрохимические, ядерные методы.
Для серийных анализов широко используются фотометрические методы определения марганца с формальдоксимом, персульфатом калия и периодатом калия. Персульфатный и перио-датный методы основаны на образовании марганцевой кислоты и различаются по способу окисления Мn2+ до МnО42-. Эти методы отличаются большой селективностью, хотя и малочувствительны.
Метод определения марганца с формальдоксимом (CH2=N=OH) основан на образовании бесцветного комплекса, который в щелочной среде быстро окисляется атмосферным кислородом в устойчивое красновато-коричневое соединение [Мп(СН2О)6]2-. Определению мешают ионы Fe2+, Cu2+, Ni2+, Со2+, которые с формальдоксимом образуют аналогичные окрашенные соединения. При этом в щелочной среде металлы могут давать осадки. Для устранения мешающего влияния указанных ионов добавляют цианиды или аскорбиновую кислоту.
Молибден может быть определен как атомно-абсорбционным, так и фотометрическим методом. Вследствие низкой концентрации элемента в биологических объектах и низкой чувствительности атомно-абсорбционного метода молибден определяется после предварительного концентрирования и очищения проб от матричных элементов.
Селективных фотометрических реагентов для определения молибдена не существует. Чаще всего для этого используется дитиол и роданид, с которыми в кислой среде (раствор серной или соляной кислоты) ионы Мо (V) образуют окрашенные комплексы. Роданидный метод основан на способности молибдена образовывать окрашенные в оранжевый цвет комплексы с роданид-ионом и последующей экстракцией его органическими растворителями (бутанолом, амиловым спиртом, амилацетатом, эфиром, хлороформом, циклогексаном) и фотометрированием. Определению мешают титан, ванадий, хром, вольфрам и другие элементы. Вольфрам можно маскировать лимонной или винной кислотой, другие элементы необходимо отделять.
Медь. Для определения меди в биологических объектах требуются высокочувствительные методы, так как содержание меди в растениях редко превышает 20 мг/кг сухого вещества. Содержание подвижных форм в почве не превышает 5 мг/кг, тогда как минимальные концентрации меди в биологических объектах могут быть на порядок меньше.
Арбитражным методом определения меди является атомно-абсорбционный. Текущими являются экстракционные методы. Наиболее распространен экстракционный метод с диэтилдитиокарбаматом свинца. Он основан на образовании окрашенного комплекса ионов Си (ІІ) с диэтилдитиокарбаматом натрия, растворимого в органических растворителях. Метод не является специфическим, поэтому требуется строгое соблюдение рН, маскирование и отделение мешающих ионов. В связи с этим для определения меди в биологических объектах в качестве реагента используют бесцветную соль диэтилдитиокарбамата свинца. Ионы свинца из этой соли могут вытеснить только ионы меди, серебра и ртути, образующие с диэтилдитиокарбаматом соединения с большей величиной констант устойчивости. Так как серебро и ртуть в незагрязненных биологических объектах практически отсутствуют, метод является специфическим для меди.
Кобальт. Для кобальта характерны степени окисления +2, +3. В ионном состоянии более устойчив Со+2, в комплексах - Со+3.
При определении кобальта наиболее часто применяются методы, в которых используются органические реагенты - производные нитрозонафтолов, пиридиновые азосоединения. Они содержат характерные группировки, являющиеся в определенных условиях специфичными для кобальта и обладающие высокой чувствительностью. Одним из наиболее распространенных реагентов является нитрозо-R-соль, являющаяся производной 1-нитрозонафтола-2. Реакцию проводят при нагревании в слабокислой среде в пристутствии ацетатного буферного раствора. В ходе реакции Со+2 окисляется до Со+3. Мешающее влияние железа устраняют добавлением цитрата натрия и смеси фосфорной и азотной кислот.
СОСТАВА ПОЧВ
1. Общая характеристика ионно-солевого состава почв как
объекта исследований
2. Методы определения карбонатов и гипса
3. Изучение емкости катионного обмена
Почва является полихимической системой. Ионно-солевой состав определяет важнейшие физические, физико-химические и химические свойства почвы, является показателем направленности почвообразовательных процессов. В лабораторной практике широко используются методы определения различных солей в водной и солевой вытяжках, позволяющие оценить содержание различных по доступности растениям форм тех или иных ионов и сделать выводы о пригодности почвы для возделывания сельскохозяйственных культур.
Изотермы сорбции,
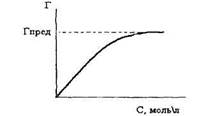
Важнейшей характеристикой сорбционного процесса является графическая зависимость количества сорбированного вещества Г от равновесной концентрации или давления при T=const, называемая изотермой сорбции (рисунок 2).
|
|
Рисунок 2. Изотерма сорбции
Для газов, растворов неэлектролитов и слабых электролитов, адсорбируемых твердыми адсорбентами, ход такой кривой для средних давлений и концентраций выражается эмпирическим уравнением Фрейндлиха
|
|
|
|
где Г - величина адсорбции на единицу массы адсорбента; р -равновесное давление газа над адсорбентом; С - равновесная концентрация раствора; К и 1/п - константы адсорбции, характерные для данного процесса адсорбции в определенных пределах, значение которых можно найти из опытных данных.
Изотерма адсорбции имеет характер кривой насыщения. При некоторой концентрации адсорбата достигается предельная адсорбция Гпред и дальнейшее увеличение концентрации адсорбата к росту величины адсорбции не приводит. Значение Гпред может быть найдено графически или математически. Дифференцирование интегральной изотермы адсорбции позволяет нам найти величину Гпред и определить концентрацию адсорбата, при которой она достигается.
Изотермы адсорбции широко используются в почвенных исследованиях при изучении процессов поглощения почвенными коллоидами различных веществ, находящихся как в газообразном, так и в жидком состоянии. Величина Гпред позволяет количественно оценить способность почвы поглощать ионы. Почвенные коллоиды имеют преимущественно отрицательный заряд, поэтому наиболее интенсивно происходит адсорбция катионов почвенным поглощающим комплексом. В последнее время доказано, что возможна и анионная адсорбция почвенными коллоидами. Важным вопросом является изучение поглощения почвой радионуклидов, ядохимикатов и продуктов их метаболизма.
ТЕМА 1. ХАРАКТЕРИСТИКА ПОЧВЫ КАК ОБЪЕКТА ИССЛЕДОВАНИЙ
1. Особенности химических процессов, протекающих в почве
2. Элементный состав почвы
3. Фазовый состав почвы
Дата: 2019-02-02, просмотров: 452.