1. Что такое обеззараживание воды?
а) действие факторов, убивающих патогенные микроорганизмы;
б) биологическое воздействие с целью очистки воды от бактерий;
в) действие физико – химических факторов с целью очистки воды от биологически – активных ингредиентов.
2. Какие соединения хлора являются наиболее эффективными реагентами при обеззараживании воды:
а) хлорноватистая кислота, гипохлорит – ион;
б) хлороводородная кислота, хлорит – ион;
в) хлористый натрий, хлорит – ион.
3. Механизм действия на бактериальную клетку гипохлорит – иона:
а) гипохлорит ион является ингибитором роста и размножения бактерий;
б) гипохлорит ион вступает в реакцию с ферментами бактерий и нарушает обмен веществ в бактериальной клетке;
в) гипохлорит ион замедляет усвоение соединений фосфора и окислительное фосфорилирование.
4. Указать правильное утверждение. Хлор при растворении в воде образует…
а) HCl и ClO2;
б) HCl и HOCl;
в) HOCl и ClO2.
5. Указать формулу хлорной извести:
А) Ca(ClO)2;
Б) CaCl2 ∙ Ca(OH)2;
В) NaOCl ∙ Ca(OH)2.
6. Понятие «активный» хлор определяет:
а) истинное содержание хлора в соединении;
б) окислительную способность соединения в кислой среде;
в) восстановительную способность соединения в нейтральной среде.
7. Рассчитать содержание активного хлора в молекуле NaCl:
а) 35,5 г/моль;
б) 58,5 г/моль;
в) 0 г/моль.
8. Рассчитать содержание активного хлора в молекуле NaOCl
а) 71 г/моль;
б) 35,5 г/моль;
в) 0 г/моль.
9. Найти содержание активного хлора в хлорной извести следующего состава 3 CaOCl∙ Ca( OH)2 ∙5 H2 O
а) 39,08 %;
б) 81,02%;
в) 78,08%.
10. Содержание активного хлора в хлорсодержащих веществах рассчитываются по формуле:
а) Cl (%)=(nM/ Mo) ∙100;
б) Cl2 (%)=(nM/ Mo) ∙100;
в) ClО- (%)=(M/ nMo) ∙100.
11. При определении оптимальной дозы хлора следует исходить из:
а) хлорпоглощаемости воды и избытка хлора, обеспечивающего бактерицидный эффект;
б) только из хлорпоглощаемости воды, обеспечивающей бактерицидный эффект;
в) хлорпоглощаемости и хлороемкости воды, обеспечивающий бактерицидный эффект.
12. Как находят хлорпоглощаемость воды?
а) экспериментально;
б) путем расчетов по формуле;
в) теоретически.
13. В каких случаях применяют хлорирование с аммонификацией?
а) в случаях пуска новых водопроводных сетей;
б) в случаях высокой цветности и мутности воды;
в) для избежания образования хлорфенольных запахов.
14. Указать процесс образования хлорамина:
а) NH3 + Cl2 ↔ NH2Cl + HCl;
б) NH2Cl + H2O ↔ NH4OH + HOCl;
в) N2+ Cl2 + 2H2O ↔ 2NH2Cl +O2.
15. Указать реакцию, выражающую гидролиз хлорамина:
а) NH2Cl + H2O ↔ NH3 + HOCl;
б) NH2Cl + 2H2O ↔ NH4OH + HOCl;
в) 2NH2Cl + H2O ↔ OCl2 + 2NH3.
16. В каких случаях применяется хлорирование с манганированием?
а) в случае высокой мутности и цветности воды, вызванной минеральными примесями;
б) при пуске новых водопроводных сетей;
в) при наличии в воде органических веществ, вызывающих запахи и привкусы.
17. Какова доза KMnO4, если он вводится до ее осветления:
а) 0,08 мг/л;
б) 0,1 мг/л;
в) 1 мг/л.
18. Указать дозу KMnO4 при манганировании после обработки воды:
А) 1 мг/л;
Б) 0,08 мг/;
В) 0 мг/л.
19. Области применения хлормедного метода обеззараживания воды:
а) для вод плавательных бассейнов;
б) для пуска новых водопроводных сетей;
в) для устранения высокой цветности мутных вод.
20. Области применения хлормедного метода обеззараживания воды:
а) для вод плавательных бассейнов;
б) для пуска новых водопроводных сетей;
в) для устранения высокой цветности мутных вод.
21. Перехлорирование –это…
а) обработка воды после других мероприятий водоподготовки;
б) обработка воды повышенными дозами хлора;
в) мероприятия по обеззараживанию воды, включающие различные методы.
22. С чем связано бактерицидное действие озона?
а) с высоким окислительным потенциалом озона;
б) с высокой растворимостью озона в воде;
в) с затруднением диффузии озона через клеточные оболочки микроорганизмов.
23. Преимущества метода озонирования воды?
а) озон разрушает сталь, чугун, медь, резину, эбонит;
б) улучшение органолептических свойств воды и легкость получения;
в) необходимы мероприятия по удалению избытка реагента.
24. Указать реагенты для дехлорирования:
а) Na2SO4, SO3, H2SO4;
б) SO2, Na2SO3, Na2S2O3;
в) SO3, Na2SO3, H2SO4.
25. Какие вещества применяются для удаления из воды излишков хлора?
а) окислители;
б) буферные растворы;
в) восстановители.
26. В воде остаточный хлор составляет 4 мг/л. Сколько хлора необходимо убрать из 10 м3 воды:
а) 1∙104мг;
б) 4∙104мг;
в) 3 ∙104мг.
27. Определить количество (г) SO2 идущего на дехлорировании 10 м 3 воды, содержащей 1 мг/л избыточного остаточного хлора:
а) 9 г;
б) 0,1 мг;
в) 0,9 г.
28. Определить количество (г) Na2 SO3, идущее на дехлорировании 10 м3, содержащей остаточный хлор в количестве 4 мг/л:
А) ≈ 17,7 г;
Б) ≈ 1,77 г;
В) ≈ 35,4 г.
29. Указать уравнение реакции, отражающее сущность процесса дехлорировния воды:
а) SO2 +Cl2 +H2O = 2HCl + H2SO4;
б) Cl2 +H2O = HCl + HOCl;
в) 3Cl2 +6KOH = 5KCl + KClO3 + 3H2O.
30. Какая из реакций отражает сущность процесса дехлорирования воды?
а) Cl2 +H2O +Na2S2O3 = 2HCl + Na2SO4 +S
б) NH3 +Cl2 = NH2Cl +HCl
NH2Cl +2H2O= NH4 OH+ HOCl
в) 2H2O + Ca(OCl)2 = 2HOCl +Ca (OH)2
31. Содержание остаточного хлора 7,5 мг/л.. какое количество SO2 необходимо для дехлорирования 50 л. воды?
а) 0,338 г;
б) 338 г;
в) 0,338 мг.
32. Какое количество (г) гипохлорит ионов получается из 10 г Cl2:
а) 51,5г;
б) 7,25г;
в) 71г.
33. Какое магнийсодержащее вещество образуется при хлорировании и манганировании:
а) MgO;
б) MgCl2;
в) Mg(OH)2.
34. Чем обуславливается нижняя граница остаточного хлора в питьевой воде:
а) Опасностью вторичного бактериального загрязнения;
б) необходимостью наличия хлора в питьевой воде для улучшения органолептических свойств воды;
в) санитарно – гигиенической необходимостью.
35. Возможно ли применение ультрафиолета для обеззараживания воды в современной Вологде?
а) нет, из-за износа водопроводных сетей
б) да, так как избыток хлора вреден для организма
в) нет, в соответствии с СанПиН.
36. В практике обеззараживание применяется:
а) NH2Cl и NaOCl$
б) KCl и NH4OH;
в) NaOCl и NH4OH/
37. Указать уравнение реакции образования хлораминов:
а) NHCl2+ NH2Cl = N2 + 3HCl;
б) 4NH2Cl + 3 Cl2 + H2O ↔ N2 + N2O + 10HCl;
в) NH3 +2Cl2 = NHCl2 + 2HCl.
38. В каких случаях для обеззараживания воды применяется хлормедный метод?
а) для обеззараживания питьевой воды;
б) для обеззараживания воды плавательных басеййнов;
в) для удаления неприятных запахов (дезодорации).
39. Указать интервал концентраций остаточного активного хлора для питьевой воды:
а) 0,3 -0,5 (мг/л);
б) 0,1 -0,3 (мг/л);
в) 1,5 -1,9 (мг/л).
40. Дехлорирование воды осуществляется:
а) окислителями;
б) коагулянтами;
в) восстановителями.
ТЕМА 4. ХИМИЧЕСКИЕ МЕТОДЫ
ОЧИСТКИ СТОЧНЫХ ВОД.
1. Какие методы используются при очистке сточных вод от тяжелых металлов:
а) осаждения;
б) окисления;
в) гидролиза.
2. Указать схему процесса удаления из сточных вод ионов цинка:
а)Zn2+ + 2 OH- = Zn(OH)2
б) Zn+ SO4 2- = ZnSO4
в) Zn+ 2Cl - = ZnCl2
3. Указать схему процесса удаления из сточных вод ионов никеля:
а) Ni 2+ + 2 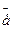 = Ni 0
= Ni 0
б) Ni + PO43+= Ni 3(PO4)2
в) Ni 2++ 2 OH- = Ni(OH)2
4. Указать схему процесса удалении из сточных вод ионов меди:
а) Сu2+ + 2 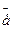 = Cu 0
= Cu 0
б) )Сu2+ + 2 OH- = Cu(OH)2
в) Zn 2++ Cl2 = CuCl2
5. Какие соединения образуются при действии соды на сточные воды, содержащие ионы тяжелых металлов:
а) труднорастворимые карбонаты;
б) труднорастворимые фосфаты;
в) нерастворимые гидроксиды.
6. Указать схему процесса (в ионом виде) удаления из сточных вод меди действием соды:
а) 2Cu2++CO32- +2OH-→ (CuOH)2CO3;
б) Cu2+ +Na2CO3 → CuCO3+ 2Na+;
в) Cu2+ + Na2CO3+ H2O → (CuOH)2+2NaHCO3;
7. Указать схему процесса (в ионом виде) удаления из сточных вод никеля действием соды:
а) Ni2++CO32- +2OH-→ NiCO3 ;
б) Cu2+ +Na2CO3 → NiCO3+ 2Na+;
в) 2Ni2+ +CO32- +2OH- → (NiOH)2CO3;
8. Указать схему процесса (в ионом виде) удаления из сточных вод никеля действием соды:
а) Zn2++CO32- +2OH-→ ZnCO3;
б) Zn2+ +Na2CO3 → ZnCO3+ 2Na+;
в) 2Zn2+ +CO32- +2OH- → (ZnOH)2CO3.
9. На какие группы делятся сточные воды?
а) производственные, ливневые и бытовые;
б) производственные, поверхностные и подземные;
в) бытовые, поверхностные и ливневые.
10. Указать правильное утверждение:
а) производственные сточные воды образуются в результате практической жизнедеятельности людей;
б) Бытовые сточные воды образуются в результате практической деятельности и жизнедеятельности людей;
в) Бытовые сточные воды являются результатом производственной деятельности людей.
11. . Какой зависимости подчиняется концентрация загрязнений бытовых сточных вод (С):
а)  ;
;
б) 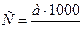 ;
;
в) C= q∙1000∙ a.
12..Указать минеральные загрязнения сточных вод:
а) соли аммония, фосфаты, хлориды;
б) фосфаты, хлориды жирные кислоты;
в) ПАВ, соли аммония, хлориды, сульфаты.
13. Что представляет из себя твердая фаза, выпадающая при медленном движении и отстаивании бытовых сточных вод:
а) коагулирующие коллоидные системы – гели;
б) частицы песка, шлаки, волокна, органика различного происхождения;
в) шлаки, волокна, гидроксиды и карбонаты металлов.
14. На какие две группы можно разделить органические вещества бытовых сточных вод?
а) серусодержащие и непредельные углеводороды;
б) безазотистые и азотсодержащие вещества;
в) углеводороды и жироподобные соединения.
15. Каким способом достигается наиболее полное осаждение ионов Zn2+:
а) обработкой сульфидом натрия;
б) обработкой сульфатом натрия;
в) обработкой тиасульфатом натрия.
16. Каким способом достигается наиболее полное осаждение ионов ртути:
а) обработкой хлоридом серебра;
б) обработкой сульфидом серебра;
в) обработкой нитратом натрия.
17. Какие вещества образуются при обработке воды сульфидом натрия в присутствии в воде ионов цинка и ртути:
а) HgS и ZnS;
б) HgSO4 и ZnSO4;
в) HgS и ZnSO4.
18. Что является недостатком метода удаления из сточных вод металлов с помощью сульфида натрия:
а) образование тонкодисперсного осадка;
б) образование сероводорода при понижении рН;
в) образование сероводорода при повышении рН.
19. Какие методы используют для удаления цианидов?
а) окисление хлором и хлорной известью;
б) восстановление сульфидами и тиасульфатом натрия;
в) осаждение гидроскидами и известкование воды.
20. Какие вещества образуются на завершающей стадии удаления цианидов из сточных вод методом окисления хлором в щелочной среде:
а) NaCNO, NaCl, H2O;
б) (NH4)2CO3, Na2CO3;
в) NaCNO, Na2CO3, H2O.
21. Какой метод применяют при очистке сточных вод от шестивалентного хрома:
а) окисление и осаждение в виде гидроксида трехвалентного хрома;
б) восстановление и осаждение в виде гидроксида трехвалентного хрома;
в) окисление и осаждение в виде гидроксида шестивалентного хрома.
22. Какие методы используются для доочистки сточных вод от органических соединений:
а) окислительные;
б) восстановительные;
в) ионный обмен.
23. Какие вещества применяются при очистке сточных вод от органических загрязнений:
а) Na2S2O3 , O3 , KMnO4;
б) Cl2, O3 , KMnO4;
в) Ca(OH)2, Na2CO3, KMnO4.
24. Указать правильное утверждение:
а) химические методы являются конденсационными;
б) химические методы очистки сточных вод являются регенеративными;
в) химические методы очистки сточных вод являются деструктивными.
25. Формы нахождения железа в природных водах:
а) Fe(HCO3), FeSO4;
б) FeS2, FeCl3;
в) Fe(HCO3)2, FeCO3.
26. Указать правильное утверждение.
а) при выходе подземных вод на поверхность происходит окисление Fe2+ до Fe3+;
б) при выходе подземных вод на поверхность трехвалентное железо восстанавливается до двухвалентного;
в) подземные воды при выходе на поверхность под действием атмосферы восстанавливаются с образованием Fe(OH)3.
27. ПДК по железу в питьевой воде:
а) 0,3 мг/л
б) 0,1 мг/л
в) 0,03 мг/л
28. Какие процессы протекают при обезжелезивании воды?
а) окисление и гидролиз;
б) восстановление и окисление;
в) гидролиз и восстановление.
29. Какой продукт образуется в результате насыщения воды кислородом с целью обезжелезивания воды:
а) Fe(OH)2;
б) Fe(HCO3)2;
в) Fe(OH)3.
30. ПДК по марганцу для питьевой воды:
а) 0,3 мг/л;
б) 0,05 мг/л;
в) 0,1 мг/л.
31. Формы марганца в природной воде:
а) гидрокарбонат и сульфат марганца, органические соединения;
б) органические соединения марганца, хлорид и карбонат марганца;
в) гидрокарбонат, сульфат, хлорид и сульфид марганца.
32. Методы деманганирования воды:
а) обработка содой и известью;
б) известкование и аэрация;
в) восстановление и аэрация.
33. Какое соединение марганца образуется при деманганировании воды с применением окислителей:
а) MnO2;
б) Mn(OH)4;
в) KMnO4.
34. Указать процесс, протекающий при деманганировании воды с применением в качестве окислителя озона:
а) Mn(OH)2 + O3 +H2O↔Mn(OH)4 ↓ +O2;
б) MnSO4 + O3 + H2O ↔ MnO2 ↓ + O2 + H2SO4;
в) MnSO4 + O3 + 3H2O ↔ Mn(OH)4 ↓ + H2SO4 +O2.
35. Указать процесс, протекающий при деманганировании воды с применением в качестве окислителя диоксида хлора:
а) Mn(OH)2 + 2ClO2 +H2O=Mn(OH)4 ↓ + Cl2 +1,5O2;
б) MnSO4 + ClO2 + H2O = MnO2 ↓ +HCl+ H2SO4;
в) KMnO4 + ClO2 + 2H2O = Mn(OH)4 ↓ + KCl + 2O2.
36. Указать процесс, протекающий при деманганировании воды с применением в качестве окислителя перманганата калия:
а) 2MnSO4 + 2KMnO4 + H2O = 4MnO2 ↓ +K2SO4+ H2SO4;
б) KMnO4 + MnO+ H2O = KOH +2 Mn(OH)4↓;
в) MnSO4 + 2 KMnO4+ 6H2O = 3Mn(OH)4 ↓ + K2SO4.
37. Фторирование воды производится с применением реактивов:.
а) NaF, Na2SiF6, H2SiF6;
б) NaF, F2, AgF;
в) H2SiF6, AgF.
38. В каком виде присутствует в воде свободная кремниевая кислота:
а) SiO2 ∙2H2O;
б) SiO2 ∙CaO;
в) SiO3 ∙7H2O.
39. Методы удаления сероводорода:
а) с помощью восстановителей SO2, Na2SO3;
б) известкованием с применением Ca(OH)2, NaOH;
в) с помощью хлора Cl2.
40. Кислород удаляется:
а) с помощью восстановителей SO2, Na2SO3
б) с помощью окислителей KMnO4, O3.
в) при хлорировании воды.
Дата: 2019-02-02, просмотров: 362.