Устойчивость коллоидных систем зависит от соотношения электростатических сил отталкивания и межмолекулярных сил притяжения.
Силы притяжения преобладают на очень малых расстояниях и больших. На средних расстояниях преобладают электростатические силы отталкивания. Этому способствует высокий потенциал поверхности и малая концентрация окружающего раствора.
Соединению коллоидных частиц препятствует наличие потенциального барьера.
Чем больше заряд поверхности и толщина диффузного слоя, тем выше потенциальный барьер, который нужно преодолеть частицам для их взаимодействия.
Уменьшение высоты барьера наблюдается:
- при снижении величины заряда частицы вследствие сорбции ионов из раствора (нейтрализационная коагуляция);
- при сжатии диффузного слоя (концентрационная коагуляция).
Это ведёт к преобладанию сил притяжения между частицами и к коагуляции.
При введении электролита изменяется толщина диффузионного слоя и плёнки жидкости, разделяющей частицы. После достижения порога коагуляции величина потенциального барьера снижается, силы притяжения преобладают начинается процесс коагуляции. В начале размер образующихся агрегатов невелик и видимых изменений не происходит. Это период скрытой коагуляции.
Затем в результате дальнейшего укрупнения частиц образуются хлопья.
При введении в разрушающийся коллоид ВМС, имеющих полярные группы, происходит их соединение с агрегатами коллоида, которое сопровождается образованием рыхлых хлопьев. Этот процесс называется флокуляцией, а применяемое ВМС – флокулянтом.
Заканчивается процесс коагуляции седиментацией – осаждением частиц под действием силы тяжести.
Коагуляция коллоида может произойти при введении в него другого золя, имеющего противоположный заряд. Это взаимная коагуляция.
Коагуляция может быть обратимой и необратимой.
Обратимая (золь <=>гель), необратимая (золь → гель).
Переход геля в золь называется пептизацией и дезагрегацией. Она осуществляется при введении электролитов – пептизаторов. Так например гидроксид железа III пептизируется FeCl3.
Действие электролита – пептизатора заключается в том, что один из его ионов адсорбируется на поверхности частиц осадка и сообщает им заряд, что ведёт к увеличению электрокинетического потенциала и расширению гидратной оболочки.
Растворы ВМС и некоторые органические вещества образуют на поверхности коллоидных частиц прочные адсорбционнно-сольватные слои, которые способствуют повышению устойчивости коллоидов, то есть проявляют защитное действие. Это защитные коллоиды. При очистке воды содержащиеся в ней органические коллоиды замедляют процессы коагуляции, повышая устойчивость образующихся коллоидов гидроксидов алюминия и железа.
Определение оптимальной дозы коагулянта:
для мутных вод Д=3,5√M;
для цветных вод Д=4√Ц;
Д-доза коагулянта (мг/л).
Обработка воды коагулянтами
В природных водах содержатся одновременно частицы по размерам соответствующие грубодисперсным системам и коллоидам. Грубодисперсные частицы удаляются отстаиванием. А коллоиды не отстаиваются.
Воды бывают мутные и цветные.
В мутных водах присутствуют: коллоидные частицы алюмосиликатов (глинистые), кремниевой кислоты, органоминеральных комплексов почвы.
Коллоидные частицы примесей природных вод, как правило, имеют отрицательный заряд.
Основу глинистых частиц образуют гидроалюмосиликаты.
Гумусовые соединения занимают промежуточное положение между коллоидами и ВМС. Они более устойчивы к действию электролитов и обладают защитными свойствами по отношению к коллоидным растворам гидроксидов металлов. Они затрудняют процессы очистки воды.
Метод обработки воды, направленный на удаление веществ – коллоидов с помощью химических реагентов называется коагулированием. Вещества, вызывающие разрушение коллоидов, называются коагулянтами.
Коагулирование применяется для осветления мутных и обесцвечивания цветных вод. Наряду с коллоидами при этом удаляются грубодисперсные примеси, планктон, бактерии и вирусы.
Коагулянты представляют собой соли слабых оснований и сильных кислот. Они гидролизуются :
Al3+ + H2O ↔ ( AlOH )2+ + H+
(AlOH )2+ + H2O ↔ Al (OH)2+ + H+
Al(OH)2+ + H2O ↔ Al(OH)3 + H+
Могут образоваться аквакомплексы, тогда гидролиз :
[Al (H2O)6]+3 + H2O = [ Al (H2O)5OH]+2 + H3O+
Эффективность действия коагулянта определяется полнотой гидролиза с образованием труднорастворимых гидроксидов.
Для увеличения степени гидролиза необходимо связывать ионы H+. Это достигается за счёт HCO3- ,CO32- ,OH- , присутствующих в воде (щелочной резерв).
Al2(SO4)3 + 3Ca(HCO3)2 + 6H2O → 2Al(OH)3 + 3CuSO4 + 6H2CO3
∕ \
H2O CO2
Гидроксид алюминия обладает амфотерными свойствами. Его образование начинается при pH >4,5, а при pH >8,5 происходит растворение Al(OH)3.
С образованием алюминатов
Al(OH)3 + Na OH = Na3[Al(OH)6]
гексагидроксоалюминат
натрия
В щелочной среде образуется анион метаалюминиевой кислоты AlO-2. В результате гидролиза:
AlO-2 + 2H2O → Al(OH)3 + OH-
На этом основано применение его как коагулянта. Гидроксид железа Fe(OH)3 образуется в более широком диапазоне pH. Коагулирование воды включает три стадии.
1.Образование коллоидного раствора гидроокиси металла в результате полного гидролиза коагулянта.
2.Коагуляцию образовавшегося золя коагулянта под действием анионов воды и его взаимодействие с коллоидными и грубодисперсными примесями воды.
3.Процесс хлопьеобразования, завершающийся седиментацией.
Коагуляция Fe(OH)3 или AL(OH)3 происходит за счёт сжатия диффузионного слоя коллоидных частиц. Противоионы диффузионного слоя переходят в адсорбционный, уменьшается электрокинетический потенциал (концентрационная коагуляция).
Скоагулировавшиеся частицы Fe(OH)3 и Al(OH)3 обладают хорошо развитой поверхностью и являются хорошими адсорбентами для коллоидных примесей воды.
Может иметь место взаимная коагуляция. Коагуляция коллоидов Al(OH)3 и Fe(OH)3 вызывается анионами (SO42-,HCO3-,Cl-) содержащимися в воде.
Процесс коагуляции идёт быстро, необходимо энергичное перемешивание. На процесс коагуляции влияет температура (устойчивость коллоидов увеличивается, т.к. увеличивается тепловое движение частиц).
Количество введённого в воду коагулянта (мг/л, мг-экв/л, г/м3, г-экв/м3) называется дозой коагулянта.
|
|
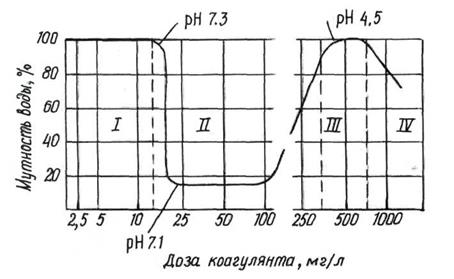
Минимальная концентрация коагулянта, отвечающая наибольшему осветлению или обесцвечиванию воды, называется оптимальной дозой коагулянта. Она определяется опытным путём и зависит от солевого состава, жесткости, щелочности и т.д.
Рис.12. Кривая коагуляции.
Оптимальной дозой считается минимальное количество коагулянта, которое при пробном коагулировании даёт крупные хлопья и максимальную прозрачность воды через 15-20 минут.
Во время паводка доза увеличивается на 50 %. При температуре ниже 4 0С дозу увеличивают в 2 раза.
Мягкие воды плохо коагулируются (мало анионов). Для цветных вод:
Д=4√Ц,
где Д – доза Al2(SO4)3 мг/л
Ц – цветность воды по платиново-кобальтовой шкале, град.
При малой щелочности и низкой температуре проводят коагуляцию с подщелачиванием. Обычно используют известь и соду. При этом:
2FeCl3 + 3Ca(OH)2 → 2Fe(OH)3 ↓+ 3CaCl2
Al2(SO4)3 + Na2CO3 + H2O → Al(OH)3 + Na2SO4 + H2CO3
Количество щёлочи определяют:
Дщ = Дк – Щ + 1 ,
где Дщ – доза щёлочи, мг-экв/л;
Дк – доза коагулянта, мг-экв/л;
Щ – щелочность воды, мг-экв/л;
1 – избыток щелочного реагента, мг-экв/л.
Характеристика коагулянтов
1.Сульфат алюминия (сернокислый глинозем) Al2(SO4)3∙18H2O применяется для осветления и обесцвечивания воды. При отсутствии щелочного резерва вызывает снижение pH до 4,5 и вода становится агрессивной по отношению к железу и бетону.
2.Основной хлорид алюминия Al2(OH)5Cl ∙ 6H2O
3.Алюминат натрия NaAlO2, используется если увеличение солесодержащих за счёт анионов коагулянтов нежелательно
4.Хлорид железа III FeCO3 ∙ 6 H2O, для осветления воды.
5.Сульфат железа III Fe2(SO4)3, обладает сильным коррозионным действием по отношению к железу и бетону.
6.Сульфат железа II FeSO4 ∙ 7H2O, коагулирование осуществляется в щелочной среде (с известью).
FeSO4 + Ca(OH)2 → Fe(OH)2 + CaSO4
4Fe(OH)2 + O2 + 2H2O → 4 Fe(OH)3
В этом случае из воды удаляется до 50 % органических примесей. Применяется для осветления технических вод.
Преимущества железных коагулянтов:
- меньшая зависимость от солевого состава и pH;
- меньшая зависимость от температуры;
- осаждение быстрее, так как хлопья имеют большую плотность;
- коагель Fe(OH)3 – хороший адсорбент для органических соединений, соединений меди, мышьяка, марганца и др.
Недостатки:
- высокая коррозийная активность;
- применение только для осветления.
Характеристика флокулянтов
Для интенсификации очистки воды методом коагулирования применяются дополнительные реагенты – флокулянты, позволяющие ускорить процесс хлопьеобразования.
Используются следующие классы:
- неорганические (активированная кремниевая кислота);
- органические ВМС;
- синтетические ВМС (полиакриламид, полиэтиленимин и т.д.).
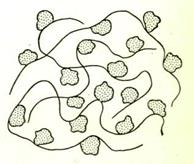
Механизм действия основан на адсорбции макромолекул флокулянта скоагулировавшими или взвешенными частицами. Процесс флокуляции включает три стадии:
1.Адсорбцию.
2.Образование мостикоподобной структуры.
3.Собственно флокуляцию.
|
|
Рис.13.Схема образования хлопьев в присутствии высокомолекулярного флокулянта.
Если адсорбция макромолекул на поверхности частицы не сопровождается взаимодействием между образующимися агрегатами, то происходит стабилизация системы (явление защиты).
1.Полиакриламид (ПАА)
Полимер содержит полиамидные

-CH2-CH-
│
O= C-NH2
n
и кислотные звенья.

-CH2-CH-
│
COOH
n
2. Активированная кремниевая кислота.
Получают при взаимодействии жидкого стекла (Na2O ∙ n SiO2∙mH2O) с неорганическими кислотами. При этом получают оксиды кремния с различной степенью гидратации (SiO2 ∙ nH2O).
3.Катионный флокулянт ВА-2 это полимер с образованием активного катиона. Он является эффективным коагулянтом коллоидов имеющих отрицательный заряд.
 -CH2-CH2-
-CH2-CH2-
│

│
CH2-N+(CH3)3Cl- n
Катионы флокулянты ВА -212 и ВА -202, представляющие собой четвертичные аммониевые соли на основе полистирола и поливинилтолуола, разрешены для обработки питьевой воды. ПДК таких флокулянтов в воде составляют 2 мг/л.
Дата: 2019-02-02, просмотров: 423.