1. Броуновское движение препятствует оседанию коллоидных частиц. Причиной броуновского движения является невидимое движение молекул растворителя, сталкивающихся с коллоидными частицами.
2. Так как коллоидные частицы обладают тепловым движением, то для них характерно явление диффузии.
Формула Эйнштейна:
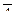 =
=  ,
,
где 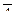 - среднее смещение частицы;
- среднее смещение частицы;
D – коэффициент диффузии;
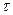 – отрезок времени, за которое произошло смещение частицы.
– отрезок времени, за которое произошло смещение частицы.
Коэффициент диффузии равен количеству вещества, проходящему за секунду через сечение 1 см2, когда разность концентрации на расстоянии 1 см равна единице:
D= RT/6 πrŋ Na ,
где R – газовая постоянная;
T – температура системы, К;
r – радиус частицы;
ŋ – вязкость среды;
Na - число Авогадро.
3. Осмотическое давление золя мало по сравнению с истинными растворами. Если взять для приготовления истинного и коллоидного раствора одно и то же количество вещества, то в коллоидном растворе частичек будет меньше, так как они крупнее.
Концентрация коллоидного раствора характеризуется числом частиц в единице объёма (частичная концентрация ν). Кроме этого есть грам-частичная концентрация:
Cd= 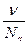
Малая грам-частичная концентрация коллоидного раствора ведёт к уменьшению осмотического давления.
p=cRT
p=CdKT
K=R/Na
4. В коллоидных системах наблюдается распределение коллоидных частиц по высоте. В нижних слоях их больше, в высоких - меньше. Такое распределение частиц называется перреновским седиментационным равновесием (аналогично распределению газа в атмосфере).
Скорость установившегося седиментационного равновесия мала, но оно может сохраняться сколь угодно долго.
ln C1/C2=mg (h2-h1)Na(P-Po)/RTP,
где С1 - концентрация на высоте h1;
C2 – концентрация на высоте h2;
m – масса частицы;
Na – число Авогадро;
P – средняя плотность частиц;
Ро – плотность дисперсионной среды.
Оптические свойства коллоидов.
Они оптически неоднородны. Эффект Тиндаля – это явление, при котором луч света, проходящий через коллоидный раствор, хорошо виден сбоку. Частички коллоидных растворов обладают свойствами рассеивать во всех направления падающие лучи света. Этим пользуются для отличия коллоидных растворов от истинных, так как последние являются «оптически пустыми».
Строение коллоидной частицы
В основе мицеллы лежит нерастворимое в данной дисперсионной среде ядро. Поверхность ядра адсорбирует из окружающей среды ионы. Эти ионы называются потенциалообразующими, так как сообщают частице определённый заряд. Например для золя гидроокиси железа потенциалообразующим ионом будет хлорокись железа FeOCl образующая по уравнению
Fe(OH)3 + HCl = FeOCl + 2H2O
FeOCl = FeO+ + Cl-
Катионы FeO+ адсорбируются на поверхности ядра, заряжая его положительно.
Катион FeO+ сообщает частице положительный заряд, а в растворе находятся ионы Cl- -противоионы. Они испытывают действие двух сил:
- электростатическую, притягивающую их к ядру (адсорбционную);
- диффузионную, стремящуюся их рассеять.
В соответствии с этим ионы Cl- образуют плотный адсорбционный слой на ядре и диффузионный слой – ионную атмосферу частицы. Совокупность адсорбционного и диффузионного слоёв представляет собой двойной электрический слой. Ядро с адсорбционным слоем образует гранулу, а система, состоящая из гранулы и диффузионного слоя, называется мицеллой.
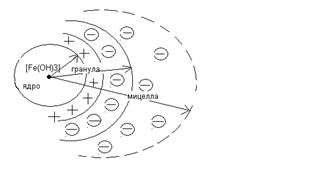
Рис. 10. Строение коллоидной частицы гидроксида железа.
Рассмотрим двойной электрический слой:
|
|
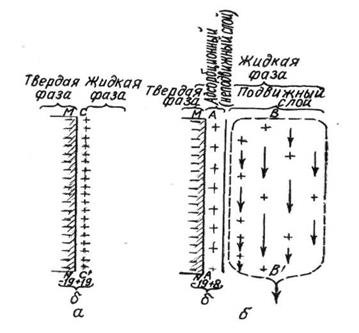
При диффузионном строении слоя потенциал твердой частицы компенсируется частично, так как около неё удерживается неподвижным слоем жидкости только часть противоионов. На границе подвижного и неподвижного слоёв возникает разность потенциалов – это, так называемый, электрокинетический потенциал. Следовательно, электрокинетический потенциал есть разность потенциалов на границе неподвижного (адсорбционного) слоя жидкости и подвижного (диффузионного).
Рис.11. Структура двойного электрического слоя:
а – адсорбционный слой; б –диффузное строение слоя.
Полное падение потенциала на границе, твёрдое вещество – растворённое до нулевого значения соответствует максимальной разности потенциалов твёрдого вещества и всех противоионов вместе взятых. Это термодинамический потенциал.
В вопросах очистки воды дзета-потенциал имеет большое значение. При разрушении дисперсных систем с помощью коагулянта происходит снижение дзета-потенциала до критической величины, то есть до изоэлектрического состояния коллоидной частицы.
Коагуляция электролитами наступает в результате сжатия диффузионного слоя, за счёт увеличения концентрации противоионов в диффузионном слое.
Таким образом, дзета-потенциал является мерой устойчивости коллоидных систем.
Если граница диффузионного слоя совпадает с границей адсорбционного, электрокинетический дзета-потенциал равен нулю. Это изоэлектрическая точка золя.
Дата: 2019-02-02, просмотров: 350.