1. Ддля обесцвечивания и осветления воды:
а) сульфат алюминия и серной кислоты;
б) сульфат алюминия и активированная кислота;
в) полиакриламид и сода.
2. Наличием каких соединений обуславливается цветность воды:
а) ионов Са и Mg;
б) сульфатов и хлоридов;
в) гуминовых соединений и комплексных соединений железа.
3. Указать правильное утверждение:
а) грунтовыми называются подземные воды, расположенные на первом от поверхности земли водоупорном слое, имеющим значительную площадь распространения;
б) основную опасность для загрязнения грунтовых вод соединениями тяжелых металлов представляют выбросы автотранспорта;
в) грунтовые воды лежат в зоне аэрации и лежат между двумя водоупорными слоями.
4. Природные источники поступления главных ионов в подземные воды:
а) хозяйственная деятельность человека;
б) растворение минералов и грунтов залегания;
в) атмосферные осадки.
5. Метод определения мутности воды:
а) нефелометрия;
б) аргентометрия;
в) потенциалометрия.
6. Главные ионы в подземные воды поступают в результате:
а) хозяйственной деятельности человека;
б) растворение минералов и грунтов залегания;
в) атмосферные осадки.
7. Из общей массы гидросферы доля пресных вод составляет:
а) до 1%;
б) от 2% до 5%;
в) от 20%.
8. Доля пресных вод в гидросфере составляет:
а) до 1%;
б) от 2 до 5%;
в) от 20%.
9. Соединения, увеличивающие цветность природных вод это:
а) жирные кислоты;
б) оксиды металлов;
в) гуматамы и фульватамы железа.
10. Какие ионы занимают в океанских водах первое место:
а) фосфаты;
б) силикаты;
в) хлориды.
11. Определение какого показателя качества воды определяется методом нефелометрии:
а) мутность;
б) кислотность и щелочность;
в) химическое потребление кислорода.
12. Морские воды относятся:
а) сульфатно-кальциевые, 3-й группы;
б) сульфатно-натриевые, 3-й группы;
в) хлоридно- натриевые, 3-й группы.
13. Качество воды определяют по следующим показателям:
а) индексу загрязненности воды;
б) содержанию тяжелых металлов;
в) степени минерализации.
14. Аномально высокая температура кипения объясняется:
а) изотопным составом воды;
б) полярностью молекул воды;
в) диэлектрической проницаемостью воды.
15. При определении типа химического состава воды решающее значение имеет:
а) концентрация органических веществ;
б) соотношение концентраций в воде главных ионов (мг∙экв/л);
в) щелочность и кислотность воды.
16. Цветность воды обусловливается присутствием:
а) ионов Н+ и ОН-;
б) сульфатов и хлоридов;
в) гуминовых соединений и комплексных соединений железа.
17. Удельная электропроводность показывает:
а) суммарную концентрацию всех катионов;
б) концентрацию неэлктролитов;
в) суммарную концентрацию электролита.
18. Определить число степеней свободы (С) для системы, состоящей из чистой воды в жидкой фазе:
а) С = 1;
б) С = 2;
в) С = 3.
19. К главным ионам относятся:
а) Na+, K+, Ca2+, Mg2+, Fe3+;
б) Na+, K+, Fe3+, SiO 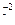 ;
;
в) Na+, K+, Ca2+, Fe3+.
20. Каким фактором определяется содержание кислорода в водоем:
а) разложением органики;
б) окислением примесей;
в) поступление из атмосферы.
21. Указать правильное утверждение:
а) температура воды зависит от местоположения источника и подвержена колебаниям;
б) температура воды не зависит от местоположения источника и в среднем является постоянной;
в) температура воды водоисточника зависит от климатических условий и является постоянной величиной.
22. Соединения обуславливающие цветных природных вод:
а) ионов Са и Mg;
б) сульфатов и хлоридов;
в) гуминовых соединений и комплексных соединений железа.
23. Определить число фаз (Ф) в насыщенном растворе соли:
а) Ф = 3;
б) Ф = 2;
в) Ф = 1.
24. Цветные воды характеризуются цветностью, выраженной:
а) в градусах;
б) в мг/л;
в) в баллах.
25. Наиболее эффективными для осветления воды являются:
а) сульфат алюминия и серной кислоты;
б) сульфат алюминия и активированная кислота;
в) полиакриламид и сода.
26. Число степеней свободы (С) для системы, состоящей из чистой воды в газообразной фазе:
а) С = 1;
б) С = 2;
в) С = 3.
27. Указать правильное утверждение:
а) цветность воды определяется по платиново – кобальтовой шкале;
б) цветность воды выражается в мг/л;
в) цветность воды выражается в баллах.
28. Молекулы воды могут взаимодействуют друг с другом:
а) т.к. молекулы воды имеют дипольные моменты;
б) т.к. в воде наблюдаются аномами плотности;
в) т.к. у воды высокая диэлектрическая проницаемость.
29. Воды, содержащие 100 – 200 мг/л солей относятся к:
а) ультрапресным;
б) повышенной минерализации;
в) маломинерализованным.
30. В какой форме встречается фтор в природных водах:
а) фторид - ионов;
б) гидроксифторидов;
в) в виде фторсиликатов.
31. Что является причиной запаха и привкуса воды?
а) растворенными солями, газами, органическими соединениями, образующимися в процессе жизнедеятельности водных организмов;
б) смывом органических соединений с поверхности водосбора;
в) сбросом промышленных сточных вод, содержащих ионы тяжелых металлов.
32. Как определяется сухой остаток?
а) методом электрофотоколориметрии;
б) визуальным методом;
в) гравиметрический метод.
33. Что называется взвешенными веществами?
а) взвешенные вещества – это крупные частицы, задерживающиеся бумажными фильтрами;
б) взвешенные вещества характеризуют содержание и количество коллоидно - растворенных в воде веществ;
в) нелетучие примеси воды.
34. Для определения мутности воды применяется:
а) метод нефелометрии;
б) метод гравиметрии;
в) метод ионного обмена.
35. Взвешенные вещества определяются методами:
а) нефелометрии и гравиметрии;
б) визуальный метод и фотоколориметрии;
в) гравиметрии и метод ионного обмена.
36. Электропроводимость воды характеризует:
а) общее солесодержание;
б) жесткость воды;
в) величину ХПК.
37. Что относится к физическим показателям качества воды?
а) температура, рН, плотность;
б) температура, прозрачность, цветность;
в) мутность, цветность, жесткость, вкус.
38. Цветность природных вод открытых водоемов обуславливается:
а) наличием различных растворенных и взвешенных примесей;
б) взвешенными частицами глины, песка или органических взвесей;
в) наличием нефти и нефтепродуктов, попадающих в воду.
39. Температура природных вод зависит от следующих факторов:
а) от времени года и от температуры тех грунтов, с которыми она соприкасается;
б) от глубины водоема и химического состава примесей;
в) от грунтов залегания водоема;
40. Действие некоторых токсических соединений может:
а) не влияет на токсичность друг друга;
б) уменьшаться;
в) усиливаться.
ТЕМА 2. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ВОДЕ ХОЗЯЙСТВЕННО - БЫТОВОГО И ПРОМЫШЛЕННОГО ВОДОСНАБЖЕНИЯ
1. Указать правильное утверждение:
а) требования к воде промышленного водоснабжения определяются технологией производства;
б) требования к воде промышленного водоснабжения едины ко всем видам водопользования;
в) требования к воде промышленного водоснабжения обусловлены проблемой сброса вод в открытые водоемы.
2. Указать ПДК по железу для вод применяемых для охлаждения:
а) 0,01 мг/л;
б) 10 мг/л;
в) 0,1 мг/л.
3. Указать ПДК по сероводороду для воды, применяемой в качестве охлаждающей жидкости:
а) ПДК 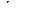 ≤ 0,5 мг/л;
≤ 0,5 мг/л;
б) ПДК 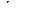 ≥ 0,5 мг/л;
≥ 0,5 мг/л;
в) ПДК 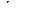 = 0,5 мг/л;
= 0,5 мг/л;
4. ПДК по жесткости на воду, применяемую для охлаждения:
а) 4 ммоль/дм3;
б) 0,17 ммоль/дм3;
в) 2,8 ммоль/дм3.
5. Требования к воде, идущей на питание паровых котлов:
а) Общая жесткость 0,017 ммоль/л; минимальные значения растворенного кислорода и солесодержания;
б) Общая жесткость 2,8 ммоль/дм3 ; минимальное солесодержание;
в) Карбонатная жесткость 0,017; минимальное значение растворенного кислорода; солесодержание не лимитируется.
6. Указать правильное утверждение: первая группа примесей воды, по отношению ее к дисперсной среде -…
а) это нерастворимые в воде примеси, образующие коллоидные растворы, подверженные седиментации;
б) это нерастворимые в воде примеси, образующие кинетически неустойчивые системы;
в) это растворимые в воде примеси, образующие кинетически устойчивые системы – истинные растворы.
7. Вторая группа примесей воды по отношению их к дисперсионной среде – это:
а) грубодисперсные системы, удаляемые флотацией и электрофорезом;
б) истинные растворы, к которым применимы реагентные методы;
в) коллоидные примеси, выделяемые из воды введением реагентов, вызывающих их коагуляцию.
8. Третья группа примесей воды по отношению их к дисперсной среде, это-
а) коллоидные растворы, удаляемые методом коагуляции;
б) грубодисперсные системы кинетически неустойчивые и склонные к содиментации;
в) молекулярные растворы, образующие гомогенные растворы и удаляющиеся химическими реагентами.
9. Какие примеси природных вод относятся к третьей группе по их отношению к дисперсионной среде:
а) газы, органические вещества, продукты жизнедеятельности водных организмов;
б) коллоидные растворы, продукты распада органики;
в) грубодисперсные системы – взвеси, эмульсии, зоо – и фитопланктон.
10. Какими методами удаляются примеси воды, относящиеся к четвертой группе по их соотношению к дисперсной среде?
а) флотация, электрофорез, адгезия;
б) электрофорез, коагуляция, адгезия;
в) ионный обмен, электродиализ.
11. Что такое адгезия?
а) прилипание частиц к поверхности сорбента;
б) разрушение частиц под действием электрического тока;
в) введение реагентов, вызывающих агрегирование частиц.
12. На каких методах основано удаление примесей воды, относящихся к первой группе по их отношению к дисперсионной среде?
а) электрофорез, коагуляция;
б) седиментация, адгезия;
в) ионный обмен, электродиализ.
13. Какие ионы обуславливают общую жесткость воды:
а) Са2+, Mg2+;
б) Na2+, K+;
в) Mg2+, Fe2+.
14. Какие соли обуславливают временную жесткость воды:
а) Ca(HCO3)2, CaCO3, MgCO3;
б) Mg(HCO3)2, Ca(HCO3)2;
в) MgCO3, Mg(HCO3)2.
15. Какие соли обуславливают постоянную жесткость воды:
а) Ca(HCO3)2, CaCl, CaSO4;
б) MgCO3, MgCl2, Mg(HCO3)2;
в) CaCl2, MgCl2, CaSO4, MgCO3.
16. Чему равен один миллиграмм – эквивалент ионов Са2+ ?
а) 20 мг;
б) 20 г;
в) 20∙ 10-3 мг.
17. Чему равна жесткость воды (моль/дм3) обусловленная содержанием Са2+ равным 20 мг/л.
а) 1 ммоль /дм3;
б) 20 ммоль /дм3;
в) 1∙ 10-3 ммоль/дм3.
18. Жесткость воды составляет 1,5 ммоль/дм3 .
а) это вода средней жесткости;
б) это мягкая вода;
в) это вода очень мягкая.
19. По какому критерию жесткость воды относится к карбонатной?
а) по существенному аниону;
б) по сопутствующему катиону;
в) по величине жесткости.
20. Как устраняется временная жесткость воды?
а) кипячением в течение часа;
б) применением железных и алюминиевых реагентов;
в) методом дегезации.
21. Указать продукты, образующиеся при термическом методе умягчения воды:
а)CaCO3, Mg (OH)2;
б)CaCl2, MgCl2;
в)Ca(OH)2, Mg(OH)2.
22. Какой газ образуется при термическом методе умягчения воды:
а) кислород;
б) углекислый газ;
в) сероводород.
23. На чем основаны реагентные методы умягчения воды:
а) перевод ионов Са2+, Mg2+ в газообразные соединения;
б) перевод ионов Са2+, Mg2+ в труднорастворимые соединения;
в) перевод ионов Са2+, Mg2+ в коллоидную фракцию с последующей коагуляцией.
24. От чего зависит остаточная концентрация Са2+ и М g2+ при применении реагентных методов умягчения воды:
а) от величины произведения растворимости образующихся соединений;
б) от величины константы гидролиза образующихся соединений;
в) от величины константы диссоциации и электродных потенциалов образующихся соединений.
25. Что такое известкование воды?
а) это перевод заметно растворяемых гидрокарбонатов кальция и магния в труднорастворимые соединения;
б) это образование хлоридов и сульфатов Са2+ и Mg2+ в целях умягчения воды;
в) это умягчение воды с образованием извести и последующем ее осаждении.
26. Какие соединения образуются при взаимодействии извести с гидрокарбонатом магния?
а) Гидроксид магния, карбонат кальция и вода;
б) Гидрокарбонат кальция, оксид магния и вода;
в) Оксид кальция, гидроксид магния и вода.
27. Какие соединения образуются при взаимодействии извести с гидрокарбонатом магния?
а) Гидроксид магния, карбонат кальция и вода;
б) Гидрокарбонат кальция, оксид магния и вода;
в) Оксид кальция, гидроксид магния и вода.
28. Какие цели достигаются при известковании воды?
а) снижаются: постоянная жесткость, величина рН, меняется углекислое равновесие;
б) снижаются: карбонатная жесткость, общее солесодержание, концентрация свободной угольной кислоты;
в) снижаются: общая жесткость, величина рН, концентрация растворенного кислорода.
29. Какие приемы используются для более полного умягчения воды.
а) повышение давления, увеличение рН, увеличение температуры;
б) повышение температуры, перемешивание, создание избытка извести;
в) повышение температуры, создание избытка извести, введение катализатора.
30. Как связаны между собой окисляемость воды и формирование осадка при известковании воды.
а) чем выше окисляемость воды, тем хуже кристаллизация осадка;
б) чем ниже окисляемость , тем хуже кристаллизация осадка;
в) формирование осадка при известковании воды не зависит от величины окисляемости воды.
31. Указать выражение для определения оптимальной дозы извести:
а) Ди = 28[ЖК + 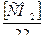 + 0,5]
+ 0,5] 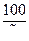 ;
;
б) Ди = 28[Ж + 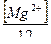 + 0,5]
+ 0,5] 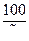 ;
;
в) Ди = 28[ЖК + 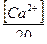 + 0,5]
+ 0,5] 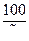 .
.
32. Сущность содово – известкового метода умягчения воды:
а) обработка воды карбонатом натрия и гидроксидом кальция;
б) обработка воды карбонатом магния и гидроксидом магния;
в) обработка воды гидроксидом кальция и карбонатом кальция.
33. Какая реакция протекает при добавлении в воду соды?
а) CaSO4 + Na2CO3 = CaCO3 ↓ + Na2SO4 ;
б) CaSO4 + 2NaCl = CaCl2 + Na2SO4;
в) CaSO4 + 2NaOH = Ca(OH)2 + Na2SO4 ;
34. Указать выражение, по которому рассчитывается доза соды при содово - известковом методе умягчения воды.
а) Дс = 53 [ЖНК + 1]  ;
;
б) Дс = 53 [Жобщ + 1] 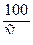 ;
;
в) Дс = 53 [Ж + 1]  ;
;
35. Преимущества термохимического метода умягчения воды.
а) образование крупных хлопьев, уменьшение дозы извести, степень умягчения воды 0,2 -0,3 мг –экв/л.;
б) уменьшение солесодержания, понижение величины жесткости до нуля, нейтральная реакция среды;
в) уменьшение дозы извести, улучшение органолептических свойств воды, снижение содержания газов.
36. Недостатками реагентных методов умягчения воды являются:
а) недостаточная степень умягчения, расход продуктов, сложность технологического осуществления;
б) расход энергии, сложность технологического осуществления, высокая степень умягчения;
в) расход реагентов, расход энергии, сложность осуществления.
37. Достоинства ионообменного метода умягчения воды.
а) не образуется осадка, не нужно дозирование реагента, уменьшение содержания;
б) дозировка реагента, плотный осадок, регуляция солесодержания;
в) улучшение органолептических свойств воды, снижение содержания газов.
38. Статистически объемная емкость – это:
а) число мг –эквивалентов ионов, обменивающихся при контакте раствора с определенным количеством ионитов;
б) определяется количеством ионов, поглощенных объемом набухшего ионита в процессе фильтрования до появления этих ионов в фильтрате;
в) характеризуется общим числом активных групп ионита в единице объема смолы.
39. Катионит универсальный КУ -2 , это:
а) сополимер метилметакрилата с дивинилбензолом.
б) сульфированный сополимер стирола с дивинилбензолом.
в) продукт обработки бурого угля серной кислотой.
40. Что такое обессоливание воды?
а) Метод обработки воды, направленный на снижение общего солесодержания.
б) Частный случай опреснения воды.
в) Метод обработки воды приводящий к осветлению и обесцвечиванию воды.
Дата: 2019-02-02, просмотров: 323.