Теперь обратимся ко второй ситуации, указанной в конце п.11.2. Будем считать, что в растворе – только слабый электролит. Найдём рН раствора и степень диссоциации электролита.
 |
1. Закон разведения Оствальда. а) Для чистого раствора слабого электролита, диссоциирующего по уравнению
 |
справедливо:
где с0 = [RH]0 — общая концентрация электролита.
 |
б) Вспоминаем выражение для константы кислотности:
Полученное выражение связывает степень диссоциации слабого электролита с общей его концентрацией. Оно-то и называется законом разведения Оствальда. Чтобы уяснить смысл этого закона, рассмотрим различные виды слабых электролитов.
2. Слабые кислоты.
 |
а) Для них в чистом состоянии (и при с0 » Ка) α « 1; поэтому в знаменателе формулы (11.25) величиной α можно пренебречь. Тогда
Получается, что повышение концентрации раствора приводит к уменьшению степени диссоциации, а разбавление (или разведение) сопровождается увеличением диссоциации. Отсюда и термин – «закон разведения».
б) До какого уровня растёт α при разбавлении раствора? Выразив α из (11.25), можно показать, что
lim α = 1 . (11.25,б)
со → 0
Таким образом, при очень сильном разбавлении (с0 « Ка) слабый электролит диссоциирует почти полностью.
в) Теперь, используя (11.24,а) и приближённую формулу (11.26,б), найдём концентрацию водородных ионов:
 |
 |
что в логарифмической форме выглядит так:
 |
Заметим, что последнее выражение можно получить и непосредственно из формулы (11.19, б), если подставить в неё
 |
г) Приведем пример использования этих выражений. Для уксусной кислоты р Ka = 4,76. Пусть ее концентрация с0 = 0,1 М. Тогда по формуле (11.27, б) находим:
 |
А чтобы воспользоваться формулой (11.26,б), учтем:
 |
Отсюда
3. Слабые многоосновные кислоты.
а) Такие кислоты имеют несколько стадий диссоциации протона, например:
 |
Каждая стадия характеризуется своей константой диссоциации; как видно из примера, константа каждой последующей стадии на несколько порядков меньше предыдущей.
б) Это значит, что в чистом растворе можно учитывать только первую стадию ионизации и рассчитывать рН раствора по формуле для одноосновной кислоты путем подстановки pKa, 1 в качестве pKa ..
 |
Так, для 0,1 М раствора H3PO4
4. Слабые основания.
а) Здесь α (доля молекул в состоянии сопряженного основания) близка к 1 (α ≈ 1); поэтому непосредственно использовать формулу закона Оствальда (11.25) неудобно.
 |
б) В этом случае следует обратиться к уравнению вида
 |
характеризуемому константой основности
 |
и ввести степень диссоциации по этому уравнению:
 |
в) В результате нетрудно получить формулы точно такого же вида, как для слабой кислоты:
г) Первая формула показывает, что степень оснóвной диссоциации тоже увеличивается при уменьшении с0, т.е. при разведении раствора. Закон Оствальда справедлив и здесь.
 |
д) Но, как мы уже знаем, слабое основание можно характеризовать также константой кислотности и кислотной степенью диссоциации, причем
 |
е) Подставляя первые два из этих выражений в (11.34, а), а два последние — в (11.34,б), для чистого раствора слабого основания находим :
 |
ж) Пример — диссоциация аммиака
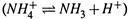 , pKa = 9,25. И пусть вновь с0 = 0,1 М. По формулам (11.36) получаем:
, pKa = 9,25. И пусть вновь с0 = 0,1 М. По формулам (11.36) получаем:
Таким образом, в чистом 0,1 М растворе аммиака основная доля частиц находится в состоянии сопряженного основания (NH3). Это справедливо и для всех других слабых оснований.
Дата: 2019-02-02, просмотров: 326.