Найдем соотношения между параметрами состояния в политропном процессе.
Установим вначале взаимосвязь между давлением и объемом. Используя уравнение (2.22), получим
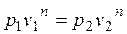
или
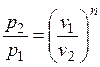 . (2.23)
. (2.23)
Из уравнения (2.23) следует, что при n > 0 изменение давления в политропном процессе обратно пропорционально изменению объема. При n < 0 – прямо пропорционально.
Для установления взаимосвязи между P и Т, V и Т знаменатель уравнения состояния для любых двух точек процесса:
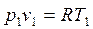 и
и 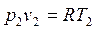 .
.
После деления второго на первое получим:
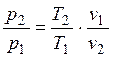 . (2.24)
. (2.24)
Подставляя это соотношение в (2.23) получим соотношение между Т и v
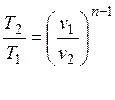 . (2.25)
. (2.25)
Таким образом, в политропных процессах при n > 1 изменение объема обратно пропорционально изменению абсолютной температуры. При n < 1 – прямо пропорционально.
Если с помощью (2.23) исключить из (2.24) объем, то получим соотношение между Т и p
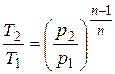 . (2.26)
. (2.26)
Как видно из (2.26), при n > 1 и n < 0 изменение давления прямо пропорционально изменению температуры. При 1 > n > 0 – обратно пропорционально.
Определение изменения внутренней энергии
Изменение внутренней энергии, как и любого другого параметра состояния, не зависит от характера процесса. В случае идеального газа оно всегда определяется с помощью следующих уравнений.
Для элементарного процесса
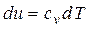 . (2.27)
. (2.27)
Для 1 кг массы термодинамической системы
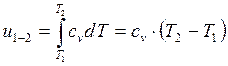 . (2.28)
. (2.28)
Для всей массы термодинамической системы
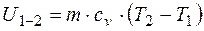 . (2.29)
. (2.29)
Определение изменения энтальпии
Для элементарного процесса
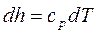 . (2.30)
. (2.30)
Для 1 кг массы термодинамической системы
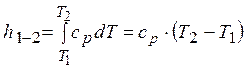 . (2.31)
. (2.31)
Для всей массы термодинамической системы
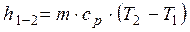 . (2.32)
. (2.32)
Определение изменения энтропии
Изменение энтропии в элементарном термодинамическом процессе по определению выражается соотношением
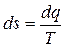 .
.
Используя соотношение первого закона термодинамики (2.13), получим
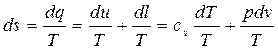 .
.
Если решить уравнение состояния идеального газа, то получим 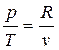 , следовательно
, следовательно
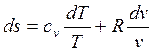 . (2.33)
. (2.33)
Интегрируя соотношение (2.33), получим изменение энтропии в конечном процессе для 1 кг термодинамической системы
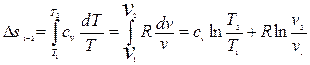 . (2.34)
. (2.34)
Используя выражение первого закона термодинамики в форме (2.16), и проделав аналогичные преобразования, получим
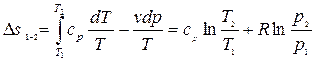 . (2.35)
. (2.35)
Определение теплоты, подводимой (отводимой)
В ходе политропного процесса
Количество тепла, подводимого (отводимого) в ходе политропного процесса, можно определить с помощью уравнения первого закона термодинамики
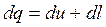 .
.
Сказанное не исключает возможности определения dq с помощью теплоемкости
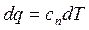
или
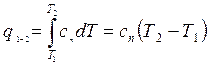 .
.
Используя соотношение (2.19) найдем теплоемкость политропного процесса
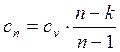 , (2.36)
, (2.36)
где 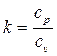
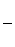 показатель адиабаты.
показатель адиабаты.
Таким образом
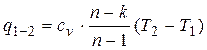 . (2.37)
. (2.37)
Дата: 2019-02-02, просмотров: 350.