в молекуле
 СH2OH (CHOH)4 – C
\ О
H ∕∕
СH2OH (CHOH)4 – C
\ О
H ∕∕
 CН2ОН(СНОН)4 – С +2Ag
CН2ОН(СНОН)4 – С +2Ag  +3NH3
+3NH3  +H2O
\
ONH4
Это качественная реакция на альдегидную группу.
2. Окисляется гидроксидом меди (II) при нагревании
(с образованием глюконовой кислоты и выпадением красного
осадка – CuO).
3. Под действием восстановителей превращается в шестиатомный
+H2O
\
ONH4
Это качественная реакция на альдегидную группу.
2. Окисляется гидроксидом меди (II) при нагревании
(с образованием глюконовой кислоты и выпадением красного
осадка – CuO).
3. Под действием восстановителей превращается в шестиатомный
 спирт – сорбит: С6Н12О6 + Н2 С6Н14О6
спирт – сорбит: С6Н12О6 + Н2 С6Н14О6
Специфические
Свойства
 а) спиртовое брожение: С6Н12О6 2С2Н5ОН + 2СО2
а) спиртовое брожение: С6Н12О6 2С2Н5ОН + 2СО2 
 б) молочнокислое брожение: С6Н12О6 2СН3 – СНОН – СООН
молочная кислота
в) маслянокислое брожение:
б) молочнокислое брожение: С6Н12О6 2СН3 – СНОН – СООН
молочная кислота
в) маслянокислое брожение:
 С6Н12О6 С3Н7СООН + 2Н2
С6Н12О6 С3Н7СООН + 2Н2  +2СО2
+2СО2  масляная кислота
масляная кислота
Лекция 28
Полисахариды
План
1. Крахмал
1.1 Нахождение в природе.
1.2 Физические свойства.
1.3 Строение молекулы.
1.4 Получение.
1.5 Химические свойства.
2. Целлюлоза.
2.1 Нахождение в природе.
2.2 Физические свойства.
2.3 Строение молекул
2.4 Химические свойства.
2.5 Получение
1.1 Нахождение в природе. Крахмал – основное запасное питательное вещество растений. Особенно много крахмала содержат бананы, рис, кукуруза, пшеница, клубни картофеля, плоды бобовых растений.
1.2 Физические свойства. Крахмал – белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер.
1.3 Строение молекулы. Химическая формула крахмала (С6Н10О5)n, где n достигает несколько тысяч. Крахмал – природный полимер, молекулы которого состоят из отдельных звеньев (С6Н10О5). Так как при гидролизе крахмала образуется только глюкоза, то можно сделать вывод, что эти звенья являются остатками молекул глюкозы.
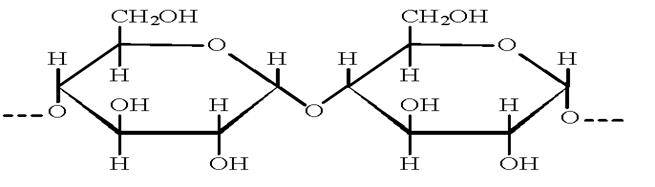
Крахмал
1.4 Получение. Крахмал получают чаще всего из картофеля. Для этого картофель измельчают, промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе тёплого воздуха.
1.5 Химические свойства. Характерной реакцией крахмала является его взаимодействие с иодом. Если к охлаждённому крахмальному клейстеру добавить раствор иода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь.
2. Целлюлоза.
2.1 Нахождение в природе. Целлюлоза, так же как и крахмал, образуется в растениях в процессе фотосинтеза. Оная является основной составной частью оболочки растительных клеток; отсюда происходит её название (от лат – клетка). Волокна хлопка – это почти чистая целлюлоза (до 98%). Волокна льна – конопли тоже состоят главным образом из целлюлозы. В древесине её содержится примерно 50% .
2.2 Физические свойства. Целлюлоза – волокнистое вещество, не растворимое ни в воде, ни в обычных органических растворителях. Растворителем её является реактив Швейцера – аммиачный раствор гидроксида меди (II).
2.3 Строение молекул. Молекулярная формула целлюлозы такая же, как и крахмала: (С6Н10О5)n. Целлюлоза тоже является природным полимером. Её макромолекула состоит из многих остатков молекул глюкозы.
2.4 Химические свойства. Одно из наиболее характерных свойств целлюлозы – способность в присутствии кислот подвергаться гидролизу с образованием глюкозы. Как и гидролиз крахмала, гидролиз целлюлозы протекает ступенчато. Суммарно этот процесс можно изобразить так:
H2SO4, t
 (C6H10O5)n + nH2O nC6H12O6
(C6H10O5)n + nH2O nC6H12O6
В молекуле целлюлозы каждый остаток глюкозы содержит три гидроксильные группы, поэтому для целлюлозы характерны реакции этерификации. Из них практическое значение имеют реакции целлюлозы с азотной кислотой и ангидридом уксусной кислоты.
При взаимодействии целлюлозы с азотной кислотой в присутствии концентрированной серной кислоты в зависимости от условий образуются сложные эфиры – динитроцеллюлоза и 
 тринитроцеллюлоза:
тринитроцеллюлоза:
Общее свойство нитратов целлюлозы – их чрезвычайная горючесть. При взаимодействии целлюлозы с уксусным ангидридом (в присутствии уксусной и серной кислот) получается триацетилцеллюлоза или диацетилцеллюлоза:
2.5 Получение. Основную массу целлюлозы выделяют из древесины. Один из методов получения целлюлозы – так называемый сульфитный. Поэтому методу измельчённую древесину в присутствии раствора гидросульфата кальция Са(HSO3)2 или гидросульфата натрия NaHSO3 нагревают в автоклавах при давлении 0,5–0,6 МПа и температуре 1500С.
Контрольные вопросы
1. Объясните процесс образования молекул целлюлозы из молекул глюкозы.
Чем отличаются по строению молекулы целлюлозы от молекул крахмала?
2. Как образуется целлюлоза в природе? Составьте соответствующие
уравнения реакций.
3. Какие волокна получают из целлюлозы и чем они различаются?
Лекция 29
Белки. Строение. Свойства.
План
1. Белки.
2. Состав и строение.
3. Физические свойства.
4. Химические свойства.
5. Превращение белков в организме.
1. Белки – это природные полимеры, состоящие из остатков 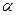 -аминокислот, соединенных между собой пептидными связями.
-аминокислот, соединенных между собой пептидными связями.
Таким образом, белки – это природные полипептиды. Белки входят в состав клеток и тканей всех живых организмов. Все биологические катализаторы – ферменты – являются белками. Белки участвуют в важнейших процессах живого организма – обмене веществ, размножении, росте, работе мышц, желёз и т.д. наряду с углеводами и жирами белки – основная составная часть нашей пищи.
2. Состав и строение. В состав белков входят углерод, водород, кислород и азот. Большинство белков содержит, кроме того, серу, а иногда ещё фосфор, железо и некоторые другие элементы. Относительная молекулярная масса белков очень большая. В результате гидролиза белков чаще всего получают 20 различных аминокислот. Если в состав молекулы белка входит только по одной молекуле каждой из этих 20 аминокислот, то они, соединяясь друг с другом, могут дать свыше 2,4х1018 различных комбинаций. Вот почему так разнообразны и сложны по строению молекулы белков.
3. Физические свойства. Белки бывают растворимые в воде и нерастворимые. Некоторые из них с водой образуют коллоидные растворы.
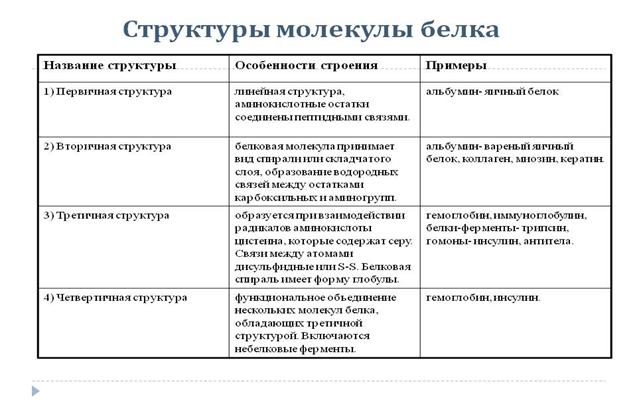
4. Химические свойства. 1. Денатурация белков. При действии солей тяжёлых металлов (Fe, Pb, Hg ), концентрированных кислот оснований, этанола, а также при нагревании происходит необратимое свёртывание (осаждение) белков, т.е. их денатурация. При этом белок теряет биологическую активность вследствие разрушения его вторичной, третичной и четвертичной структур; первичная структур сохраняется. Иногда денатурация бывает обратимой.
2. Цветные реакции белков: 1) если к небольшому количеству раствора белка прилить немного гидроксида натрия и по каплям добавлять раствор сульфата меди (II), то появляется красно-фиолетовая окраска. Такая же реакция происходит и с другими соединениями, которые содержат пептидные группы;
2) при действии концентрированной азотной кислоты белки окрашиваются в жёлтый цвет. Эта реакция доказывает, что в состав белков входят остатки ароматических аминокислот;
3) если к раствору белков прилить ацетат свинца ((II), а затем гидроксид натрия и нагреть, то выпадает осадок, что указывает на содержание серы.
5. Превращение белков в организме. Белки входят в состав пищевых продуктов. Наиболее богаты белком мясо, рыба, молочные продукты, яйца и некоторые зернобобовые продукты.
В организме животных и человека ферменты (пепсин, трипсин) катализируют гидролиз белков. В результате этого образуются аминокислоты, которые всасываются ворсинками кишечника в кровь и используются для образования белков, специфичных для данного организма.
Контрольные вопросы
1. Какие элементы входят в состав белков? Охарактеризуйте строение белковых
молекул.
2. Какие группы атомов и виды связей наиболее характерны для большинства
белковых молекул?
3. Где белки встречаются в природе и каково их значение?
4. Как можно доказать наличие белков в продуктах питания, в шерстяных и
шёлковых тканях?
Лекция 30
Нуклеиновые кислоты
План
1. Нуклеиновые кислоты.
2. Состав нуклеиновых кислот.
1. Нуклеиновые кислоты играют огромную биологическую роль. Это важнейшие компоненты (составные части) всех живых клеток. Эти вещества обеспечивают передачу наследственных признаков в ряду поколений. Без нуклеиновых кислот невозможен биосинтез белков.
2. Состав нуклеиновых кислот исключительно сложный. Их относительная молярная масса очень большая и колеблется в пределах 20 000 – 10 000 000.
Это установлено путём их гидролиза. В состав нуклеотида входят остаток пиримидинового или пуринового основания (азостистого основания), остаток моносахарида (рибозы или дезоксирибозы) и остатки фосфорной кислоты. Если в состав нуклеиновых кислот входят нуклеотиды, содержащие рибозу, то такие нуклеиновые кислоты называют рибонуклеиновыми кислотами (РНК).
В состав дезоксирибонкклеиновых кислот (ДНК) входят нуклеотилы, содержащие дезоксирибозу.
Нуклеотиды соединены в полимерную цепь сложноэфирными связями. Схематически это можно показать так:
… ––– Моносахарид ––– Фосфорная – Моносахарид – Фосфорная ––––…
 кислота кислота
кислота кислота
Азотистое Азотистое
основание основание
Радикалы R – это остатки гетероциклических азотистых оснований. В состав ДНК входят четыре азотистых основания: аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т). В РНК содержатся также четыре азотистых основания, но вместо тимина присутствует урацил (У). Оле спиральные цеп соединены водородными связями, возникающими в результате взаимодействия радикала азотистого основания одной цепи с радикалом азотистого основания другой цепи. Основания, образующие пары, соединенные водородными связями, называют комплементарными (взаимно дополняющими). При образовании таких пар соблюдается следующая закономерность: одно основание обязательно должно быть пуриновое, а другое – пиримидиновое. Причём тимин непременно находится в паре с аденином, а цитозин – с гуанином.
Макромолекула РНК состоит из одной цепи. В состав молекул рибонуклеиновых кислот вместо тимина входит азотистое основание урацил. Урацил, как и тимин, комплектарен аденину.
Контрольные вопросы
1. Как учёным удалось установить состав нуклеиновых кислот?
2.Охарактеризуйте строение нуклеиновых и отдельных звеньев РНК и ДНК.
3.Какова роль ДНК и РНК в биохимических процессах, протекающих
в организме человека? Какова роль нуклеиновых кислот в регулировке
механизма наследственности?
Лекция 31
Дата: 2019-02-02, просмотров: 436.