План
1. Классификация химических реакций по признаку обратимости.
Необратимыми называют реакции, которые протекают до конца, т.е. до полного израсходования одного из реагирующих веществ.
2KClO3 = 2 KCl + 3O2 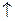

AlCl3+ 3AgNO3 + 3AgCl 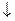 + Al (NO3)3
+ Al (NO3)3
Al3+ + 3 Cl- + 3Ag+ + 3NO-3 = 3AgCl  + Al3+ + 3NO-3
+ Al3+ + 3NO-3
Ag+ + Cl- = AgCl 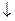
Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях, называют обратимыми.
N2 + 3H2 = 2NH3 + Q
N2 + O2 = 2NO – Q
O O
∕∕ ∕∕
CH3 – C + H – O – C2H5 = CH3 –– C + H2O
\ \
OH O – C2H5
Обратимость химических реакций создаёт много проблем в химической технологии, так как для увеличения выхода продукта реакции необходимо создавать специальные условия. Для этого надо знать правила смещения химического равновесия.
Контрольные вопросы
1. Охарактеризуйте основные типы химических реакций по их важнейшим признакам. Приведите примеры.
2. Определите, к какому типу относят приведённые ниже химические реакции, и объясните их сущность: а) взаимодействие раствора хлорида железа (III) с гидроксидом натрия; б) разложение хлората калия KClO3 при нагревании; в) окисление оксида серы ( IV); г) разложение карбоната кальция при нагревании; д) взаимодействие алюминия с серой. Составьте уравнения этих реакций.
3. Какие реакции называют обратимыми и какие – необратимыми? Приведите конкретные примеры.
4. При сгорании 327 г цинка выделилось 174 кДж теплоты. Вычислите теплоту образования оксида цинка (тепловой эффект реакции).
Лекция 40
Общие научные принципы организации химического производства
План
1. Химия в промышленности.
2. Сырьевые источники
3. Получение оксида сыра (IV).
4. Охрана окружающей среды.
1. Химия в промышленности. Задачи химических производств многообразны: это извлечение металлов из руд, синтез полимеров, лекарственных препаратов, производство важнейших неорганических веществ, стекла, минеральных удобрений, волокон, красителей, косметических средств и многое другое.
Принципиальная схема любого химического производства включает следующие этапы:
1) подготовка сырья (исходных веществ);
2) химическая переработка (проведение химических реакций);
3) выделение целевого продукта (разделение полученной смеси веществ).
Для того чтобы обеспечить оптимальную скорость реакций и высокий выход продукции, на химическом производстве увеличивают поверхность соприкосновения реагирующих веществ, повышают температуру и/или давление, а также используют катализаторы.
2. Сырьевые источники производства серной кислоты достаточно многообразны.
| ||||||
| ||||||
| ||||||
 | |||
 | |||
|
|




|

Сернокислотные заводы расположены в различных районах нашей страны. На каждом заводе используют тот или иной вид сырья, который добывают поблизости. В последние годы в развитии сернокислотного производства всё больше намечается тенденции к комплексному использованию природного сырья. Например, используют оксид серы (IV), образующийся при обжиге сульфидов цветных металлов и сероводорода, который выделяется при коксовании каменного угля или при переработке некоторых природных газов. Так соблюдается принцип комбинирования различных химических производств.
Химическая суть процессов в производстве серной кислоты сводится к окислению сырья до оксида серы (IV) и переводу его в кислоту.
3. Получение оксида сыра ( IV ). Первой стадией в производстве серной кислоты является окисление сырья до оксида серы (IV). Несмотря на то что сырьевые источники многообразны, до сих пор в качестве сырья используют преимущественно серу и серный колчедан (пирит). При этом доля колчедана в баланс сырья уменьшается, а доля серы возрастает.
Рассмотрим получение оксида серы (IV) на примере обжига серного колчедана:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Экспериментальным путём установлены закономерности изменения скорости реакции обжига пирита.
4. Охрана окружающей среды. Охране окружающей среды в нашей стране уделяется большое внимание. На сернокислотных заводах предотвратить загрязнение окружающей среды удаётся путём герметизации аппаратуры и применения газоочистительных установок.
Контрольные вопросы
1. какие этапы включают принципиальная схема химического производства?
2. Серную кислоту можно получить из следующих исходных веществ:
а) сульфида цинка; б) сероводорода; в) сульфида сурьмы Sb2S3.
Составьте уравнения соответствующих реакций.
Лекция 41
ХИМИЯ ПИЩИ
План
1. Пища – источник энергии и веществ для всех живых организмов.
2. Жиры.
3. Углеводы.
4. Белки.
5. Витамины.
1. Пища – источник энергии и веществ для всех живых организмов. Ведь она обеспечивает их жизнедеятельность. Более двух столетий в Нобелевской речи первый российский лауреат этой премии И.П. Павлов отметил, что над всеми явлениями жизни властвует поиск хлеба насущного. Он воплощает ту древнейшую связь которая объединяет все живые существа, в том числе и человека, с окружающей природой. Пища, которая попадает в организм и там претерпевает изменения, олицетворяет жизненный процесс во всей его полноте.
2. Жиры растительного и животного происхождения люди использовали с давних времен. Главная составляющая жиров – эстеры трехатомного спирта глицерина (глицерола) и карбоновых кислот, которые содержат от 5 до 24 атомов углерода в цепи.
Температура плавления жиров зависит от состава и строения кислотных остатков в их молекулах. Насыщенные жиры (они содержат остатки стеариновой и пальмитиновой кислот) обычно твердые. Растительные масла – ненасыщенные жиры, которые содержат остатки олеиновой и других высших ненасыщенных карбоновых кислот.
В любом природном жире есть и другие компоненты – красители душистые веществ. Вы, конечно, обращали на осадок который со временем образуется в бутылках с нерафинированными растительным маслом. Это фосфатиды, продукты термического разложения которых придают золотистый цвет хорошо поджаренному картофелю.
3. Углеводы – важный компонент пищи, мощный энергетический источник обеспечения жизнедеятельности организма. Вспомните: энергетический потенциал моносахарида глюкозы С6Н12О6 реализуется вследствие биохимических превращений при участии АТФ. Полученную энергии. Организм использует во время мышечных сокращений, жизненно важных процессов, биосинтеза в частности.
Животные организмы способны накапливать в печени водорастворимый полисахарид гликоген (С6Н10О5)n. Этот энергетический резерв может быть быстро мобилизован в случае необходимости компенсации внезапного недостатка глюкозы.
Резервный источник питания растений – запасы нерастворимых в воде зерен крахмала (С6Н10О5)n (какие сельскохозяйственные культуры являются источником этого полисахарида?).
4. Белки – незаменимая часть пищи. Организм использует их для построения новых клеток и замены изношенных, эти соединения принимают активное участие в обмене веществ. Диетологи небезосновательно называют их «протеинами» – первый, первостепенный.
Белки организма образуются из аминокислот – продуктов ферментативного гидролиза белков пищи. Основные источники белка животного происхождения – это мясо, рыба, сыр, яйца – важнейшие белковые продукты. В растительных продуктах тоже содержатся протеины, особенно богаты ими бобы и орехи.
5. Витамины. Роль витаминов в обеспечении нормального функционирования организма трудно переоценить. Эти соединения обеспечивают жизненно необходимые процессы в организме, принимают активное участие в обмене веществ. Поступление достаточного количества витаминов в организм возможно при условии потребления разнообразной пищи. Процессы обмена витаминов взаимосвязаны, недостаток одного из них влияет на усвоение других.
Контрольные вопросы
1. Сравните химический состав животных жиров и растительных масел.
Лекция 42
Дата: 2019-02-02, просмотров: 413.