Лекция 26
Тема: Углеводы. Классификация углеводов.
План
1. Классификация углеводов.
2. Моносахариды.
3. Глюкоза.
4. Сахароза.
5. Рибоза и дезоксирибоза.
1. Классификация углеводов. Органические вещества со сходным строением и свойствами, состав которых в большинстве случаев отражает формула Cn(H2O)m, называют углеводами.
Углеводы в зависимости от их строения можно подразделить на моносахариды, олигосахариды и полисахариды.
Схема 1
|


 | |||||
 | |||||
 | |||||
2. Моносахариды. Молекулы моносахаридов могут содержать от трёх атомов углерода. Названия моносахаридов оканчиваются на –оза. В зависимости от числа атомов углерода в молекуле моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы и т.д. Наибольшее значение имеют гексозы (особенно глюкоза) и пентозы.
3. Глюкоза содержится почти во всех органах зелёных растений. Особенно её много в соке винограда, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы и фруктозы. В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках.
В природе глюкоза наряду с другими углеводами образуется в результате реакции фотосинтеза:
хлорофилл, свет
 6СО2 + 6Н2О С6Н12О6 +6О2 – Q
6СО2 + 6Н2О С6Н12О6 +6О2 – Q
4. Сахароза. Молекулы олигосахаридов состоят из нескольких остатков моносахаридов (не более 10). Наиболее распространены дисахариды – димеры, состоящие из остатков двух молекул моносахаридов. Самый известный дисахарид – сахароза. Сахароза входит в состав сока сахарной свёклы (16-20%) и сахарного тростника (14-26%). В небольших количествах она содержится с глюкозой в плодах и листьях многих зел1ныз растений.
Чистая сахароза – бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде.
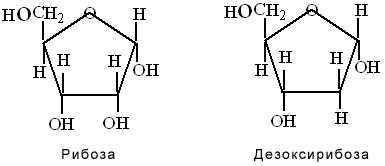
5. Рибоза и дезоксирибоза. Из пентоз большой интерес представляет рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот. (Название «дезоксирибоза» показывает, что по сравнению с рибозой в её молекуле на одну группу ОН меньше). Как и молекула глюкозы, молекулы рибозы и дезоксирибозы могут иметь циклическое строение:
Контрольные вопросы
1. Какие вещества относят к углеводам?
2. Как классифицируют углеводы и почему?
3. Какова роль глюкозы в живых организмах?
Лекция 27
Химические свойства альдегидоспиртов на примере глюкозы.
План
1. Химические свойства.
1.1. Взаимодействие глюкозы с гидроксидом меди (II).
1.2. Реакция глюкозы с оксидом серебра ((I).
2. Таблица
1. Химические свойства. Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов.
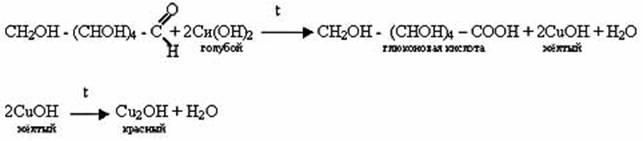
1.1. Взаимодействие глюкозы с гидроксидом меди (II). Налейте в пробирку 2-3 мл раствора глюкозы и столько же разбавленного раствора гидроксида натрия (NaOH) должен быть в избытке). Затем добавьте несколько капель раствора сульфита меди (II). Что представляет собой раствор синего цвета? Что доказывает данный опыт?
1.2. Реакция глюкозы с оксидом серебра (I). В две пробирки налейте по 1мл раствора нитрата серебра ((I) и добавляйте по каплям разбавленный раствор аммиака. Образующийся осадок оксида серебра ((I) растворяется в избытке водного раствора аммиака. Затем в одну пробирку прилейте 1–1,5 мл раствора, в котором массовая доля глюкозы равна 0,2, в другую – столько же раствора фруктозы. Обе пробирки поместите в сосуд с горячей водой.
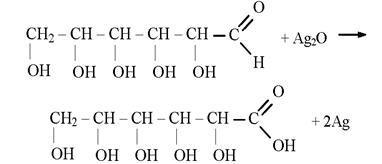
Контрольные вопросы
1. Перечислите известные вам процессы брожения глюкозы и укажите их
практическое значение.
2. Какие пентозы вам известны? Изобразите их структурные формулы.
3. Подготовьте электронную презентацию по теме «Фотосинтез».
Таблица 1
Химические свойства глюкозы
Специфические
Свойства
 а) спиртовое брожение: С6Н12О6 2С2Н5ОН + 2СО2
а) спиртовое брожение: С6Н12О6 2С2Н5ОН + 2СО2 
 б) молочнокислое брожение: С6Н12О6 2СН3 – СНОН – СООН
молочная кислота
в) маслянокислое брожение:
б) молочнокислое брожение: С6Н12О6 2СН3 – СНОН – СООН
молочная кислота
в) маслянокислое брожение:
 С6Н12О6 С3Н7СООН + 2Н2
С6Н12О6 С3Н7СООН + 2Н2  +2СО2
+2СО2 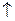 масляная кислота
масляная кислота
Лекция 28
Полисахариды
План
1. Крахмал
1.1 Нахождение в природе.
1.2 Физические свойства.
1.3 Строение молекулы.
1.4 Получение.
1.5 Химические свойства.
2. Целлюлоза.
2.1 Нахождение в природе.
2.2 Физические свойства.
2.3 Строение молекул
2.4 Химические свойства.
2.5 Получение
1.1 Нахождение в природе. Крахмал – основное запасное питательное вещество растений. Особенно много крахмала содержат бананы, рис, кукуруза, пшеница, клубни картофеля, плоды бобовых растений.
1.2 Физические свойства. Крахмал – белый порошок, нерастворимый в холодной воде. В горячей воде он набухает и образует клейстер.
1.3 Строение молекулы. Химическая формула крахмала (С6Н10О5)n, где n достигает несколько тысяч. Крахмал – природный полимер, молекулы которого состоят из отдельных звеньев (С6Н10О5). Так как при гидролизе крахмала образуется только глюкоза, то можно сделать вывод, что эти звенья являются остатками молекул глюкозы.
Крахмал
1.4 Получение. Крахмал получают чаще всего из картофеля. Для этого картофель измельчают, промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе тёплого воздуха.
1.5 Химические свойства. Характерной реакцией крахмала является его взаимодействие с иодом. Если к охлаждённому крахмальному клейстеру добавить раствор иода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь.
2. Целлюлоза.
2.1 Нахождение в природе. Целлюлоза, так же как и крахмал, образуется в растениях в процессе фотосинтеза. Оная является основной составной частью оболочки растительных клеток; отсюда происходит её название (от лат – клетка). Волокна хлопка – это почти чистая целлюлоза (до 98%). Волокна льна – конопли тоже состоят главным образом из целлюлозы. В древесине её содержится примерно 50% .
2.2 Физические свойства. Целлюлоза – волокнистое вещество, не растворимое ни в воде, ни в обычных органических растворителях. Растворителем её является реактив Швейцера – аммиачный раствор гидроксида меди (II).
2.3 Строение молекул. Молекулярная формула целлюлозы такая же, как и крахмала: (С6Н10О5)n. Целлюлоза тоже является природным полимером. Её макромолекула состоит из многих остатков молекул глюкозы.
2.4 Химические свойства. Одно из наиболее характерных свойств целлюлозы – способность в присутствии кислот подвергаться гидролизу с образованием глюкозы. Как и гидролиз крахмала, гидролиз целлюлозы протекает ступенчато. Суммарно этот процесс можно изобразить так:
H2SO4, t
 (C6H10O5)n + nH2O nC6H12O6
(C6H10O5)n + nH2O nC6H12O6
В молекуле целлюлозы каждый остаток глюкозы содержит три гидроксильные группы, поэтому для целлюлозы характерны реакции этерификации. Из них практическое значение имеют реакции целлюлозы с азотной кислотой и ангидридом уксусной кислоты.
При взаимодействии целлюлозы с азотной кислотой в присутствии концентрированной серной кислоты в зависимости от условий образуются сложные эфиры – динитроцеллюлоза и 
 тринитроцеллюлоза:
тринитроцеллюлоза:
Общее свойство нитратов целлюлозы – их чрезвычайная горючесть. При взаимодействии целлюлозы с уксусным ангидридом (в присутствии уксусной и серной кислот) получается триацетилцеллюлоза или диацетилцеллюлоза:
2.5 Получение. Основную массу целлюлозы выделяют из древесины. Один из методов получения целлюлозы – так называемый сульфитный. Поэтому методу измельчённую древесину в присутствии раствора гидросульфата кальция Са(HSO3)2 или гидросульфата натрия NaHSO3 нагревают в автоклавах при давлении 0,5–0,6 МПа и температуре 1500С.
Контрольные вопросы
1. Объясните процесс образования молекул целлюлозы из молекул глюкозы.
Чем отличаются по строению молекулы целлюлозы от молекул крахмала?
2. Как образуется целлюлоза в природе? Составьте соответствующие
уравнения реакций.
3. Какие волокна получают из целлюлозы и чем они различаются?
Лекция 29
Белки. Строение. Свойства.
План
1. Белки.
2. Состав и строение.
3. Физические свойства.
4. Химические свойства.
5. Превращение белков в организме.
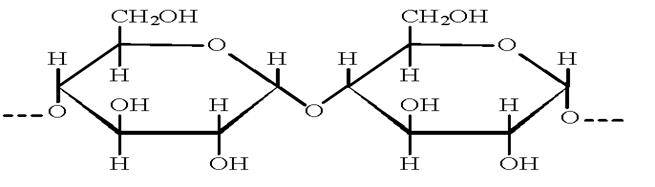
1. Белки – это природные полимеры, состоящие из остатков 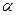 -аминокислот, соединенных между собой пептидными связями.
-аминокислот, соединенных между собой пептидными связями.
Таким образом, белки – это природные полипептиды. Белки входят в состав клеток и тканей всех живых организмов. Все биологические катализаторы – ферменты – являются белками. Белки участвуют в важнейших процессах живого организма – обмене веществ, размножении, росте, работе мышц, желёз и т.д. наряду с углеводами и жирами белки – основная составная часть нашей пищи.
2. Состав и строение. В состав белков входят углерод, водород, кислород и азот. Большинство белков содержит, кроме того, серу, а иногда ещё фосфор, железо и некоторые другие элементы. Относительная молекулярная масса белков очень большая. В результате гидролиза белков чаще всего получают 20 различных аминокислот. Если в состав молекулы белка входит только по одной молекуле каждой из этих 20 аминокислот, то они, соединяясь друг с другом, могут дать свыше 2,4х1018 различных комбинаций. Вот почему так разнообразны и сложны по строению молекулы белков.
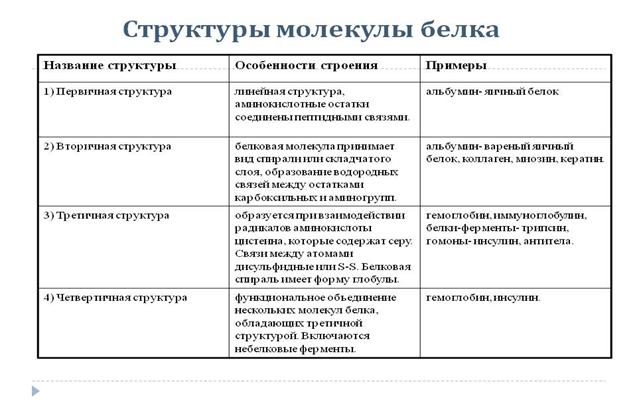
3. Физические свойства. Белки бывают растворимые в воде и нерастворимые. Некоторые из них с водой образуют коллоидные растворы.
4. Химические свойства. 1. Денатурация белков. При действии солей тяжёлых металлов (Fe, Pb, Hg ), концентрированных кислот оснований, этанола, а также при нагревании происходит необратимое свёртывание (осаждение) белков, т.е. их денатурация. При этом белок теряет биологическую активность вследствие разрушения его вторичной, третичной и четвертичной структур; первичная структур сохраняется. Иногда денатурация бывает обратимой.
2. Цветные реакции белков: 1) если к небольшому количеству раствора белка прилить немного гидроксида натрия и по каплям добавлять раствор сульфата меди (II), то появляется красно-фиолетовая окраска. Такая же реакция происходит и с другими соединениями, которые содержат пептидные группы;
2) при действии концентрированной азотной кислоты белки окрашиваются в жёлтый цвет. Эта реакция доказывает, что в состав белков входят остатки ароматических аминокислот;
3) если к раствору белков прилить ацетат свинца ((II), а затем гидроксид натрия и нагреть, то выпадает осадок, что указывает на содержание серы.
5. Превращение белков в организме. Белки входят в состав пищевых продуктов. Наиболее богаты белком мясо, рыба, молочные продукты, яйца и некоторые зернобобовые продукты.
В организме животных и человека ферменты (пепсин, трипсин) катализируют гидролиз белков. В результате этого образуются аминокислоты, которые всасываются ворсинками кишечника в кровь и используются для образования белков, специфичных для данного организма.
Контрольные вопросы
1. Какие элементы входят в состав белков? Охарактеризуйте строение белковых
молекул.
2. Какие группы атомов и виды связей наиболее характерны для большинства
белковых молекул?
3. Где белки встречаются в природе и каково их значение?
4. Как можно доказать наличие белков в продуктах питания, в шерстяных и
шёлковых тканях?
Лекция 30
Нуклеиновые кислоты
План
1. Нуклеиновые кислоты.
2. Состав нуклеиновых кислот.
1. Нуклеиновые кислоты играют огромную биологическую роль. Это важнейшие компоненты (составные части) всех живых клеток. Эти вещества обеспечивают передачу наследственных признаков в ряду поколений. Без нуклеиновых кислот невозможен биосинтез белков.
2. Состав нуклеиновых кислот исключительно сложный. Их относительная молярная масса очень большая и колеблется в пределах 20 000 – 10 000 000.
Это установлено путём их гидролиза. В состав нуклеотида входят остаток пиримидинового или пуринового основания (азостистого основания), остаток моносахарида (рибозы или дезоксирибозы) и остатки фосфорной кислоты. Если в состав нуклеиновых кислот входят нуклеотиды, содержащие рибозу, то такие нуклеиновые кислоты называют рибонуклеиновыми кислотами (РНК).
В состав дезоксирибонкклеиновых кислот (ДНК) входят нуклеотилы, содержащие дезоксирибозу.
Нуклеотиды соединены в полимерную цепь сложноэфирными связями. Схематически это можно показать так:
… ––– Моносахарид ––– Фосфорная – Моносахарид – Фосфорная ––––…
 кислота кислота
кислота кислота
Азотистое Азотистое
основание основание
Радикалы R – это остатки гетероциклических азотистых оснований. В состав ДНК входят четыре азотистых основания: аденин (А), гуанин (Г), цитозин (Ц) и тимин (Т). В РНК содержатся также четыре азотистых основания, но вместо тимина присутствует урацил (У). Оле спиральные цеп соединены водородными связями, возникающими в результате взаимодействия радикала азотистого основания одной цепи с радикалом азотистого основания другой цепи. Основания, образующие пары, соединенные водородными связями, называют комплементарными (взаимно дополняющими). При образовании таких пар соблюдается следующая закономерность: одно основание обязательно должно быть пуриновое, а другое – пиримидиновое. Причём тимин непременно находится в паре с аденином, а цитозин – с гуанином.
Макромолекула РНК состоит из одной цепи. В состав молекул рибонуклеиновых кислот вместо тимина входит азотистое основание урацил. Урацил, как и тимин, комплектарен аденину.
Контрольные вопросы
1. Как учёным удалось установить состав нуклеиновых кислот?
2.Охарактеризуйте строение нуклеиновых и отдельных звеньев РНК и ДНК.
3.Какова роль ДНК и РНК в биохимических процессах, протекающих
в организме человека? Какова роль нуклеиновых кислот в регулировке
механизма наследственности?
Лекция 31
План
1. Биологическая роль нуклеиновых кислот.
2. Дезоксирибонуклеиновая кислота (ДНК).
3. Рибонуклеиновые кислоты (РНК).
1. Биологическая роль нуклеиновых кислот. Нуклеиновые кислоты впервые были обнаружены в клеточных ядрах. Биологическое значение нуклеиновых кислот очень велико. Они играют центральную роль в хранении и передаче наследственных свойств клетки, поэтому их часто называют веществами наследственности. Известно, что любая клетка возникает в результате деления материнской клетки. При этом дочерние клетки наследуют свойства материнской. Свойства же клетки определяются главным образом её белками. Нуклеиновые кислоты обеспечивают в клетке синтез белков, точно таких же, как в материнской клетке.
Существует два вида нуклеиновых кислот – дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота(РНК)о
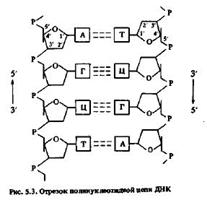
2. Дезоксирибонуклеиновая кислота (ДНК). Роль хранителя наследственной информации у всех клеток – животных и растительных – принадлежит ДНК. Молекула ДНК представляет собой две спирально закрученные одна вокруг другой нити. Ширина такой двойной спирали ДНК невелика, около 2 нм. Длина её в десятки тысяч раз больше – она достигает сотен тысяч нанометров. Между тем самые крупные белковые молекулы в развернутом виде достигают в длину не более 100-200нм. Вдоль молекулы ДНК могут быть уложены одна за другой тысячи белковых молекул. Молекулярная масса ДНК соответственно исключительно велика – она достигает десятков и даже сотен миллионов.
Каждая нить ДНК представляет собой полимер, мономерами которого являются нуклеотиды. Нуклеотид – это химическое соединение остатков трёх веществ: азотистого основания, углевода (моносахарида – дезоксирибозы) и фосфорной кислоты. ДНК образованы соединением четырёх видов нуклеотидов.. Нуклеотиды отличаются только по азотистым основаниям, в соответствии с которыми их называют: нуклеотид с азотистым основанием аденин (сокращенно А), нуклеотид с гуанином (Г), нуклеотид с тимином (Т) и нуклеотид с цитозином (Ц). по размерам А равен Г, а Т равен Ц; размеры А и Г несколько больше, чем Т и Ц.
Соединение нуклеотидов в нити ДНК происходит через углевод одного нуклеотида и фосфорную кислоту соседнего. Они соединяются прочной ковалентной связью. Каждая нить ДНК представляет собой полинуклеотид. Эта длинная цепь, в которой в строго определенном порядке расположены нуклеотиды.
Азотистые основания одной цепи «стыкуются» с азотистыми основаниями другой. Основания подходят друг к другу настолько близко, что между ними возникают водородные связи. В расположении стыкующихся нуклеотидов имеется важная закономерность, а именно: против А одной цепи всегда оказывается Т на другой цепи, а против Г одной цепи – всегда Ц. Оказывается, что только при таком сочетании нуклеотидов обеспечивается, во-первых, одинаковое по всей длине двойной спирали расстояние между цепями и, во-вторых, образование между противолежащими основаниями максимального числа водородных связей (три водородные связи между Г и Ц и две водородные связи между А и Т). В каждом из этих сочетаний оба нуклеотида как бы дополняют друг друга. Если на каком-нибудь участке одной цепи ДНК один за другим следуют нуклеотиды А, Г, Ц, Т, А, Ц, Ц, то на противолежащем участке другой цепи окажутся комплементарные им Т, Ц, Г, А, Т, Г, Г. Известен порядок следования нуклеотидов в одной цепи, то по принципу комплементарности сразу же выясняется порядок нуклеотидов в другой цепи.
3. Рибонуклеиновые кислоты (РНК). Структуры РНК сходны со структурами ДНК. РНК, как и ДНК, полинуклеотиды. Но в отличие от ДНК, молекула РНК одноцепочечная. Как и в ДНК, структура РНК создается чередованием четырёх типов нуклеотидов, но состав нуклеотидов РНК не дезоксирибоза, а рибоза, отсюда и название РНК – рибонуклеиновая кислота. В РНК вместо азотистого основания тимина входит другое, близкое по строению основание, называемое урацидом (У).
В клетке имеется несколько видов РНК. Все они участвуют в синтезе белка. Первый вид – транспортные РНК (т-РНК). Это самые маленькие по размерам РНК. Они связывают аминокислоты и транспортируют их месту синтеза белка. Второй вид – информационные РНК (и-РНК). По размерам они раз в 10 больше т-РНК. функция состоит в переносе информации о структуре белка от ДНК к месту синтеза белка. Третий вид – рибосомные РНК (р-РНК). Они имеют наибольшие размеры молекулы и входят в состав рибосом. 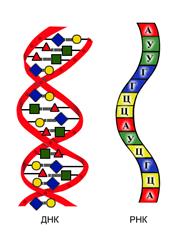
Контрольные вопросы
1. Какие виды нуклеиновых кислот обнаружены в клетке?
2. Какова биологическая роль ДНК?
3. Охарактеризуйте структуру ДНК.
4. В чем сущность принципа комплементарности?
Лекция 32
План
1. Полимеры, поучаемые в реакциях полимеризации. Строение молекул.
Реакция полимеризации характерна для многих органических веществ, в молекулах которых имеются двойные или тройные связи, например:


 nCH2 = CH (–– CH2––CH ––) n
nCH2 = CH (–– CH2––CH ––) n
CH3 CH3
пропилен полипропилен
В результате таких реакций образуются высокомелекулярные соединения, которые называют полимерами. Молекулы полимеров – это макромолекулы. Вещества, из которых получают полимеры, называют мономерами.
Например, мономером полистирола является стирол:
 HC = CH2
HC = CH2
 C
C




 HC CH nCH2 = CH (–– CH2 –– CH ––)n
HC CH nCH2 = CH (–– CH2 –– CH ––)n

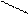
 HC CH C6H5 C6H5
HC CH C6H5 C6H5
CH поли cтирол
стирол
Буква n в формуле полимера показывает, сколько молекул мономера соединилось в процессе полимеризации; её называют степенью полимеризации. Степень полимеризации не является постоянной величиной. Так, при полимеризации этилена могут образоваться макромолекулы, у которых число n колеблется до 100 000. Поэтому обычно указываемая для данного полимера относительная молекулярная масса является его средней молекулярной массой.
Многократно повторяющуюся в молекуле полимера группу атомов называют структурным звеном.
Например, структурные звенья полиэтилена и полипропилена такие:
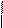 –– СН2 –– СН2––– и –– СН2–– СН ––
–– СН2 –– СН2––– и –– СН2–– СН ––
СН3
Физические свойства полимеров сильно зависят от степени полимеризации. Они зависят и от того, как соединяются друг с другом молекулы мономеров, т.е. от их строения. Полимеры могут иметь линейную, разветвлённую и пространственную (сетчатую) структуру.
В процессе полимеризации, например, пропилена может образоваться полимер со стереорегулярной структурой:

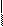
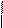

 Н СН3 Н Н Н Н Н Н
Н СН3 Н Н Н Н Н Н









 – С–С– С –С–С– С–С– С –
– С–С– С –С–С– С–С– С –
СН3 Н Н Н СН3Н СН3
Стереорегулярной эту структуру называют потому, что радикалы – СН3 в ней размещены хаотически – по одну и другую сторону цепи.
Качество полимера значительно улучшается, если он имеет стереорегулярную структуру. Но для получения таких полимеров требуются особые условия (специфические катализаторы, оптимальные температура и давление).
Контрольные вопросы
1. Какие вещества относят к высокомолекулярным соединениям?
Что называют полимером? На конкретных примерах поясните, чем
различаются мономер и структурное звено полимера.
2. Поясните, что такое степень полимеризации.
Лекция 33
Классификация пластмасс
План
1. Полиэтилен и полипропилен.
1.1 Получение.
1.2 Физические свойства.
1.3 Химические свойства.
1.4 Применение.
2. Политетрафторэтилен.
1. Полиэтилен и полипропилен. Эти линейные полимеры фактически имеют зигзагообразное строение. Их молекулы сильно изогнуты в различных направлениях, иногда даже свёрнуты в клубки.
1.1 Получение. Ещё недавно полиэтилен (–СН2–СН2–)n получили под высоким давлением при повышенной температуре. Реализация такого производственного процесса была весьма сложной. В последнее время полимеризацию проводят при атмосферном давлении и комнатной температуре в присутствии триэтилалюминия и хлорида титана (IV). Синтезированный таким путём полиэтилен плавится при более высокой температуре и обладает большей механической прочностью, так как имеет меньше ответвлений. Подобным образом получают пропилен, поливинилхлорид, полистирол, полиметилметакрилат и некоторые другие полимеры.
1.2 Физические свойства. Полиэтилен значительно легче воды, его плотность примерно 0,92 г/см3. Он эластичен, в тонком слое бесцветный, прозрачный, на ощупь несколько жирный, напоминающий парафин. Если кусочек полиэтилена нагреть, то уже при температуру 1100С он становится мягким и легко изменяет форму. При охлаждении полиэтилен затвердевает и сохраняет приданную ему форму.
Свойство тел изменять форму в нагретом состоянии и сохранять её после охлаждения называют термопластичностью. При сильном нагревании полиэтилен разлагается. Полипропилен (отдельные его виды) отличаются от полиэтилена более высокой температурой плавления (плавится при температуре 160–1800С) и большей механической прочностью.
1.3 Химические свойства. Полиэтилен и полипропилен обладают свойствами предельных углеводородов. При обычных условиях эти полимеры не реагируют ни с серной кислотой, ни со щелочами. Азотная кислота разрушает полиэтилен, особенно при нагревании. Они не обесцвечивают бромную воду и раствор перманганата калия даже при нагревании.
1.4 Применение. Полиэтилен и полипропилен в тонком слое хорошо пропускают ультрафиолетовые лучи, поэтому плёнки из этих материалов используют вместо стекла в парниках и теплицах. Их применяют также для упаковки разных продуктов. Нужно иметь в виду, что полиэтилен начинает размягчаться при 800С. Если вы хотите налить горячий чай в пластиковый стакан то будьте внимательны: стакан может быть предназначен только для холодных пищевых продуктов.
2. Политетрафторэтилен. Если в молекуле этилена все атомы водорода заместить атомами фтора, то получается тетрафторэтилен CF2 = CF2. При полимеризации последнего образуется политетрафторэтилен, или тефлон
( –CF2–CF2–)n, – прочное и химически очень стойкое вещество. Тефлон по химической устойчивости превосходит все металлы, даже золото и платину. Он выдерживает температуру до 2600С, не гори и является отличным диэлектриком. В быту очень популярна посуда с покрытием из тефлона – пища в такой посуде не пригорает. Но такое покрытие можно легко поцарапать металлическими предметами, и посуда быстро портится. Поэтому при приготовлении пищи в такой посуде необходимо пользоваться деревянной лопаточкой.
Контрольные вопросы
1. Охарактеризуйте процесс получения полиэтилена и полипропилена в
промышленности. Составьте уравнения соответствующих реакций.
2. Опишите свойства полиэтилена, полипропилена и тефлона. Где применяют
эти вещества?
3. Составьте уравнения реакций образования поливинилхлорида и полистирола.
Где применяют эти вещества?
Лекция 34
План
1. Строение и свойства.
2. Получение.
3. Важнейшие виды синтетических каучуков, их свойства и применение
1. Строение и свойства синтетических каучуков сходны со строением и свойствами природного каучука.
2. Получение. В настоящее время для получения синтетических каучуков в основном используют углеводороды, содержащиеся в нефтяных газах и продуктах переработки нефти.
Производство бутадиенового каучука основывается на полимеризации бутадиена-1,3 в присутствии катализатора.
Однако оказалось, что в звеньях бутадиенового каучука, в отличие от природного каучука, группы – СН2– расположены по разные стороны двойной связи, т.е. находятся в транс - положении:
 | |||
 | |||
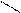
 Н СН2 –
Н СН2 –
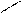
 C = С
C = С
 – СН2 H n
– СН2 H n

Впоследствии на основе изучения пространственного строения природного каучука учёным удалось решить проблему синтеза дивинилового и изопренового каучуков стереорегулярного строения.
Уравнение реакции образования синтетического изопренового каучука аналогично реакции образования природного каучука. Синтез стереорегулярных каучуков является величайшим достижением химической науки и промышленности. В последние годы получают разнообразные синтетические каучуки, обладающие высокой стойкостью к бензину, керосину, смазочным маслам.
3. Важнейшие виды синтетических каучуков, их свойства и применение
| Название | Исходные вещества (мономеры) | Формула полимера | Важнейшие свойства и применение |
| Бутадиеновый каучук | СН2=СН–СН=СН2 бутадиен –1,3 |  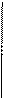 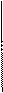 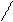 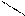 Н СН2– Н СН2–
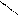 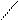 С= С С= С
  –– СН2 Н
Нерегулярное строение –– СН2 Н
Нерегулярное строение
| Характерна водо- и газонепроницаемость. По эластичности уступает природному каучуку. В производстве кабелей, обуви, принадлежностей быта. |
| Название | Исходные вещества (мономеры) | Формула полимера | Важнейшие свойства и применение |
| Дивиниловый каучук | СН2=СН–СН=СН2 бутадиен –1,3 |     Н Н Н Н
 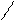 С=С СН2 ––
––СН2
Регулярное строение С=С СН2 ––
––СН2
Регулярное строение
| По износоустойчивости и эластичности превосходит природный каучук. В производстве шин. |
Контрольные вопросы
1. Поясните, кем и когда впервые в мире был разработан метод производства
синтетического каучука. Составьте уравнения.
2. Для получения бутадиенового и дивинилового каучуков используют один и
тот же мономер. Поясните, почему эти каучуки различаются по своим
свойствам.
3. Охарактеризуйте известные вам синтетические каучука и поясните, для
каких технических целей их применяют.
Лекция 35
План
1. Строение молекул.
2. Физические свойства.
3. Химические свойства.
4. Применение.
1. Строение молекул. Натуральный каучук содержится в млечном соке некоторых растений, например гевеи, родиной которой является Бразилия. Это эластичный природный полимер с относительной молекулярной массой 15 000 – 100 000. При температуре выше 2000С натуральный каучук разлагается с образованием низкомолекулярных углеводородов.
Чтобы выяснить строение молекул природного каучука, небольшие его кусочки помещают в пробирку и закрывают её пробкой с газоотводной трубкой. Конец газоотводной трубки помещают в другую пробирку. Пробирку с кусочками каучука нагревают. При температуре выше 2000С каучук разлагается. Жидкие продукты разложения собираются во второй пробирке. Если к продуктам разложения прилить бромную воду, она обесцвечивается. Из этого следует, что в продуктах разложения природного каучука содержатся непредельные соединения. Характерно, что в макромолекулы натурального каучука группы –СН2 – находятся по одну сторону двойных связей (цис-форма). Оказалось, что именно такое стереорегулярное строение молекул придаёт натуральному каучуку эластичность (способность растягиваться и сжиматься под действием внешней силы, а затем восстанавливать прежнюю форму).
2. Физические свойства. Природный каучук благодаря эластичности очень устойчив к износу. Эти свойства необходимы для получения высококачественных автомобильных и авиационных шин. Ценным его свойством является также водо - и газонепроницаемость. Кроме того, он является хорошим электроизолятором. Каучук в воде не растворяется. В этиловом спирте его растворимость небольшая. В хлороформе и бензине он набухает, а затем растворяется. При повышенной температуре каучук становится мягким и липким, а на холоде – твёрдым и хрупким. При долгом хранении каучук твердеет.
3. Химические свойства. Для устранения недостатков природного каучука используют его химические свойства.
В молекулах каучука имеются двойные связи, поэтому для него характерны реакции присоединения. Так, например, если каучук нагревают с серой (вулканизируют) до температуры 130-1400С, то атомы серы присоединяются по месту некоторых двойных связей и как бы сшивают молекулы друг с другом.
Процесс вулканизации каучука упрощённо можно изобразить так:
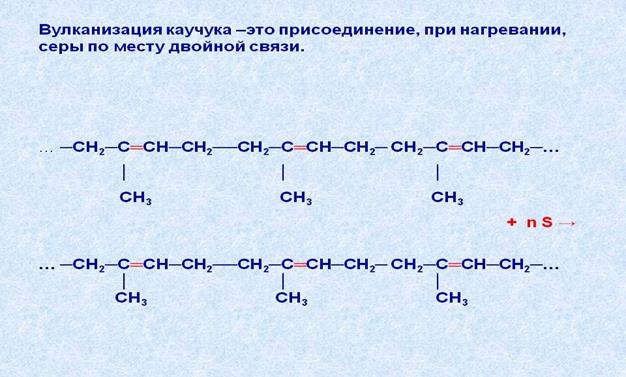
Перед вулканизацией к каучуку добавляют наполнители (сажу) и различные красители. В результате процесса вулканизации получают резину, которая значительно прочнее невулканизированного каучука. Если к каучуку при вулканизации добавляют больше серы, чем её требуется для образования резины, то получают эбонит – твёрдый неэластичный материал.
4. Применение. В настоящее время ведущие мировые производители натурального каучука – это страны Юго-Восточной Азии (Таиланд, Индонезия, Малайзия, Вьетнам, Китай). В сыром виде применяют не более 1% добываемого натурального каучука (резиновый клей). Более 60% натурального каучука идёт на изготовление автомобильных шин. Натуральный каучук незаменим при производстве крупногабаритных шин, способных выдерживать нагрузки до 75 т. Лучшие фирмы-производители изготавливают покрышки для шин легковых автомобилей из смеси натурального и синтетического каучука. Натуральный каучук применяют также при изготовлении конвейерных лент высокой мощности, антикоррозийных покрытий котлов и труб, ортопедических матрацев и подушек, в медицине.
Контрольные вопросы
1. В чём сущность процесса вулканизации каучука?
2. Что такое эбонит?
3. Какие условия следует соблюдать при долгом хранении автокамер, шин,
резиновых трубопроводов и других изделий? Почему?
Лекция 36
План
1. Атомно-молекулярное учение.
2. Строение электронных оболочек атомов.
3. Периодический закон и Периодическая система Д.И. Менделеева.
1. Атомно-молекулярное учение. Сущность учения М.в. Ломоносова сводится к следующему.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из различных атомов.
Через 67 лет после работ М.В. Ломоносова вышла книга английского ученого Джона Дальтона «Новая система химической философии» (1808), в которой были изложены основные положения химической атомистики. Дальтон впервые определил атомные массы известных тогда элементов и ввел знаки для обозначения атомов.
Однако Дальтон отрицал существование молекул у простых веществ. Он полагал, что простые вещества состоят только из атомов и лишь сложные вещества – из «сложных атомов» в современном понимании – молекул). Отрицание существования молекул простых веществ мешало дальнейшему развитию химии. В частности, нельзя было объяснить, почему из одного объема водорода и одного объема хлора образуется два объема хлороводорода (если газы взяты при одинаковых условиях). Эти трудности были преодолены итальянским ученым Амедео Авогадро, предположившим, что молекулы простых газов – кислорода, азота, водорода, хлора – двухатомны.
Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в. На Международном съезде химиков в г. Карлеруэ в 1860 г. Были приняты определения понятий молекулы и атома. В настоящее время они формулируются так.
Молекула – наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и химическим строением. Молекулы состоит из атомов.
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Химические свойства атома определяются его строением.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, образующих электронную оболочку.
Понятия молекулы и атома совпадают для одноатомных молекул, например у благородных газов. Их атомы в свободном состоянии представляют собой одноатомные молекулы.
С точки зрения атомно-молекулярного учения каждый отдельный вид атомов называется химическим элементом. Положительный заряд ядра атома, равный порядковому номеру элемента, является главной его характеристикой и служит отличительным признаком различных видов атомов. Это позволяет дать современное определение понятия элемента: химический элемент – это вид атомов с одинаковым положительным зарядом ядра. В настоящее время известно 10% элементов.
По современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом (кристаллическом) состоянии из молекул состоят лишь вещества, имеющие молекулярную структуру. Например, органические вещества, большинство неметаллов, оксид углерода (IV), вода.
2. Строение электронных оболочек атомов. Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра. Быстро движущийся электрон может находиться в любой части пространства, окружающего ядро, и различные положения его рассматриваются как электронное облако с определенной плотностью отрицательного заряда. Более наглядно это можно представить так. Если бы через весьма малые промежутки времени сфотографировать положение электрона в атоме (он отразится на фотографии в виде точки), то при наложении множества таких фотографий получилась бы картина электронного облака.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью. В нам заключено 90% электронного облака. Электроны, которые движутся в орбиталях близкого размера, образуют электронный слой. Электронные слои часто называют энергетическими уровнями. Энергетические уровни нумеруют, начиная от ядра 1,2,3,4,5,6,7. Иногда их обозначают буквами K,L,M,N,O,P, Q.
Целое число n, обозначающее номер уровня, называется главным квантовым числом. Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней будут характеризоваться большим запасом энергии. Менее прочно связаны с ядром электроны внешнего уровня.
Число заполняемых энергетических уровней в атоме численно равно номеру периода, в котором находится элемент: у атомов элементов I периода – один энергетический уровень, II периода – два, III периода – три и т.д. Наибольшее число электронов на энергетическом уровне равно удвоенному квадрату номера уровня, т.е.
N=2n2,
где N – число электронов; n – номер уровня (считая от ядра) или главное квантовое число.
Распределение электронов в атоме по энергетическим уровням и подуровням изображают в виде электронных формул.
Очень часто структуру электронных оболочек изображают с помощью энергетических, или квантовых, ячеек – это так называемые графические электронные формулы. Каждая такая ячейка обозначается клеткой: клетка – орбиталь, стрелка – электрон, направление стрелки – направление спина, свободная клетка – свободная орбиталь, которую может занимать электрон при возбуждении. По принципу Паули в ячейке может быть один или два электрона (если два электрона, то они спарены).
3. Периодический закон и Периодическая система Д.И. Менделеева. Химия уже давно свела все многообразие веществ к элементам. В настоящее время их известно 116. Во время открытия периодического закона было известно63 элемента.
Что общего у элементов? Имеется ли связь между свойствами элементов и их атомными массами? Каким законом эту связь выразить? Многие ученые пытались дать ответы на эти вопросы и построить научно обоснованную классификацию химических элементов. Однако их попытки не увеличились успехом.
Главной характеристикой атома являлась его атомная масса (теперь положительный заряд ядра). В своей книге «Основы химии» Д.И. Менделеев писал: «Масса вещества есть именно такое свойство его, от которого должны находиться в зависимости все остальные свойства. Поэтому ближе или естественнее всего искать зависимость между свойствами и сходствами элементов, с одной стороны, и атомными их весами – с другой».
Таким образом, Д.И. Менделеев ответил на поставленные вопросы. Общее у всех элементов – атомная масса. Свойства элементов зависят от атомных масс. Форма зависимости – периодическая.
Оказалось, что и формы соединений элементов также периодически повторяются. Например, форма соединения натрия с кислородом имеет вид Na2O. Такую форму имеют и оксиды аналогов натрия: калий, рубидий, цезий – K2O, Rb2O, Cs2O. Все это дало возможность Д.И. Менделееву открытый им периодический закон сформулировать следующим образом: свойства простыл тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Периодическая система элементов является графически изображением периодического закона. Дата открытия закона и создания первого варианта периодической системы –1 марта 1869г. Над усовершенствованием периодической системы элементов Д.И.Менделеев работал до конца жизни.
Контрольные вопросы
1. Приведите примеры естественных групп химических элементов.
2. Как был сформулирован периодический закон Д.И. Менделеева?
3. Свойства каких элементов были предсказаны Д.И. Менделеевым?
Лекция 37
План
1. Химическая связь.
2. Ковалентная связь.
3. Ионная связь.
1. Химическая связь. Учение о химической связи – центральный вопрос современной химии. Без него нельзя понять причин многообразия химических соединений, механизма их образования, строения и реакционной способности.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи.
Химическая связь осуществляется валентными электронами: у s- p-элементов внешними электронами, у d-элементов внешними ns- ( n–номер внешнего уровня) и предвнешними (n-1) d-электронами, у f-элементов ns-, (n-1) d- (n-2) f-электронами.
2. Ковалентная связь. Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода из атомов:
H + H = H2, 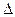 H = – 436 кДж
H = – 436 кДж
При возникновении ковалентной связи происходит перекрывание электронных облаков (орбиталей) атомов, сопровождающиеся выделением энергии. У сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм (нанометра), а после перекрывания (образования молекулы Н2) это расстояние составляет 0,074 ни. Обычно наибольшее перекрывание электронных облаков осуществляется вдоль лини, соединяющей ядра двух атомов.
Изображают образование ковалентных связей по-разному.
1. С помощью записи внешних электронов в виде точек, приставленных к химическому знаку элемента. Тогда образование молекулы водорода можно показать схемой
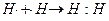
2. С помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке.
3. С помощью черточки (например, Н–Н), которая, следовательно, символизирует общую пару электронов, т.е. связующее молекулярное облако.
В молекуле хлора ковалентная связь также осуществляется с помощью двух общих электронов, или электронной пары:
неподеленная пара : : : неподеленная пара
 электронов, в ато- : Cl : +:Сl:Сl: электронов, в молекуле их 6
электронов, в ато- : Cl : +:Сl:Сl: электронов, в молекуле их 6
 ме их 3 : : :
ме их 3 : : :
неспаренный общая или
электрон поделенная
пара электронов
Химическая связь, осуществляемая общей электронной парой, называется атомной или ковалентной. Это двухэлектронная и двухцентровая (удерживает два атома) связь. Соединения с ковалентной связью называются атомными. Различают две разновидности ковалентной связи: неполярную и полярную.
У неполярной ковалентной связи электронное облако, образованное общей парой электронов, т.е. электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: H2, Cl2, O2, N2, F2 и др. У них электронные пары в одинаковой мере принадлежат обоим атомам.
У полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: HCl, H2O, H2S, NH3 и др. Образование молекулы HCl можно представить схемой
:
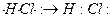
:
Ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков с противоположными спинами. Возможен и другой механизм образования ковалентной связи – донорно-акцепторной.
3. Ионная связь. Возникновение ионной связи рассмотрим на примере образования хлорида натрия NaCl. Атомы натрия и хлора, из которых образовалось это соединение, резко отличаются по относительной электроотрицательности.
Химическая связь, образованная в результате электростатического притяжения двух разноименно заряженных ионов называется ионной. Соединения, которые образовались путем притяжения ионов, называются ионными. Ионные соединения образуются элементами, которые резко отличаются по относительной электроотрицательности, например элементами главных подгрупп I II групп с элементами главных подгрупп VI и VII групп периодической системы Д.И. Менделеева.
Контрольные вопросы
1. Чем отличается ионная связь от ковалентной? Приведите примеры
соединений с такими связями.
2. Какие из двух элементов образуют соединения с преобладанием ионной или
ковалентной связей: а) рубидий с фтором; б) водород с фтором; в) водород с
углеродом?
Лекция 38
Элементарные понятия о термодинамике
План
1. Термодинамика.
2. Тепловой эффект термодинамики.
3. Сохранение и превращение энергии.
4. Закон Гесса.
5. Понятие об энтальпии.
1. Термодинамика – это наука, которая изучает законы взаимного превращения различных видов энергии при физических и химических процессах, определяет зависимость энергетического эффекта этих процессов от условий их протекания. Термодинамика также позволяет установить принципиальную возможность самопроизвольного течения любых процессов в данных условиях.
В химической термодинамике рассматриваются основные термодинамические законы применительно к химическим и физико-химическим процессам. В частности, в химической термодинамике изучается:
10 соотношение между тепловой и другими формами энергии в процессе химических реакций;
2) возможность самопроизвольного течения химической реакции в данных условиях;
3) условия, при которых химическая реакция находится в состоянии равновесия.
Теоретической основой химической термодинамики являются два основных закона естествознания – первое и второе начала термодинамики.
2. Тепловой эффект термодинамики. Количество теплоты, выделяющееся или поглощающееся при реакции, называется тепловым эффектом реакции. Если реакция протекала при постоянном объеме, то согласно уравнению тепловой эффект реакции будет  Qy =
Qy = 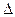 U. Если реакция протекает при постоянном давлении, то согласно уравнению тепловой эффект реакции равен Qp =
U. Если реакция протекает при постоянном давлении, то согласно уравнению тепловой эффект реакции равен Qp = 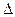 Н.
Н.
Раздел физической химии, в котором изучаются тепловые эффекты химических реакций и переходов из одного агрегатного состояния в другое, называется термохимией.
Процессы, в которых теплота выделяется, называют экзотермическими: процессы, протекающие с поглощением теплоты, называются эндотермическими.
Исторически сложилось, что в термохимии тепловые эффекты экзотермических реакций считаются положительными, а эндотермических – отрицательными. Для избежания путаницы в системе знаков термохимических и термодинамических величин, для термохимических величин иногда используют обозначения Qv и Qp
Тогда
– –
Qv = – Qv и Qv = – 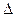 U
U
– –
Qp = Qp и Qp = – 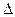 H
H
3. Сохранение и превращение энергии. Законом сохранения и превращения энергии, который устанавливает эквивалентность ее форм. Впервые этот закон в общем виде был сформулирован М.В. Ломоносовым, а впоследствии был развит в работах Р. Майера, Г. Гельмгольца, Д.Джоуля и Э.Ленца в сороковых годах прошлого века. Этот закон является универсальным и подтверждается всем опытом человечества.
Закон сохранения и превращения энергии может быть сформулирован следующим образом:
Во всех явлениях природы энергия не может исчезнуть бесследно или возникнуть из ничего. Энергия может только превращаться из одной формы в другую в строго эквивалентных соотношениях.
4. Закон Гесса. Для различных расчетов в термохимии пользуются не химическими, термохимическими уравнениями реакций. В термохимическом уравнении в правой части указывают величину и знак теплового эффекта, например:
С + О2 = СО2+ 393,8кДж
Это термохимическое уравнение следует понимать так: один моль атомов углерода (масса 12г) соединяясь с одним молем молекул кислорода (масса 32г) дает один моль молекул диоксида углерода (масса44г) и при этом выделяется 393,8кДж теплоты.
В термохимических уравнениях стехиометрические коэффициенты обозначают число участвующих в реакции молей и поэтому в них можно пользоваться дробными коэффициентами.
В термохимических уравнениях указывается также агрегатное состояние вещества и его кристаллическая форма, например:
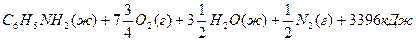
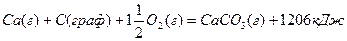
Основным законом термохимии является закон Гесса, который устанавливает, что тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от промежуточных состояний и путей перехода.
5. Понятие об энтальпии. Уравнение первого начала термодинамики применительно к процессам, в которых совершается только работа расширения (p=const) имеет следующий вид:
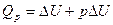
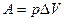
или 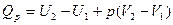
Из этого уравнения можно получить, что
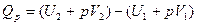
Если обозначить
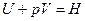
то 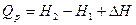
Так как p и V – параметры состояния, а U – функция состояния, то и Н также является функцией состояния.
Из уравнения видно, что теплота, поглощаемая системой при постоянном давлении, равна приросту энтальпии 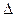 Н.
Н.
Если же процесс протекает без изменения объема, т.е. V2 – V1 = 0, то из уравнения получим
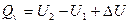
Контрольные вопросы
1. Какие принципиальные вопросы решает химическая термодинамика?
2. Как формулируется первое начало термодинамики?
3. Как связаны изменения внутренней энергии и энтальпии с тепловыми эффектами реакций?
4. Чем отличаются химические уравнения от термохимических?
Лекция 39
План
1. Классификация химических реакций по признаку обратимости.
Необратимыми называют реакции, которые протекают до конца, т.е. до полного израсходования одного из реагирующих веществ.
2KClO3 = 2 KCl + 3O2 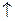

AlCl3+ 3AgNO3 + 3AgCl  + Al (NO3)3
+ Al (NO3)3
Al3+ + 3 Cl- + 3Ag+ + 3NO-3 = 3AgCl  + Al3+ + 3NO-3
+ Al3+ + 3NO-3
Ag+ + Cl- = AgCl 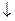
Химические реакции, протекающие при данных условиях во взаимно противоположных направлениях, называют обратимыми.
N2 + 3H2 = 2NH3 + Q
N2 + O2 = 2NO – Q
O O
∕∕ ∕∕
CH3 – C + H – O – C2H5 = CH3 –– C + H2O
\ \
OH O – C2H5
Обратимость химических реакций создаёт много проблем в химической технологии, так как для увеличения выхода продукта реакции необходимо создавать специальные условия. Для этого надо знать правила смещения химического равновесия.
Контрольные вопросы
1. Охарактеризуйте основные типы химических реакций по их важнейшим признакам. Приведите примеры.
2. Определите, к какому типу относят приведённые ниже химические реакции, и объясните их сущность: а) взаимодействие раствора хлорида железа (III) с гидроксидом натрия; б) разложение хлората калия KClO3 при нагревании; в) окисление оксида серы ( IV); г) разложение карбоната кальция при нагревании; д) взаимодействие алюминия с серой. Составьте уравнения этих реакций.
3. Какие реакции называют обратимыми и какие – необратимыми? Приведите конкретные примеры.
4. При сгорании 327 г цинка выделилось 174 кДж теплоты. Вычислите теплоту образования оксида цинка (тепловой эффект реакции).
Лекция 40
План
1. Химия в промышленности.
2. Сырьевые источники
3. Получение оксида сыра (IV).
4. Охрана окружающей среды.
1. Химия в промышленности. Задачи химических производств многообразны: это извлечение металлов из руд, синтез полимеров, лекарственных препаратов, производство важнейших неорганических веществ, стекла, минеральных удобрений, волокон, красителей, косметических средств и многое другое.
Принципиальная схема любого химического производства включает следующие этапы:
1) подготовка сырья (исходных веществ);
2) химическая переработка (проведение химических реакций);
3) выделение целевого продукта (разделение полученной смеси веществ).
Для того чтобы обеспечить оптимальную скорость реакций и высокий выход продукции, на химическом производстве увеличивают поверхность соприкосновения реагирующих веществ, повышают температуру и/или давление, а также используют катализаторы.
2. Сырьевые источники производства серной кислоты достаточно многообразны.
| ||||||
| ||||||
| ||||||
 | |||
 | |||
|
|




|

Сернокислотные заводы расположены в различных районах нашей страны. На каждом заводе используют тот или иной вид сырья, который добывают поблизости. В последние годы в развитии сернокислотного производства всё больше намечается тенденции к комплексному использованию природного сырья. Например, используют оксид серы (IV), образующийся при обжиге сульфидов цветных металлов и сероводорода, который выделяется при коксовании каменного угля или при переработке некоторых природных газов. Так соблюдается принцип комбинирования различных химических производств.
Химическая суть процессов в производстве серной кислоты сводится к окислению сырья до оксида серы (IV) и переводу его в кислоту.
3. Получение оксида сыра ( IV ). Первой стадией в производстве серной кислоты является окисление сырья до оксида серы (IV). Несмотря на то что сырьевые источники многообразны, до сих пор в качестве сырья используют преимущественно серу и серный колчедан (пирит). При этом доля колчедана в баланс сырья уменьшается, а доля серы возрастает.
Рассмотрим получение оксида серы (IV) на примере обжига серного колчедана:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Экспериментальным путём установлены закономерности изменения скорости реакции обжига пирита.
4. Охрана окружающей среды. Охране окружающей среды в нашей стране уделяется большое внимание. На сернокислотных заводах предотвратить загрязнение окружающей среды удаётся путём герметизации аппаратуры и применения газоочистительных установок.
Контрольные вопросы
1. какие этапы включают принципиальная схема химического производства?
2. Серную кислоту можно получить из следующих исходных веществ:
а) сульфида цинка; б) сероводорода; в) сульфида сурьмы Sb2S3.
Составьте уравнения соответствующих реакций.
Лекция 41
ХИМИЯ ПИЩИ
План
1. Пища – источник энергии и веществ для всех живых организмов.
2. Жиры.
3. Углеводы.
4. Белки.
5. Витамины.
1. Пища – источник энергии и веществ для всех живых организмов. Ведь она обеспечивает их жизнедеятельность. Более двух столетий в Нобелевской речи первый российский лауреат этой премии И.П. Павлов отметил, что над всеми явлениями жизни властвует поиск хлеба насущного. Он воплощает ту древнейшую связь которая объединяет все живые существа, в том числе и человека, с окружающей природой. Пища, которая попадает в организм и там претерпевает изменения, олицетворяет жизненный процесс во всей его полноте.
2. Жиры растительного и животного происхождения люди использовали с давних времен. Главная составляющая жиров – эстеры трехатомного спирта глицерина (глицерола) и карбоновых кислот, которые содержат от 5 до 24 атомов углерода в цепи.
Температура плавления жиров зависит от состава и строения кислотных остатков в их молекулах. Насыщенные жиры (они содержат остатки стеариновой и пальмитиновой кислот) обычно твердые. Растительные масла – ненасыщенные жиры, которые содержат остатки олеиновой и других высших ненасыщенных карбоновых кислот.
В любом природном жире есть и другие компоненты – красители душистые веществ. Вы, конечно, обращали на осадок который со временем образуется в бутылках с нерафинированными растительным маслом. Это фосфатиды, продукты термического разложения которых придают золотистый цвет хорошо поджаренному картофелю.
3. Углеводы – важный компонент пищи, мощный энергетический источник обеспечения жизнедеятельности организма. Вспомните: энергетический потенциал моносахарида глюкозы С6Н12О6 реализуется вследствие биохимических превращений при участии АТФ. Полученную энергии. Организм использует во время мышечных сокращений, жизненно важных процессов, биосинтеза в частности.
Животные организмы способны накапливать в печени водорастворимый полисахарид гликоген (С6Н10О5)n. Этот энергетический резерв может быть быстро мобилизован в случае необходимости компенсации внезапного недостатка глюкозы.
Резервный источник питания растений – запасы нерастворимых в воде зерен крахмала (С6Н10О5)n (какие сельскохозяйственные культуры являются источником этого полисахарида?).
4. Белки – незаменимая часть пищи. Организм использует их для построения новых клеток и замены изношенных, эти соединения принимают активное участие в обмене веществ. Диетологи небезосновательно называют их «протеинами» – первый, первостепенный.
Белки организма образуются из аминокислот – продуктов ферментативного гидролиза белков пищи. Основные источники белка животного происхождения – это мясо, рыба, сыр, яйца – важнейшие белковые продукты. В растительных продуктах тоже содержатся протеины, особенно богаты ими бобы и орехи.
5. Витамины. Роль витаминов в обеспечении нормального функционирования организма трудно переоценить. Эти соединения обеспечивают жизненно необходимые процессы в организме, принимают активное участие в обмене веществ. Поступление достаточного количества витаминов в организм возможно при условии потребления разнообразной пищи. Процессы обмена витаминов взаимосвязаны, недостаток одного из них влияет на усвоение других.
Контрольные вопросы
1. Сравните химический состав животных жиров и растительных масел.
Лекция 42
Действие моющих средств.
План
1. Состав мыла.
2. Моющее действие мыла.
3. Синтетические моющие средства.
4. Особенности современных СМС.
1. Состав мыла определяет его свойства как поверхностно-активного вещества. Чтобы постичь суть этого понятия, вспомним: поверхностное натяжение обеспечивает силу сцепления между молекулами воды и геометрическую форму поверхности – каплю.
Мыло – один из древнейших препаратов бытовой химии, эффективное средство личной гигиены, его использование является одним из критериев цивилизованности.
ПАВ снижает поверхностное натяжение на границе раздела, например вода (жидкость) – масло (жидкость), они играют роль своеобразного «мостика» между взаимонерастворимыми полярными и неполярными веществами. Чем это обусловлено? Поверхностно-активные вещества содержат в своем составе как гидрофильные, так и гидрофобные группы.
Молекулы ПАВ на границе поверхностей вода – воздух выстраиваются так, что гидрофильные группы направлены в воду, а гидрофобные выталкиваются из неё. В результате поверхность воды покрывается частоколом из молекул детергента. Такая поверхность имеет меньшее натяжение и как следствие, большую смачивающую способность.
2. Моющее действие мыла – способность очищать поверхности твердых тел от загрязнений. Процессы мытья и стирки основаны на удалении неполярных загрязняющих веществ с твёрдой поверхности и перемещении их в полярную водную фазу. Наиболее распространенные загрязнения – жировые пленки, которые содержат частички пыли, сажи.
Ассортимент современных синтетических моющих средств (СМС) поражает разнообразием. Самыми важными компонентами СМС являются поверхностно-активные вещества, консерванты, ингибиторы коррозии, антиоксиданты средства против образования накипи, красители.
3. Синтетические моющие средства значительно эффективнее, чем мыло. В частности и потому, что не теряют моющего действия в жесткой воде. Это не единственное преимущество перед мылом.
Почему мыло теряет моющую способность в жесткой воде? Вследствие реакции обмена образуются нерастворимые соли кальция и магния:
 2С17Н35СОО- + Са2+ (С17Н35СОО)2Са
2С17Н35СОО- + Са2+ (С17Н35СОО)2Са 
 2С17Н35СОО- + Mg2+ (С17Н35СОО)2Mg
2С17Н35СОО- + Mg2+ (С17Н35СОО)2Mg 
4. Особенности современных СМС. Это, прежде всего, их многофункциональность. Среди них есть универсальные, для машинной стирки, для стирки очень загрязненного белья, тонких и легкоповреждаемых тканей, стирки и отбеливание с кипячением и без него, средства для низкотемпературной стирки.
Моющая эффективность большинства ПАВ усиливается в щелочной среде и в присутствии различных электролитов. По этой причине почти во все СМС добавляют неорганические соли: сульфаты, карбонаты, полифосфаты. Именно полифосфаты в составе синтетических моющих средств становятся причиной эвтрофикации водоемов, в которые попадают сточные воды. Излишек соединений фосфора приводит к массовому развитию микроскопических водорослей и других микроорганизмов, а также бактерий, которые разлагают отмершие органические остатки. Вследствие этого расходуется значительное количество кислорода, а в воду попадают токсичные продукты распада, что ухудшает условия обитания гидробионтов.
Контрольные вопросы
1. Какие соединения в составе синтетических моющих средств вызывают
эвтрофикацию природных водоёмов?
2. Сравните мыло и СМС. Результаты сравнения оформите в виде таблицы иди
диаграммы Венна.
3. Подготовьте презентацию «Как моя семья использует мыло и синтетические
моющие средства».
Лекция 43
Пигменты и краски
План
1. Органические растворители.
2. Нефтяные растворители.
3. Токсичное действие органических растворителей.
1. Органические растворители широко применяют в технике и быту. В их состав входят представители разных классов органических соединений – углеводороды, их галогено- и нитропроизводные, спирты, эстеры, органические кислоты и их производные.
Многие органические вещества, хорошо известные используют в качестве растворителей. Например, этанол- растворитель, который применяют для изготовления духов, лечебных экстрактов и настоек, других лечебных средств. Им удаляют пятна от травы (ведь хлорофилл хорошо растворяется в этиловом спирте), фломастеров.
Спирт денатурированный, или растворитель денатурат, – жидкость с неприятным запахом, изготовленная из отходов ликероводочного или спиртового производства с добавлением веществ и красителей, что делает денатурат непригодным для употребления как напитка.
2. Нефтяные растворители – фракции нефти, получаемые её перегонкой. Они состоят из смесей индивидуальных углеводородов (парафиновых, циклопарафиновых, ароматических). Это прозрачные маслянистые жидкости с характерным запахом нефтепродуктов, легковоспламеняющиеся и токсичные. Их используют на производстве и в быту для разбавления красок, промывания деталей, удаления загрязнений и консервирующих покрытий.
Сольвент – смесь ароматических углеводородов с невысоким содержанием циклопарафинов, парафинов и ненасыщенных циклических углеводородов. Сольвент получают во время коксования каменного угля и пиролиза нефтяных фракций. Его применяют для растворения масел, битумов, каучуков, полимерных смол.
Скипидар – едва ли не самый известный среди терпеновых растворителей. Это бесцветная прозрачная летучая жидкость с характерным запахом соснового дерева. Он хорошо растворяет органические масла, жиры, смолы, канифоль. Скипидар получают из сосновой живицы перегонкой с водяным паром, а также сухой перегонкой древесины.
3. Токсичное действие органических растворителей связано с их способностью растворяться в жирах, а также летучестью. Они легко всасываются через дыхательные пути и кожу, оказывают наркотическое действие, вызывают раздражение кожи, слизистой оболочки органов дыхания, пищеварительной системы, воспалительные процессы.
В процессе образования пленочного покрытия после нанесения на поверхность лакокрасочного материала весь растворитель испаряется. Скорость и полнота этого процесса во многом определяет качество покрытия. С учетом мирового потребления лакокрасочных материалов суммарный выброс органических растворителей в атмосферу за год достигает десятков миллионов тонн. Важным аспектом решения этой проблемы является переход на использование водоэмульсионных, тиксотропных и порошковых лакокрасочных материалов, применение безвоздушных способов нанесения, распыление красок в электростатическом поле.
Контрольные вопросы
1. Какой растворитель используют в медицине для изготовления настоев
лекарственных растений?
А этанол; Б метанол; В бензин; Г бутилацетат.
2. Приведите примеры растворителей, которые извлекают фракционной
перегонкой нефти.
3. Подготовьте презентацию «Как моя семья безопасно использует
органические растворители».
Лекция 44
Тема: Химия в строительстве
План
1. Естественные и научные основы строительства
2. Химические основы строительства
3. Химические и физические процессы в строительстве
4. Виды материалов
5. Смеси
6. Растворы
7. Дисперсии
8. Легирование
9. Важнейшие строительные материалы и их соединения
10. Соли, используемые в строительстве
Виды материалов
По своему составу вещества делятся на несколько видов. Это основные вещества, смеси, химические соединения и элементы.
Смеси состоят из совокупности различных веществ и отдельных материалов. Также смеси позволяют при помощи физико-механической технологии разложить себя на отдельные вещества. Физико-механические методы разделения смесей – это дистилляция, выпаривание, фильтрование и отстаивание. Химические соединения состоят как минимум из двух разных основных веществ или химических элементов. Химическое соединение не может быть разложено на составляющие вещества при помощи физико-механических процессов, как, например, смеси. Такое разложение возможно только лишь при помощи химических процессов.
Химические элементы – это основные вещества, которые не могут быть разложены на составляющие в принципе, ни при помощи физико-механических методов, ни посредством химической реакции.
Химические элементы
В природе существует 92 химических элемента. Из этих элементов в различных пропорциях и состоят все вещества на нашей планете. Семнадцать элементов из них получены искусственным путем, то есть не встречаются в природе в чистом виде. Природные элементы состоят из 66 металлов, 16 неметаллов и 6 полуметаллов. Металлы имеют выраженный металлический блеск, хорошо проводят электрический ток и тепло. Неметаллы, среди которых преобладают газообразные и летучие элементы, преимущественно не проводят электрический ток, то есть являются диэлектриками.
Также неметаллы, как правило, плохо проводят тепло. Полуметаллы могут обладать как металлическими, так и не металлическими свойствами. Яркий пример таких элементов – это селен и кремний. Элементы обозначают, помимо их названий на разных языках, Буквенными сокращениями от названия элемента на греческом или латинском языках.
Чаще всего для определения удельной массы, плотности и других свойств вещества пользуются периодической таблицей элементов, где химические элементы размещены в порядке возрастания физических и химических свойств и разделяются на группы и подгруппы. Химические элементы состоят из атомов. Определенные атомы определенных элементов имеют сходное или идентичное строение.
Смеси
Некоторые материалы можно смешивать. При этом они не будут вступать в реакции друг с другом, а лишь находиться в перемешанном состоянии. Получаемая путем смешивания смесь не является новым веществом, поскольку возможно ее разделение на составляющие на исходные материалы при помощи физически-механических процессов. Примеры смесей – растворы, дисперсии и легирования.
Растворы
Многие твердые, жидкие и газообразные материалы и вещества могут так тонко распределяться в жидкостях, что будут существовать в них только лишь в виде отдельных молекул. В этом случае вещество находится в воде или другой жидкости в растворенном состоянии, то есть жидкость, содержащая молекулы некоего вещества, является раствором. Жидкость, в которой содержатся молекулы вещества, называют растворителем. Любое вещество растворяется в любой жидкости до определенного предела. При наступлении критической точки предела растворяемости раствор называется концентрированным. Температура растворителя влияет на верхний порог растворяемости.При повышении температуры растворителя порог растворяемости повышается. Раствор, далекий от насыщения веществом, называется разбавленным. Процесс растворения ускоряется при нагревании, помешивании и измельчении вещества. Выделение из раствора происходит при охлаждении в случае сильно концентрированных растворов и выпаривании растворителя. Яркий пример выпаривания растворителя в строительстве – обмазка битумной мастикой, Покраска дисперсными красками на водной основе и застывание бетона и растворов.Разделение двух смешанных друг с другом жидкостей можно производить с помощью перегонки, или дистилляции.Раствор жидкостей доводится до кипения, и легче испаряемая жидкость выпаривается. Затем, собранный пар охлаждается и вновь переходит в жидкое состояние. Жидкость, которая испаряется медленнее, остается в сосуде. Растворение нескольких растворенных друг в друге жидкостей производится при помощи многократной дистилляции, которую называют фракционной дистилляцией. Пример такой фракционной дистилляции – разделение сырой нефти на фракции – бензины, мазуты, смазочные материалы и битумы.
Дисперсии
Процесс, когда частицы вещества распределяются в жидкости в виде очень тонких фрагментов, не растворяясь в ней, называется дисперсией. Жидкость с распределенным в ней веществом называют дисперсионной. В случае, если тонко распределенное вещество является твердым по первоначальной структуре, такую дисперсию называют суспензией.
Если распределенное вещество является жидкостью, такую дисперсию называют эмульсией. В любой дисперсии частицы распределенного вещества со временем оседают, и образуется частичное расслоение. Поэтому перед употреблением дисперсии требуется тщательно перемешивать. Примеры дисперсий в строительстве – дисперсионные клеи и краски, сверлильные эмульсии на основе нефтепродуктов и воды для обработки металлов.
Легирование
Многие металлы в расплавленном состоянии растворяются друг в друге. После затвердевания получаемый сплав называют легированным. Свойства легированного металла зачастую значительно отличаются от свойств исходных металлов и могут превосходить их по твердости, прочности или температуре плавления. Посредством легирования создают материалы с заданными свойствами, например, сталь с присадками хрома и никеля становится устойчивой к коррозии и называется нержавеющей сталью.
Лекция 45
План
1. Основные направления химизации сельского хозяйства.
2. Удобрения и их классификация.
Химизация — это одно из направлений научно-технического прогресса, основанное на широком применении химических веществ, процессов и методов в различных отраслях, например в сельском хозяйстве.
Основные направления химизации сельского хозяйства:
- Производство минеральных макро- и микроудобрений, а также кормовых фосфатов.
- Внесение извести, гипса и других веществ для улучшения структуры почв.
- Применение химических средств защиты растений: гербицидов, зооцидов и инсектицидов и т. д.
- Использование в растениеводстве стимуляторов роста и плодоношения растений.
- Разработка способов выращивания экологически чистой сельскохозяйственной продукции.
- Повышение продуктивности животных с помощью стимуляторов роста, специальных кормовых добавок.
-Производство и применение полимерных материалов для сельского хозяйства.
-Производство материалов для средств малой механизации, использующихся в сельском хозяйстве.
Основная цель химизации сельского хозяйства — обеспечение роста производства, улучшение качества и продление сроков сохранности сельскохозяйственной продукции, повышение эффективности земледелия и животноводства.
Химическая мелиорация почв
Химическую мелиорацию проводят для улучшения качества почв с повышенной кислотностью или щелочностью. В первом случае осуществляют известкование, во втором — гипсование.
Лекция 46
Неорганические материалы
План
1. Производство стекла и керамики.
1. Производство стекла и керамики. Обычное оконное стекло – сплав различных силикатов. Получают его при сплавлении смеси белого песка, кальцинированной соды и мела в специальных печах. Реакции, происходящие при этом, можно записать в виде уравнений:
Na2CO3 + SiO2 = Na2SiO3 + CO2;
CaCO3 + SiO2 = CaSiO3 + Co2
Образующиеся соли растворяются в избытке расплавленного кремния (IV), образуя прозрачный аморфный сплав – стекло. Химический состав стекла может изменяться в широких пределах. Обычно его записывают в виде формулы
Na2O x CaO x 6SiO2.
Для получения тугоплавкого стекла вместо соды берут поташ. Из калиевого стекла изготавливают химическую посуду. Если оксид кальция заменить оксидом свинца PbO,образуется хрустальное стекло примерно такого состава:
K2O x PbO x 6SiO2 . Высокотемператуное стекло содержит в своем составе оксид бора B2O3. Оно стойко к действию химических реагентов, поэтому используется для изготовления химической посуды.
Оксиды некоторых металлов могут окрашивать стекло. Например, оксид хрома CrO3 придает стеклу зеленую окраску, а оксид кобальта СоО – синюю. При этом оксиды, растворяясь в стекле, образуют коллоидно-дисперсную систему.
Новым ценным материалом являются ситаллы – закристаллизованные стекла, получающиеся из аморфных силикатных стекол при термической обработке. Микрометаллическое строение ситаллов обусловливает их высокие механические свойства, устойчивость против тепловых ударов.
Больше значение в народном хозяйстве имеют изделия, полученные при спекании глины с оксидом кремния (IV): кирпич, огнеупорные материалы, гончарные изделия (грубая керамика), фарфор и фаянс (тонкая керамика). Изделия грубой керамики изготовляют из смеси каолина, кварца и полевых шпатов, которую обжигают при высокой температуре.
Фарфоровые и фаянсовые изделия покрывают стеклоподобным слоем – глазурью, защищающей их от действия воды, химических реагентов, а также придающей им красивый вид. Фарфор и фаянс отличаются физическими свойствами черепка: черепок фарфора плотный, фаянс – пористый. Обычный фарфор и фаянс изготовляют при спекании глинистых веществ (50%), кварца (25%) и полевого шпата (25%). Образуется смесь различных силикатов и алюминатов.
Контрольные вопросы
1. Напишите уравнения реакций между оконным стеклом и плавиковой кислотой, свинцовым стеклом и плавиковой кислотой.
2. К каким системам следует отнести окрашенное различными оксидами (например, Cr2O3) стекло?
Лекция 47
ПОЛИМЕРЫ
План
1. Важнейшие полимеры – полиэтилен и полипропилен.
1. Важнейшие полимеры – полиэтилен и полипропилен. Этилен и пропилен полимеризуются, образуя полимеры полиэтилен и полипропилен. Механизм полимеризации весьма сложен. Известны различные типы полимеризации. В самом общем виде процесс полимеризации можно изобразить 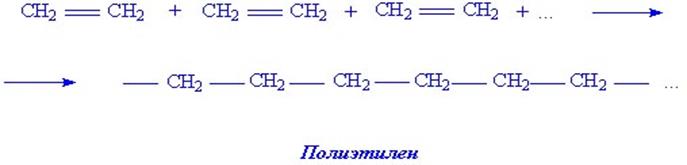
Рассмотрим пример механизма полимеризации этилена под действием свободного радикала 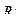 , где
, где 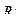 это CH3, C2H5 и т.д. Вещество, вызывающее полимеризацию называют инициатором.
это CH3, C2H5 и т.д. Вещество, вызывающее полимеризацию называют инициатором.
Итак, радикальную полимеризацию этилена под действием свободного радикала 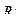 (инициатора) можно представить в виде:
(инициатора) можно представить в виде:
 CH2 = CH2 +
CH2 = CH2 + 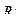 R – CH2 – CH2 –.
R – CH2 – CH2 –.
Под действием активной частицы 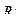 двойная связь разрывается и радикал
двойная связь разрывается и радикал 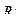 присоединяется по месту двойной связи.
присоединяется по месту двойной связи.
Образовавшаяся новая частица (новый радикал) оказывает на молекулу этилена такое же действие, как и радикал R. Углеродная цепь при этом растет:
 R – CH2 – CH2 – + CH2 = CH2 R – CH2 – CH2 – CH2– CH2–.
R – CH2 – CH2 – + CH2 = CH2 R – CH2 – CH2 – CH2– CH2–.
Подобного рода процесс происходит и дальше, пока не наступи обрыв углеродной цепи. Это может произойти или при присоединении к цепи с углеродом, имеющим свободную связь, частицы инициатора R, или при соединении двух частиц с атомами углерода со свободной связью. В обоих случаях свободные единицы валентности насыщаются:
 R – CH2 – CH2–…– CH2 – CH2–+
R – CH2 – CH2–…– CH2 – CH2–+ 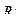
 R – CH2 – CH2 –…– CH2 –CH2– R.
R – CH2 – CH2 –…– CH2 –CH2– R.
или
 R – CH2 – CH2–… – CH2– CH2– + – CH2– CH2–…–CH2– CH2–R
R – CH2 – CH2–… – CH2– CH2– + – CH2– CH2–…–CH2– CH2–R
 R– CH2– CH2–…– CH2– CH2– CH2–CH2–…– CH2– CH2– R.
R– CH2– CH2–…– CH2– CH2– CH2–CH2–…– CH2– CH2– R.
Три точки (…) показывают, что звено – СН2 – СН2– повторяется и дальше угодно раз.
Сокращенно формулу полиэтилена записывают так: [–СН2–СН2–]n. В квадратные скобки берут элементарное звено полимера, т.е. ту часть, которая повторяется n раз и образуется из молекулы мономера. Радикалы на концах цепи не указываются, поскольку учитывая огромную молекулярную массу полимера, они не оказывают практического влияния на состав макромолекулы.
 СН3
СН3
Формула полипропилена имеет вид [–СН2– СН –]n. Элементарное звено образуется при раскрытии двойной связи в молекуле пропилена:
 СН3
СН3
 СН2 = СН – СН3 – СН2 – СН –.
СН2 = СН – СН3 – СН2 – СН –.
Полиэтилен и полипропилен – представители полимеров, являющихся основой пластмасс (пластических масс) – материалов, способных при нагревании становиться пластичными, т.е. формоваться, приобретая определенную форму, которая сохраняется и после охлаждения пластмассы.
Полиэтилен обладает высокими физико-химическими свойствами и сравнительно недорог. По химическому составу это наиболее простой полимер. В зависимости от условий полимеризации производят полиэтилен высокого и низкого давления. Первый получают под давлением 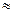 120 – 150 МПа и при температуре 100 –3000С; второй – при давлении
120 – 150 МПа и при температуре 100 –3000С; второй – при давлении  0,4МПа и комнатной температуре с применением специальных катализаторов. Молекулярная масса полиэтилена первого типа 18000 –4000, второго значительно выше – 60000–800000.
0,4МПа и комнатной температуре с применением специальных катализаторов. Молекулярная масса полиэтилена первого типа 18000 –4000, второго значительно выше – 60000–800000.
Полипропилен, сходный с полиэтиленом полимер, имеет большие перспективы применения в народном хозяйстве. Полипропилен легкий, стойкий против действия кислот, щелочей, масел, имеет температуру плавления несколько более высокую, чем полиэтилен. Она колеблется для полипропилена в интервале 160-1300С, в то время как для полиэтилена в интервале 100-1300С. Применяют полипропилен для изоляции высокочастотных кабелей и монтажных проводов, в качестве диэлектрика высокочастотных конденсаторов. Весьма перспективным является применение полипропилена для изготовления тонкостенной твердой тары, выдерживающей стерилизацию в кипящей воде. Один из его недостатков – недостаточная сопротивляемость окислению.
Полиэтилен и полипропилен – обычно ненаполненные пластические массы, состоящие только из синтетического полимера. Такой синтетический полимер часто называют синтетической смолой.
Контрольные вопросы
1. Полиэтиленовые трубы, посуду, полиэтиленовую пленку изготовляют из полимера, для которого степень полимеризации n равна 1500 –2000. Напишите схему полимеризации для полиэтилена, если n =2000.
2. Какой из известных вам полимеров наиболее устойчив против агрессивных сред?
Лекция 26
Тема: Углеводы. Классификация углеводов.
План
1. Классификация углеводов.
2. Моносахариды.
3. Глюкоза.
4. Сахароза.
5. Рибоза и дезоксирибоза.
1. Классификация углеводов. Органические вещества со сходным строением и свойствами, состав которых в большинстве случаев отражает формула Cn(H2O)m, называют углеводами.
Углеводы в зависимости от их строения можно подразделить на моносахариды, олигосахариды и полисахариды.
Схема 1
|
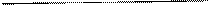


 | |||||
 | |||||
 | |||||
2. Моносахариды. Молекулы моносахаридов могут содержать от трёх атомов углерода. Названия моносахаридов оканчиваются на –оза. В зависимости от числа атомов углерода в молекуле моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы и т.д. Наибольшее значение имеют гексозы (особенно глюкоза) и пентозы.
3. Глюкоза содержится почти во всех органах зелёных растений. Особенно её много в соке винограда, поэтому глюкозу иногда называют виноградным сахаром. Мёд в основном состоит из смеси глюкозы и фруктозы. В организме человека глюкоза содержится в мышцах, в крови и в небольших количествах во всех клетках.
В природе глюкоза наряду с другими углеводами образуется в результате реакции фотосинтеза:
хлорофилл, свет
 6СО2 + 6Н2О С6Н12О6 +6О2 – Q
6СО2 + 6Н2О С6Н12О6 +6О2 – Q
4. Сахароза. Молекулы олигосахаридов состоят из нескольких остатков моносахаридов (не более 10). Наиболее распространены дисахариды – димеры, состоящие из остатков двух молекул моносахаридов. Самый известный дисахарид – сахароза. Сахароза входит в состав сока сахарной свёклы (16-20%) и сахарного тростника (14-26%). В небольших количествах она содержится с глюкозой в плодах и листьях многих зел1ныз растений.
Чистая сахароза – бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде.
5. Рибоза и дезоксирибоза. Из пентоз большой интерес представляет рибоза и дезоксирибоза, входящие в состав нуклеиновых кислот. (Название «дезоксирибоза» показывает, что по сравнению с рибозой в её молекуле на одну группу ОН меньше). Как и молекула глюкозы, молекулы рибозы и дезоксирибозы могут иметь циклическое строение:

Контрольные вопросы
1. Какие вещества относят к углеводам?
2. Как классифицируют углеводы и почему?
3. Какова роль глюкозы в живых организмах?
Лекция 27
Химические свойства альдегидоспиртов на примере глюкозы.
План
1. Химические свойства.
1.1. Взаимодействие глюкозы с гидроксидом меди (II).
1.2. Реакция глюкозы с оксидом серебра ((I).
2. Таблица
1. Химические свойства. Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов.
1.1. Взаимодействие глюкозы с гидроксидом меди (II). Налейте в пробирку 2-3 мл раствора глюкозы и столько же разбавленного раствора гидроксида натрия (NaOH) должен быть в избытке). Затем добавьте несколько капель раствора сульфита меди (II). Что представляет собой раствор синего цвета? Что доказывает данный опыт?

1.2. Реакция глюкозы с оксидом серебра (I). В две пробирки налейте по 1мл раствора нитрата серебра ((I) и добавляйте по каплям разбавленный раствор аммиака. Образующийся осадок оксида серебра ((I) растворяется в избытке водного раствора аммиака. Затем в одну пробирку прилейте 1–1,5 мл раствора, в котором массовая доля глюкозы равна 0,2, в другую – столько же раствора фруктозы. Обе пробирки поместите в сосуд с горячей водой.

Контрольные вопросы
1. Перечислите известные вам процессы брожения глюкозы и укажите их
практическое значение.
2. Какие пентозы вам известны? Изобразите их структурные формулы.
3. Подготовьте электронную презентацию по теме «Фотосинтез».
Таблица 1
Химические свойства глюкозы
Дата: 2019-02-02, просмотров: 407.