План
1. Химическая связь.
2. Ковалентная связь.
3. Ионная связь.
1. Химическая связь. Учение о химической связи – центральный вопрос современной химии. Без него нельзя понять причин многообразия химических соединений, механизма их образования, строения и реакционной способности.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи.
Химическая связь осуществляется валентными электронами: у s- p-элементов внешними электронами, у d-элементов внешними ns- ( n–номер внешнего уровня) и предвнешними (n-1) d-электронами, у f-элементов ns-, (n-1) d- (n-2) f-электронами.
2. Ковалентная связь. Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода из атомов:
H + H = H2,  H = – 436 кДж
H = – 436 кДж
При возникновении ковалентной связи происходит перекрывание электронных облаков (орбиталей) атомов, сопровождающиеся выделением энергии. У сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм (нанометра), а после перекрывания (образования молекулы Н2) это расстояние составляет 0,074 ни. Обычно наибольшее перекрывание электронных облаков осуществляется вдоль лини, соединяющей ядра двух атомов.
Изображают образование ковалентных связей по-разному.
1. С помощью записи внешних электронов в виде точек, приставленных к химическому знаку элемента. Тогда образование молекулы водорода можно показать схемой
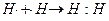
2. С помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке.
3. С помощью черточки (например, Н–Н), которая, следовательно, символизирует общую пару электронов, т.е. связующее молекулярное облако.
В молекуле хлора ковалентная связь также осуществляется с помощью двух общих электронов, или электронной пары:
неподеленная пара : : : неподеленная пара
 электронов, в ато- : Cl : +:Сl:Сl: электронов, в молекуле их 6
электронов, в ато- : Cl : +:Сl:Сl: электронов, в молекуле их 6
 ме их 3 : : :
ме их 3 : : :
неспаренный общая или
электрон поделенная
пара электронов
Химическая связь, осуществляемая общей электронной парой, называется атомной или ковалентной. Это двухэлектронная и двухцентровая (удерживает два атома) связь. Соединения с ковалентной связью называются атомными. Различают две разновидности ковалентной связи: неполярную и полярную.
У неполярной ковалентной связи электронное облако, образованное общей парой электронов, т.е. электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: H2, Cl2, O2, N2, F2 и др. У них электронные пары в одинаковой мере принадлежат обоим атомам.
У полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: HCl, H2O, H2S, NH3 и др. Образование молекулы HCl можно представить схемой
:
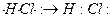
:
Ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков с противоположными спинами. Возможен и другой механизм образования ковалентной связи – донорно-акцепторной.
3. Ионная связь. Возникновение ионной связи рассмотрим на примере образования хлорида натрия NaCl. Атомы натрия и хлора, из которых образовалось это соединение, резко отличаются по относительной электроотрицательности.
Химическая связь, образованная в результате электростатического притяжения двух разноименно заряженных ионов называется ионной. Соединения, которые образовались путем притяжения ионов, называются ионными. Ионные соединения образуются элементами, которые резко отличаются по относительной электроотрицательности, например элементами главных подгрупп I II групп с элементами главных подгрупп VI и VII групп периодической системы Д.И. Менделеева.
Контрольные вопросы
1. Чем отличается ионная связь от ковалентной? Приведите примеры
соединений с такими связями.
2. Какие из двух элементов образуют соединения с преобладанием ионной или
ковалентной связей: а) рубидий с фтором; б) водород с фтором; в) водород с
углеродом?
Лекция 38
Элементарные понятия о термодинамике
План
1. Термодинамика.
2. Тепловой эффект термодинамики.
3. Сохранение и превращение энергии.
4. Закон Гесса.
5. Понятие об энтальпии.
1. Термодинамика – это наука, которая изучает законы взаимного превращения различных видов энергии при физических и химических процессах, определяет зависимость энергетического эффекта этих процессов от условий их протекания. Термодинамика также позволяет установить принципиальную возможность самопроизвольного течения любых процессов в данных условиях.
В химической термодинамике рассматриваются основные термодинамические законы применительно к химическим и физико-химическим процессам. В частности, в химической термодинамике изучается:
10 соотношение между тепловой и другими формами энергии в процессе химических реакций;
2) возможность самопроизвольного течения химической реакции в данных условиях;
3) условия, при которых химическая реакция находится в состоянии равновесия.
Теоретической основой химической термодинамики являются два основных закона естествознания – первое и второе начала термодинамики.
2. Тепловой эффект термодинамики. Количество теплоты, выделяющееся или поглощающееся при реакции, называется тепловым эффектом реакции. Если реакция протекала при постоянном объеме, то согласно уравнению тепловой эффект реакции будет  Qy =
Qy = 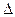 U. Если реакция протекает при постоянном давлении, то согласно уравнению тепловой эффект реакции равен Qp =
U. Если реакция протекает при постоянном давлении, то согласно уравнению тепловой эффект реакции равен Qp = 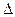 Н.
Н.
Раздел физической химии, в котором изучаются тепловые эффекты химических реакций и переходов из одного агрегатного состояния в другое, называется термохимией.
Процессы, в которых теплота выделяется, называют экзотермическими: процессы, протекающие с поглощением теплоты, называются эндотермическими.
Исторически сложилось, что в термохимии тепловые эффекты экзотермических реакций считаются положительными, а эндотермических – отрицательными. Для избежания путаницы в системе знаков термохимических и термодинамических величин, для термохимических величин иногда используют обозначения Qv и Qp
Тогда
– –
Qv = – Qv и Qv = – 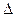 U
U
– –
Qp = Qp и Qp = – 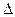 H
H
3. Сохранение и превращение энергии. Законом сохранения и превращения энергии, который устанавливает эквивалентность ее форм. Впервые этот закон в общем виде был сформулирован М.В. Ломоносовым, а впоследствии был развит в работах Р. Майера, Г. Гельмгольца, Д.Джоуля и Э.Ленца в сороковых годах прошлого века. Этот закон является универсальным и подтверждается всем опытом человечества.
Закон сохранения и превращения энергии может быть сформулирован следующим образом:
Во всех явлениях природы энергия не может исчезнуть бесследно или возникнуть из ничего. Энергия может только превращаться из одной формы в другую в строго эквивалентных соотношениях.
4. Закон Гесса. Для различных расчетов в термохимии пользуются не химическими, термохимическими уравнениями реакций. В термохимическом уравнении в правой части указывают величину и знак теплового эффекта, например:
С + О2 = СО2+ 393,8кДж
Это термохимическое уравнение следует понимать так: один моль атомов углерода (масса 12г) соединяясь с одним молем молекул кислорода (масса 32г) дает один моль молекул диоксида углерода (масса44г) и при этом выделяется 393,8кДж теплоты.
В термохимических уравнениях стехиометрические коэффициенты обозначают число участвующих в реакции молей и поэтому в них можно пользоваться дробными коэффициентами.
В термохимических уравнениях указывается также агрегатное состояние вещества и его кристаллическая форма, например:
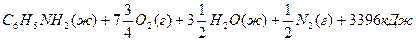
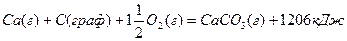
Основным законом термохимии является закон Гесса, который устанавливает, что тепловой эффект химической реакции зависит только от вида и состояния исходных веществ и конечных продуктов, но не зависит от промежуточных состояний и путей перехода.
5. Понятие об энтальпии. Уравнение первого начала термодинамики применительно к процессам, в которых совершается только работа расширения (p=const) имеет следующий вид:
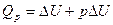
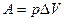
или 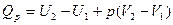
Из этого уравнения можно получить, что
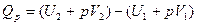
Если обозначить
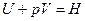
то 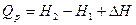
Так как p и V – параметры состояния, а U – функция состояния, то и Н также является функцией состояния.
Из уравнения видно, что теплота, поглощаемая системой при постоянном давлении, равна приросту энтальпии 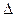 Н.
Н.
Если же процесс протекает без изменения объема, т.е. V2 – V1 = 0, то из уравнения получим
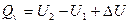
Контрольные вопросы
1. Какие принципиальные вопросы решает химическая термодинамика?
2. Как формулируется первое начало термодинамики?
3. Как связаны изменения внутренней энергии и энтальпии с тепловыми эффектами реакций?
4. Чем отличаются химические уравнения от термохимических?
Лекция 39
Дата: 2019-02-02, просмотров: 367.